Pirazina
| Pirazina | |
|---|---|
|

|

|

|
Pirazina | |
Outros nomes 1,4-Diazabenzeno, p-Diazina, 1,4-Diazina, Paradiazina, Piazina, UN 1325 | |
| Identificadores | |
| Número CAS | 290-37-9 |
| PubChem | 9261 |
| ChemSpider | 8904 |
| Número CE | 206-027-6 |
| ChEBI | CHEBI:30953 |
| ChEMBL | CHEMBL15797 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C4H4N2 |
| Masa molecular | 80,09 g/mol |
| Aspecto | Cristais brancos |
| Densidade | 1,031 g/cm3 |
| Punto de fusión | 52 °C |
| Punto de ebulición | 115 °C |
| Solubilidade en auga | Soluble |
| Acidez (pKa) | 0,37[1] (pirazina protonada) |
| Perigosidade | |
| NFPA 704 | |
| Punto de inflamabilidade | 55 °C c.c. |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
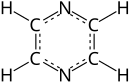
A pirazina (ou piracina) é un composto químico orgánico aromático heterocíclico coa fórmula C4H4N2.
A pirazina é unha molécula simétrica co grupo puntual D2h. O seu derivado máis coñecido é a fenazina polas súas actividades antitumorais, antibióticas e diuréticas. A pirazina ten unha natureza menos básica que a piridina, piridazina e pirimidina. A tetrametilpirazina (tamén chamada ligustrazina) pode eliminar anións superóxido e fai decrecer a produción de óxido nítrico nos leucocitos polimorfonucleares humanos,[2] e é o compoñente dalgunhas plantas medicinais utilizadas na medicina tradicional chinesa.[3]
Síntese
[editar | editar a fonte]Existen moitos métodos para a síntese orgánica de pirazina e os seus derivados. Algúns deles están entre as reaccións de síntese máis antigas que aínda se usan.
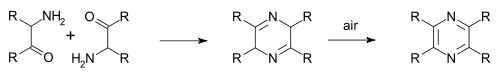
Na síntese de pirazina Staedel–Rugheimer (1876) a 2-cloroacetofenona reacciona con amoníaco formando amino cetona, despois condensa e seguidamente oxídase a pirazina [4] Unha variante é a síntese de pirazina de Gutknecht (1879), tamén baseada nesta autocondensación, pero que difire no modo en que se sintetiza a alfa-cetoamina.[5][6]
A síntese de Gastaldi (1921) é outra variante:[7][8]
Notas
[editar | editar a fonte]- ↑ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ↑ Zhaohui Zhanga, Taotao Wei, Jingwu Houb, Gengshan Lia, Shaozu Yua, Wenjuan Xinb (18 de abril de 2003). "Tetramethylpyrazine scavenges superoxide anion and decreases nitric oxide production in human polymorphonuclear leukocytes". Life Sciences (en inglés) 72 (22): 2465–2472. doi:10.1016/S0024-3205(03)00139-5.
- ↑ http://www.itmonline.org/arts/ligustrazine.htm
- ↑ Ueber die Einwirkung von Ammoniak auf Chloracetylbenzol (pp. 563–564) W. Staedel, L. Rügheimer doi 10.1002/cber.187600901174 Berichte der deutschen chemischen Gesellschaft Volume 9, Issue 1, pp. 563–564, 1876
- ↑ Mittheilungen Ueber Nitrosoäthylmethylketon H. Gutknecht Berichte der deutschen chemischen Gesellschaft Volume 12, Issue 2 , pp. 2290–2292, 1879 doi 10.1002/cber.187901202284
- ↑ Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2
- ↑ G. Gastaldi, Gazz. Chim. Ital. 51, (1921) 233
- ↑ Amines: Synthesis, Properties and Applications Stephen A. Lawrence 2004 Cambridge University Press ISBN 0-521-78284-8
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Pirimidina, un análogo co segundo átomo de nitróxeno en posición 3
- Piridazina, un análogo co segundo átomo de nitróxeno en posición 2
- Piridina, un análogo cun só átomo de nitróxeno
- Benceno, un análogo sen ningún átomo de nitróxeno
- Metoxipirazinas
- Alqulpirazinas