Lactona


Unha lactona é un éster cíclico,[1] que se pode considerar o produto da condensación dun grupo alcohólico (-OH) e un grupo carboxilo (-COOH) pertencentes á mesma molécula. Caracterízase por presentr un anel formado por dous ou máis átomos de carbono e un só osíxeno, que leva un grupo cetona (C=O) nun dos átomos de carbono adxacentes ao outro osíxeno.
Nomenclatura
[editar | editar a fonte]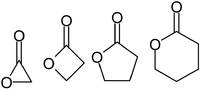
As lactonas noméanse xeralmente segundo o nome da molécula ácida precursora (aceto = 2 carbonos, propio = 3, butiro = 4, valero = 5, capro = 6 etc.), co sufixo -lactona ao final e un prefixo de letra grega que especifica o número de carbonos no heterociclo, é dicir, a distancia entre o -OH relevante para a formación da lactona e o grupo -COOH no seu esqueleto. O primeiro átomo de carbono despois do grupo -COOH do composto orixinal denomínase α, o segundo β, e así sucesivamente. Por tanto, os prefixos tamén indican o tamaño do anel da lactona: α-lactona = anel de 3 membros, β-lactona = de 4 membros, γ-lactona = de 5 etc.
Outro sufixo utilizado para as lactonas é -ólido, utilizado para os nomes de clases de substancias, como por exemplo: butenólido, macrólido, cardenólido ou bufadienólido.
Etimoloxía
[editar | editar a fonte]O nome lactona deriva do composto cíclico chamado lactida, que se forma por deshidratación do ácido 2-hidroxipropanoico (ácido láctico) CH3-CH(OH)-COOH. O ácido láctico, á súa vez, recibe ese nome porque foi orixinalmente illado do leite acedo. Unha deshidratación interna na mesma molécula de ácido láctico orixinará unha alfa-propiolactona, que é unha lactona cun anel de 3 membros.
Fontes naturais
[editar | editar a fonte]As lactonas son común entre os seres vivos. Moitos compostos importantes son lactonas, como o ácido ascórbico e outras lactonas de azucres ácidos. A lactona 3-metil-4-octanólido atópase nos carballos e noutras plantas, e dálle aroma ao whisky (gardado en bocois de madeira de carballo [2][3]).
Síntese
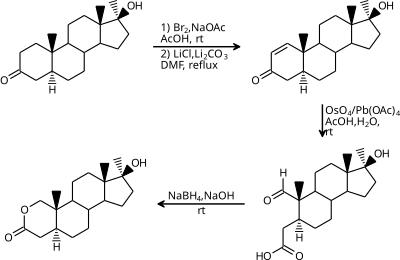
[editar | editar a fonte]Para a síntese de lactonas poden aplicarse moitos métodos da síntese de ésteres. Por exemplo, na síntese industrial de oxandrolona a reacción básica para a formación da lactona é unha redución orgánica- esterificación:[4]
Na halolactonización, un alqueno é atacado por un halóxeno por medio dunha adición electrofílica co intermediato catiónico atrapado intramolecularmente por un ácido carboxílico adxacente, como por exemplo nesta iodolactonización:[5]
Outro método específico denomínase esterificación de Yamaguchi.
Reaccións
[editar | editar a fonte]A estrutura máis estable das lactonas é a dos aneis de 5 membros das γ-lactonas e a dos de 6 membros das δ-lactonas porque, como en todas as moléculas cíclicas orgánicas, os aneis dese tamaño minimizan a tensión dos ángulos de enlace. As γ-lactonas son tan estables que, en presenza de ácidos diluídos a temperatura moderada, os 4-hidroxiácidos (R-CH(OH)-(CH2)2-COOH) sofren inmediatamente unha espontánea esterificación e ciclación para formar unha lactona. As β-lactonas existen, pero só poden obterse por métodos especiais. As α-lactonas poden detectarse por espectrometría de masas como especies químicas transitorias nalgunhas reaccións.[6]
As reaccións das lactonas son similares ás dos ésteres, como se exemplifica para as gamma-lactonas nas seguintes seccións:
Hidrólise
[editar | editar a fonte]Ao quentar unha lactona cunha base (hidróxido de sodio) hidrolízase orixinando o composto orixinal do que procede, é dicir, o composto de cadea liñal bifuncional (cos dous grupos químicos que reaccionaron formando a lactona). Unha vez en forma de ésteres de cadea liñal, a reacción de hidrólise-condensación das lactonas é reversible, e está en equilibrio químico. Porén, a constante de equilibrio da reacción de hidrólise das lactonas é menor cá do éster de cadea liñal, é dicir, os produtos (hidroxiácidos) están menos favorecidos no caso das lactonas. Isto débese a que, aínda que as entalpías da hidrólise de ésteres e lactonas son case iguais, a entropía da hidrólise de lactonas é menor cá entropía dos ésteres de cadea liñal. Os ésteres de cadea liñal orixinan dous produtos na súa hidrólise, facendo que o cambio de entropía sexa máis favorable ca no caso das lactonas, as cales orixinan un só produto.
Redución
[editar | editar a fonte]Unha lactona pode ser reducida a un diol utilizando hidruro de litio alumino en éter seco. A reacción de redución rompe primeiro o enlace éster da lactona, e despois reduce o grupo carboxilo a alcohol (-OH). Por exemplo, as gamma-lactonas redúcense a butan-1,4-diol, (CH2(OH)-(CH2)2-CH2(OH).
Aminólise
[editar | editar a fonte]As lactonas tamén reaccionan con amonio etanólico, que primeiro rompe o enlace éster e despois reaciona co grupo carboxilo -COOH, debido ás propiedades básicas do amonio, para formar un grupo disfuncional, é dicir, alcohol e amida. As gamma-lactonas reaccionan rendendo CH2(OH)-(CH2)2-CO-NH2.
Reacción de Michael
[editar | editar a fonte]As lactonas sesquiterpenos, que se encontran en moitas plantas, poden reaccionar con outras moléculas pola reacción de Michael.
Aplicacións
[editar | editar a fonte]Prevención da formación de biofilmes
[editar | editar a fonte]As furanonas brominadas mostraron certa efectividade na prevención da formación de biofilmes (capas formadas polo crecemento bacteriano sobre diversas superficies). Unha especie, a Salmonella enterica serovar Typhimurium mostrou un incremento da súa susceptibilidade ao tratamento antimicrobiano.[7]
Exemplos
[editar | editar a fonte]-
γ-butirolactona (GBL)
Dilactonas
[editar | editar a fonte]Conteñen dous ésteres cíclicos intramoleculares.
- Ácido eláxico (ácido hexahidroxidifénico dilactona)
- Ácido flavogalónico dilactona, que se pode encontrar en sementes de Rhynchosia volubilis e en Shorea laeviforia
- Lactida
- Ácido tergálico dilactona, que se pode encontrar en sementes de Rhynchosia volubilis
- Ácido valoneico dilactona, que se illou da cerna de Shorea laeviforia
Notas
[editar | editar a fonte]- ↑ March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure Michael B. Smith, Jerry March Wiley-Interscience, 5th edition, 2001, ISBN 0-471-58589-0
- ↑ The whiskey lactones
- ↑ "Whiskey barrels". Arquivado dende o orixinal o 07 de decembro de 2011. Consultado o 10 de decembro de 2011.
- ↑ Development of a Commercial Process to Produce Oxandrolone John E. Cabaj, David Kairys, and Thomas R. Benson Org. Process Res. Dev.; 2007; 11(3) pp 378 - 388; (Article) doi 10.1021/op060231b
- ↑ Organic Syntheses, Coll. Vol. 7, p.164 (1990); Vol. 64, p.175 (1986) Ligazón.
- ↑ Detlef Schröder, Norman Goldberg, Waltraud Zummack, Helmut Schwarz, John C. Poutsma and Robert R. Squires (1997), Generation of α-acetolactone and the acetoxyl diradical •CH2COO• in the gas phase. International Journal of Mass Spectrometry and Ion Processes, Volumes 165-166, November issue, Pages 71-82. doi:10.1016/S0168-1176(97)00150-X
- ↑ Janssens JC, Steenackers H, Robijns S, Gellens E, et. al. (2008), Brominated furanones inhibit biofilm formation by Salmonella enterica serovar Typhimurium. Appl Environ Microbiol. 2008 Nov. 74(21):6639-48. PMID 18791004
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Lactama, unha amida cíclica
- Lactima, unha imida cíclica
- N-acil homoserina lactona