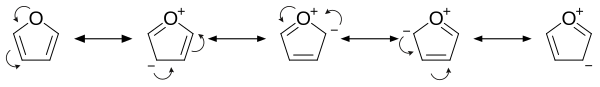Furano
| Furano | |
|---|---|
|

|
|
|
Furano | |
Oxol | |
Outros nomes Furfurán | |
| Identificadores | |
| Número CAS | 110-00-9 |
| PubChem | 8029 |
| ChemSpider | 7738 |
| KEGG | C14275 |
| ChEBI | CHEBI:35559 |
| ChEMBL | CHEMBL278980 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
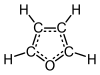
| Fórmula molecular | C4H4O |
| Masa molar | 68,07 g mol−1 |
| Aspecto | Incoloro, líquido volátil |
| Densidade | 0,936 g/mL |
| Punto de fusión | −856 °C; −1 509 °F; −583 K |
| Punto de ebulición | 313 °C; 595 °F; 586 K |
| Perigosidade | |
| Frases R | R26/27/28, R45 |
| Frases S | S16, S37, S45, S28 |
| NFPA 704 | |
| Punto de inflamabilidade | −69 °C; −92 °F; 204 K |
| Límites de explosividade | Inferior:2,3%, superior:14.3% a 20 °C |
| LD50 | > 2 g/kg (rata) |
| Estrutura | |
| C2v | |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O furano é un composto heterocíclico orgánico, que consta dun anel aromático de cinco membros con catro átomos de carbono e un de oxíxeno. A clase de compostos que conteñen eses aneis tamén se denominan furanos.
O furano é un líquido incoloro, inflamable, moi volátil cun punto de ebulición próximo á temperatura ambiente dunha habitación. É soluble en solventes orgánicos comúns, como o alcohol, éter, e acetona, pero é lixeiramenrte soluble en auga.[1] É un composto tóxico e pode ser carcinóxeno para os humanos. O furano utilízase como material inicial para a obtención de compostos químicos especializados.[2]
Historia[editar | editar a fonte]
O nome furano procede do latín furfur, que significa farelo.[3] O primeiro derivado do furano foi descrito como ácido 2-furoico por Carl Wilhelm Scheele en 1780. Outro importante derivado, o furfural, foi descuberto por Johann Wolfgang Döbereiner en 1831 e caracterizado nove anos despois por John Stenhouse. O propio furano foi preparado por primeira vez por Heinrich Limpricht en 1870, aínda que o chamou tetrafenol.[4][5]
Produción[editar | editar a fonte]
Industrialmente, o furano é fabricado por medio da descarbonilación catalizada por paladio do furfural, ou pola oxidación catalizada por cobre do 1,3-butadieno:[2]
No laboratorio, o furano pode obterse a partir do furfural por oxidación do ácido furan-2-carboxílico, seguida de descarboxilación.[6] Pode tamén prepararse directamente por descomposición térmica de materiais que conteñan pentosas, sólidos celulósicos especialmente madeira de piñeiro.
Síntese de furanos[editar | editar a fonte]
A síntese de Feist–Benary é unha maneira clásica de sintetizar furanos, aínda que se desenvolveron moitas sínteses.[7] Un dos métodos de síntese máis simples de furanos é a reacción de 1,4-dicetonas con pentóxido de fósforo (P2O5) na síntese de Paal–Knorr. A reacción de formación de tiofeno de 1,4-dicetonas con reactivo de Lawesson tamén forma furanos como subprodutos. Existen moitas rutas para a síntese de furanos substituídos.[8]
Química[editar | editar a fonte]
O furano é aromático porque un dos pares solitarios de electróns do átomo de oxíxeno está delocalizado no anel, creando un sistema aromáico 4n+2 (ver regra de Hückel) similar ao benceno. Debido á súa aromaticidade, a molécula é plana e carece de dobres enlaces discretos. O outro par solitario de electróns do átomo de oxixeno esténdese no plano do sistema de aneis planos. A súa hibridación sp2 permite que un dos pares solitarios do oxíxeno se encontre nun orbital p e así pode interaccionar no sistema π.
Debido á súa aromaticidade, o comportamento do furano é bastante diferente do que presenta éteres heterocíclicos máis típicos como o tetrahidrofurano.
- É considerablemente máis reactivo que o benceno en reaccións de substitución electrófila, debido aos efectos de doazón de electróns do heteroátomo de oxíxeno. O exame dos contribuídores de resonanacia mostra o incremento de densidade electrónica do anel, que leva a incrementar as proporcións de substitución electrofílica.[9]
- O furano serve como un dieno nas reaccións de Diels-Alder con dienófilos deficientes en electróns como o etil (E)-3-nitroacrilato.[10] O produto de reacción é unha mestura de isómeros con preferencia polo endo isómero:

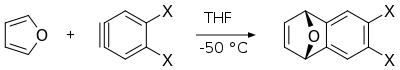
- A reacción de Diels-Alder do furano con arinos proporciona os derivados correspondentes de dihidronaftalenos, os cales son útiles intermediarios na síntese doutros compostos aromáticos policíclicos.[11]
- A hidroxenación dos furanos rende secuencialmente dihidrofuranos e tetrahidrofuranos.
- Na reacción de Achmatowicz, os furanos son convertidos en compostos dihidropiranos.
Seguridade[editar | editar a fonte]
O furano encóntrase en alimentos comerciais tratados con calor e prodúcese por medio de degradación térmica de constituíntes dos alimentos naturais.[12][13] Pode encontrarse no café torrado, café instantáneo e alimentos de bebé procesados.[13][14][15] As investigacións indicaron que o café feito en máquinas de café expreso, e, sobre todo, o feito utilizando cápsulas, contén máis furano que o feito con cafeteiras eléctricas de goteo tradicionais, aínda que os seus niveis están aínda dentro dos límites de seguridade considerados saudables.[16]
A exposición de ratas e ratos ao furano a doses 2000 veces maiores do nivel proxectado para a exsposición humana a partir de alimentos incrementa neses animais o risco de ter tumores hepatocelulares e, en ratas, o de ter tumores do conduto biliar.[17] Por tanto, o furano está na lista de posibles carcinóxenos humanos.[17]
Na combustión de residuos sólidos urbanos que conteñen plásticos PVC poden orixinarse furanos e dioxinas.[18]
Notas[editar | editar a fonte]
- ↑ Hans Dieter Jakubke; Hans Jeschkeit (1994). Concise Encyclopedia of Chemistry. Walter de Gruyter. pp. 001–1201. ISBN 0-89925-457-8.
- ↑ 2,0 2,1 H. E. Hoydonckx, W. M. Van Rhijn, W. Van Rhijn, D. E. De Vos, P. A. Jacobs (2005), "Furfural and Derivatives", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a12_119.pub2 [1]
- ↑ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006. ISBN 0-444-52239-5.
- ↑ Limpricht, H. (1870). "Ueber das Tetraphenol C4H4O". Berichte der deutschen chemischen Gesellschaft 3 (1): pp. 90–91. doi:10.1002/cber.18700030129.
- ↑ Rodd, Ernest Harry (1971). Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier.
- ↑ Wilson, W.C. (1941). "Furan". Org. Synth. cv1p0274.
- ↑ Hou XL, Cheung HY, Hon TY, Kwan PL, Lo TH, Tong SY, Wong HNC (1998). "Regioselective syntheses of substituted furans". Tetrahedron 54 (10): 1955–2020. doi:10.1016/S0040-4020(97)10303-9.
- ↑ Katritzky, Alan R. (2003). "Synthesis of 2,4-disubstituted furans and 4,6-diaryl-substituted 2,3-benzo-1,3a,6a-triazapentalenes". Arkivoc 2004 (2): 109. doi:10.3998/ark.5550190.0005.208.
- ↑ Bruice, Paula Y. (2007). Organic Chemistry (Fifth ed.). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 0-13-196316-3.
- ↑ Masesane I, Batsanov A, Howard J, Modal R, Steel P (2006). "The oxanorbornene approach to 3-hydroxy, 3,4-dihydroxy and 3,4,5-trihydroxy derivatives of 2-aminocyclohexanecarboxylic acid". Beilstein Journal of Organic Chemistry 2 (9): 9. PMC 1524792. PMID 16674802. doi:10.1186/1860-5397-2-9.
- ↑ M.A. Filatov, S. Baluschev, I.Z. Ilieva, V. Enkelmann, T. Miteva, K. Landfester, S.E. Aleshchenkov, A.V. Cheprakov (2012). "Tetraaryltetraanthra[2,3]porphyrins: Synthesis, Structure, and Optical Properties". J. Org. Chem. 77 (24): 11119–11131. doi:10.1021/jo302135q.
- ↑ Anese, M; Manzocco, L; Calligaris, S; Nicoli, MC (2013). "Industrially Applicable Strategies for Mitigating Acrylamide, Furan and 5-Hydroxymethylfurfural in Food". Journal of Agricultural and Food Chemistry 61 (43): 130528102950009. PMID 23627283. doi:10.1021/jf305085r.
- ↑ 13,0 13,1 Moro, S; Chipman, JK; Wegener, JW; Hamberger, C; Dekant, W; Mally, A (2012). "Furan in heat-treated foods: Formation, exposure, toxicity, and aspects of risk assessment". Molecular nutrition & food research 56 (8): 1197–211. PMID 22641279. doi:10.1002/mnfr.201200093.
- ↑ European Food Safety Authority (2011). "Update on furan levels in food from monitoring years 2004-2010 and exposure assessment". EFSA Journal 9 (9): 2347. doi:10.2903/j.efsa.2011.2347.
- ↑ Waizenegger, J; Winkler, G; Kuballa, T; Ruge, W; Kersting, M; Alexy, U; Lachenmeier, DW (2012). "Analysis and risk assessment of furan in coffee products targeted to adolescents". Food Additives & Contaminants: Part A 29 (1): 19–28. PMID 22035212. doi:10.1080/19440049.2011.617012.
- ↑ "Espresso makers: Coffee in capsules contains more furan than the rest", Science Daily, April 14, 2011
- ↑ 17,0 17,1 Bakhiya, N; Appel, KE (2010). "Toxicity and carcinogenicity of furan in human diet". Archives of toxicology 84 (7): 563–78. PMID 20237914. doi:10.1007/s00204-010-0531-y.
- ↑ Colin Baird. Química ambiental. Google books. Páxina 356. Cap. 6. Compuestos químicos tóxicos.