Clatrina
Clatrina, polipéptido lixeiro (Lca)
| |
| Identificadores | |
| Símbolo | CLTA |
| Entrez | 1211 |
| HUGO | 2090 |
| OMIM | |
| RefSeq | NM_007096 |
| UniProt | P09496 |
| Outros datos | |
| Locus | Cr. 12 q23-q24 |
Clatrina, polipéptido lixeiro (Lcb)
| |
| Identificadores | |
| Símbolo | CLTB |
| Entrez | 1212 |
| HUGO | 2091 |
| OMIM | |
| RefSeq | NM_001834 |
| UniProt | P09497 |
| Outros datos | |
| Locus | Cr. 4 q |
Clatrina, cadea lixeira
| |
| Identificadores | |
| Símbolo | Clathrin_lg_ch |
| Outros datos | |
Clatrina, polipéptido pesado (Hc)
| |
| Identificadores | |
| Símbolo | CLTC |
| Símbolos alt. | CLTCL2 |
| Entrez | 1213 |
| HUGO | 2092 |
| OMIM | |
| RefSeq | NM_004859 |
| UniProt | Q00610 |
| Outros datos | |
| Locus | Cr. 17 q11-qter |
Clatrina, similar ao polipéptido pesado 1
| |
| Identificadores | |
| Símbolo | CLTCL1 |
| Símbolos alt. | CLTCL |
| Entrez | 8218 |
| HUGO | 2093 |
| OMIM | |
| RefSeq | NM_001835 |
| UniProt | P53675 |
| Outros datos | |
| Locus | Cr. 22 q11.2 |

| |
| dominio terminal de clatrina acomplexado con tlpwdlwtt | |
Repetición en propulsor de clatrina
| |
| Identificadores | |
| Símbolo | Clathrin_propel |
| Outros datos | |

| |
| dominio terminal de clatrina acomplexado con tlpwdlwtt | |
Enlazador (linker) da cadea pesada de clatrina
| |
| Identificadores | |
| Símbolo | Clathrin-link |
| Outros datos | |
A clatrina é unha proteína que ten unha importancia fundamental para a formación de vesículas revestidas. A clatrina foi illada por primeira vez por Barbara Pearse en 1975.[1] Ten forma de tríscele composto por tres cadeas pesadas de clatrina e tres lixeiras. Cando os trísceles interaccionan forman unha retícula poliédrica que rodea a vesícula como un revestimento. As proteínas de recubrimento, como a clatrina, utilízanse para construír pequenas vesículas para transportar moléculas con seguridade dentro da célula ou entre células. A endocitose e exocitose de vesículas permite que as células transfiran nutrientes, importen receptores de sinalización celular, medien unha resposta inmunitaria despois de sondear o mundo extracelular, e eliminen os residuos celulares que quedan despois da inflamación dos tecidos. En ocasións, este mecanismo tamén proporciona unha vía para o ataque de patóxenos ou toxinas.
Estrutura[editar | editar a fonte]
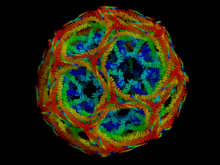
O tríscele de clatrina está composto por tres cadeas pesadas de clatrina e tres cadeas lixeiras que interaccionan polos seus extremos C-terminais. As tres cadeas pesadas proporcionan o esqueleto estrutural da retícula de clatrina, e as tres lixeiras pénsase que regulan a formación e desemsamblaxe da retícula de clatrina. A cadea pesada de clatrina pode desglosarse en múltiples subdominios, comezando polo dominio N-terminal, seguidos dos dominios chamados nocello, perna distal, xeonllo, perna proximal e de trimerización. O dominio N-terminal consiste nunha estrutura de tipo propulsor-β de sete pas. Os outros dominios forman unha superhélice de hélices alfa curtas. Isto determinouse orixinalmente a partir da estrutura do dominio da perna proximal que identificaba e está composto dun pequeno módulo estrutural denominado motivos repetidos da cadea pesada de clatrina. As cadeas lixeiras únense principalmente á porción da perna proximal da cadea pesada e establecen algunhas interaccións preto do dominio de trimerización. Cando os trísceles se ensamblan en disolución, poden interaccionar con bastante flexibilidade para formar aneis de 6 lados, que orixinan unha retícula máis plana, ou aneis de 5 lados, que son necesarios para a formación de retículas curvadas. Cando se conectan moitos trísceles, poden formar unha estrutura similar a unha cesta.
A estrutura que se mostra arriba, está formada por 36 trísceles, un dos cales está resaltado en verde. Cando os trísceles están en disolución, poden interaccionar con bastante flexibilidade para formar ou ben aneis de 6 lados que dan lugar a unha superficie máis plana ou ben de 5 lados con curvaturas maiores. Nunha célula, un tríscele que flote no citoplasma únese a unha proteína adaptadora, unindo un dos seus tres pés á membrana. Este tríscele unirase a outros trísceles unidos a membranas para formar unha retícula ou entramado redondeado de hexágonos e pentágonos, parecidos aos paneis que forman un balón de fútbol, que empuxan a membrana formando un avultamento invaxinado ou evaxinado. Realizando diferentes combinacións de aneis de 5 e 6 lados, poden ensamblarse vesículas de diferentes tamaños. A estrutura mostrada aquí representa a segunda menor posible estrutura en cesta, que en realidade é demasiado pequena para poder conter unha vesícula funcional. Creouse no laboratorio reconstituíndo trísceles sen vesícula lipídica. A cesta de clatrina máis pequena comunmente fotografada, chamada minirrecubrimento, ten 12 pentágonos e só dous hexágonos. Probablemente non se forman a partir da proteína nativa cestas de clatrina de tamaño aínda menor, sen ningún hexágono, porque os pés dos trísceles son demasiado voluminosos.
Funcións[editar | editar a fonte]
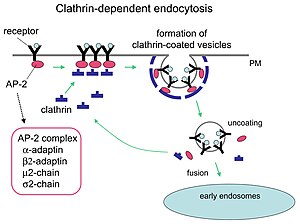
Como moitas proteínas, a clatrina representa un caso perfecto de forma adaptada a unha función. Desempeña un importante papel en dar forma ás vesículas arredondadas no citoplasma para o tráfico intracelular. As vesículas recubertas de clatrina seleccionan selectivamente o cargamento que levarán na membrana plasmática, na cara trans do aparato de Golgi, e nos compartimentos endosómicos de moitas vías de tráfico de membranas. Unha vez que unha vesícula se evaxina no citoplasma, o recubrimento da vesícula desensámblase rapidamente, o que permite que a clatrina se recicle mentres a vesícula se transporta a diversos lugares da célula. Hai moléculas adaptadoras responsables da autoensamblaxe e recrutamento. Dous exemplos de proteínas adaptadoras son a AP180 [2] e a epsina.[3][4][5] A AP180 utilízase na formación de vesículas sinápticas. Recruta a clatrina nas membranas e tamén promove a súa polimerización. A epsina tamén recruta a clatrina nas membranas e promove a súa polimerización, pero ademais pode axudar a deformar a membrana, e así as vesículas revestidas de clatrina poden desprenderse. Na célula, un tríscele que flota no citoplasma únese a unha proteína adaptadora, unindo un dos seus pés á membrana. O tríscele únese a outros tamén unidos á membrana para formar unha retícula poliédrica, que fai que a membrana forme un avultamento. O tríscele non se une directamente á membrana, senón ás proteínas adaptadoras, que son as que recoñecen as moléculas da superficie da membrana.
A clatrina ten outra función ademais de recubrir orgánulos. Nas células que non se dividen a formación de vesículas revestidas de clatrina ocorre continuamente. A formación de vesículas recubertas de clatrina detense nas células que están a realizar a mitose. Durante a mitose, a clatrina únese ao aparato do fuso. A clatrina axuda a congregación dos cromosomas ao estabilizar as fibras do fuso mitótico. A clatrina únese directamente polo seu dominio amino terminal da súa cadea pesada. Durante a mitose a clatrina únese directamente aos microtúbulos ou a proteínas asociadas aos microtúbulos. A estabilización das fibras ciinetocóricas require a estrutura trimérica da clatrina para que se estabilicen as fibras.[6]
A endocitose mediada por clatrina regula moitos procesos fisiolóxicos celulares como a introdución na célula de factores de crecemento e receptores, entrada de patóxenos, e a transmisión sináptica. Crese que os patóxenos que invaden as células utilizan a vía dos nutrients para conseguir acceder aos mecanismos de replicación da célula. Certas moléculas de sinalización celular abren a vía dos nutrientes. Existen dous compostos químicos chamados Pitstop 1 e Pitstop 2, que son inhibidores selectivos da clatrina, que poden interferir coa actividade patoxénica, e así protexen ás células contra a invasión. Estes dous compostos bloquean selectivamente a asociación de ligandos endocíticos co dominio terminal da clatrina.[7]
Notas[editar | editar a fonte]
- ↑ Pearse BM (1976). "Clathrin: a unique protein associated with intracellular transfer of membrane by coated vesicles". Proceedings of the National Academy of Sciences of the United States of America 73 (4): 1255–9. PMC 430241. PMID 1063406. doi:10.1073/pnas.73.4.1255.
- ↑ McMahon HT. "Clathrin and its interactions with AP180.". MRC Laboratory of Molecular Biology. Arquivado dende o orixinal o 01 de maio de 2009. Consultado o 05 decembro 2012.
micrographs of clathrin assembly
- ↑ McMahon HT. "Epsin 1 EM gallery". MRC Laboratory of Molecular Biology,. Arquivado dende o orixinal o 02 de xaneiro de 2009. Consultado o 2009-04-17.
micrographs of vesicle budding
- ↑ Ford MG, Pearse BM, Higgins MK, Vallis Y, Owen DJ, Gibson A, Hopkins CR, Evans PR, McMahon HT (2001). "Simultaneous binding of PtdIns(4,5)P2 and clathrin by AP180 in the nucleation of clathrin lattices on membranes" (PDF). Science 291 (5506): 1051–5. PMID 11161218. doi:10.1126/science.291.5506.1051. Arquivado dende o orixinal (PDF) o 21 de novembro de 2008. Consultado o 05 de decembro de 2012.
- ↑ Higgins MK, McMahon HT (2002). "Snap-shots of clathrin-mediated endocytosis" (PDF). Trends in Biochemical Sciences 27 (5): 257–63. PMID 12076538. doi:10.1016/S0968-0004(02)02089-3. Arquivado dende o orixinal (PDF) o 21 de novembro de 2008. Consultado o 05 de decembro de 2012.
- ↑ Royle SJ, Bright NA, Lagnado L (2005). "Clathrin is required for the function of the mitotic spindle". Nature 434 (7037): 1152–1157. PMID 15858577. doi:10.1038/nature03502.
- ↑ Role of the Clathrin Terminal Domain in Regulating Coated Pit Dynamics Revealed by Small Molecule Inhibition|Cell, Volume 146, Issue 3, 471-484, 5 August 2011 Abstract
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Wakeham DE, Chen CY, Greene B, Hwang PK, Brodsky FM (2003). "Clathrin self-assembly involves coordinated weak interactions favorable for cellular regulation". The EMBO Journal 22 (19): 4980–90. PMC 204494. PMID 14517237. doi:10.1093/emboj/cdg511.
- Ford MG, Mills IG, Peter BJ, Vallis Y, Praefcke GJ, Evans PR, McMahon HT (2002). "Curvature of clathrin-coated pits driven by epsin". Nature 419 (6905): 361–6. PMID 12353027. doi:10.1038/nature01020.
- Fotin A, Cheng Y, Sliz P, Grigorieff N, Harrison SC, Kirchhausen T, Walz T (2004). "Molecular model for a complete clathrin lattice from electron cryomicroscopy". Nature 432 (7017): 573–9. PMID 15502812. doi:10.1038/nature03079.
- Mousavi SA, Malerød L, Berg T, Kjeken R (2004). "Clathrin-dependent endocytosis". The Biochemical Journal 377 (Pt 1): 1–16. PMC 1223844. PMID 14505490. doi:10.1042/BJ20031000.
- Smith CJ, Grigorieff N, Pearse BM (1998). "Clathrin coats at 21 A resolution: a cellular assembly designed to recycle multiple membrane receptors". The EMBO Journal 17 (17): 4943–53. PMC 1170823. PMID 9724631. doi:10.1093/emboj/17.17.4943. (Model of Clathrin assembly)
- Pérez-Gómez J, Moore I (2007). "Plant endocytosis: it is clathrin after all". Current Biology : CB 17 (6): R217–9. PMID 17371763. doi:10.1016/j.cub.2007.01.045. (Review on involvement of clathrin in plant endocytosis - proven recently)
- Royle SJ, Bright NA, Lagnado L (2005). "Clathrin is required for the function of the mitotic spindle". Nature 434 (7037): 1152–7. PMID 15858577. doi:10.1038/nature03502.
- Knuehl C, Chen CY, Manalo V, Hwang PK, Ota N, Brodsky FM (2006). "Novel binding sites on clathrin and adaptors regulate distinct aspects of coat assembly". Traffic (Copenhagen, Denmark) 7 (12): 1688–700. PMID 17052248. doi:10.1111/j.1600-0854.2006.00499.x.
- Edeling MA, Smith C, Owen D (2006). "Life of a clathrin coat: insights from clathrin and AP structures". Nature Reviews Molecular Cell Biology 7 (1): 32–44. PMID 16493411. doi:10.1038/nrm1786.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Clathrin structure
- Membrane Dynamics
- Clathrin Dynamics[Ligazón morta] ASCB Image & Video Library
