Fixación do carbono C4

A: Célula do mesofilo
B: Cloroplasto
C: Tecido vascular
D: Célula da vaíña vascular
E: Estroma
F: Tecido vascular: subministra a auga />1) O carbono fíxase para producir oxalacetato pola PEP carboxilase.
2) A molécula de catro carbonos despois sae da célula e entra no cloroplasto das células da vaíña vascular.
3) Despois é degradada liberando o dióxido de carbono e producindo piruvato. O dióxido de carbono combínase coa ribulosa 1,5-bisfosfato e entra no ciclo de Calvin.
4) O piruvato reentra na célula do mesofilo. Alí reacciona co ATP para producir o composto inicial do ciclo C4.
A fixación do carbono C4 é un dos tres procesos bioquímicos, xunto coa fixación C3 e a CAM, que se utilizan para fixar o carbono na fotosíntese. Denomínase así porque o primeiro produto estable da fixación do carbono é un composto de catro carbonos (C4). Tecnicamente a fotosíntese CAM ten tamén unha fixación C4, xa que nela se orixina tamén unha primeira molécula de C4, pero esta fotosíntese presenta bastantes diferenzas con respecto ás plantas C4 propiamente ditas, das que tratará este artigo. A fixación C4 dáse nun conxunto minoritario de plantas, xa que a gran maioría teñen unha fixación C3 (orixinan unha primeira molécula de tres carbonos); as plantas CAM son un grupo aínda máis reducido.
A fixación C4 é unha elaboración da máis común fixación C3 e crese que evolucionou máis recentemente. As C4 e as CAM evitan a tendencia que ten o encima RuBisCO (que realiza a fixación) de fixar oxíxeno en lugar de dióxido de carbono (o cal supón un desperdicio de enerxía) nun proceso chamado fotorrespiración. A RuBisCO funciona máis eficientemente nun ambiente rico en CO
2 e baixo en O
2. Esta maior eficiencia conséguese creando un ambiente máis axeitado para o funcionamento deste encima transportando o CO
2 formando parte do malato ou aspartato desde as células do mesofilo ás células da vaíña vascular. Nestas células da vaíña vascular, a RuBisCO está illada do oxíxeno amosférico e saturada de CO
2, o cal se libera nesas células por descarboxilación do malato. As plantas C4 usan a PEP carboxilase para capturar máis CO
2 nas células do mesofilo. Este encima cataliza que o fosfoenolpiruvato (PEP) (3 carbonos) se una ao CO
2 converténdose en oxalacetato (4 carbonos). Despois, o oxalacetato orixina malato (de 4 carbonos). O malato entra nas células da vaíña vascular e libera o CO
2 dentro da vaíña vascular para que a RuBisCO funcione máis eficientemente. Porén, estes pasos adicionais necesitan máis enerxía en forma de ATP, pero evitan o fenómeno malgastador de enerxía da fotorrespiración. Debido a isto, as plantas C4 poden fixar máis eficientemente o carbono en condicións de seca, alta temperatura, e limitacións do nitróxeno ou CO
2, comparada coa vía C3 máis común, que é máis eficiente nas outras condicións.
Vía C4
[editar | editar a fonte]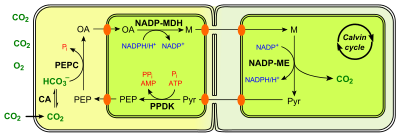


Os primeiros experimentos que indicaban que algunhas plantas non usaban a fixación do carbono C3 senón que producían malato e aspartato (a partir de oxalacetato) nos primeiros pasos da fixación do carbono fixéronos a inicios da década de 1950 Hugo P. Kortschak[1] e Yuri Karpilov.[2] A vía C4 foi dilucidada por Marshall Davidson Hatch e C. R. Slack, en Australia, en 1966, polo que se denomina tamén vía ou ruta de Hatch-Slack.[3]
Nas plantas C3, o primeiro paso nas reaccións da fase luminosa da fotosíntese implican a fixación do CO
2 polo encima RuBisCO nun azucre de cinco carbonos chamado ribulosa 1,5-bisfosfato, que forma un composto inestable de 6C, que se divide formando dúas moléculas de 3-fosfoglicerato, un composto de 3C que é o primeiro produto estable da fixación. Porén, debido á actividade dual con actividade carboxilase ou oxixenase da RuBisCO segundo as condicións en que se atope, parte do substrato pode ser ás veces oxidado (convertido en fosfoglicolato) en vez de carboxilado, resultando nunha perda de enerxía, que se ten que consumir en rexenerar o substrato oxidado, fenómeno chamado fotorrespiración. A fotorrespiración ocorre cando a RuBisCO está nun ambiente con concentración baixa de CO2 e alta de O2 e está favorecida polas teperaturas altas.
Para evitar a fotorrespiración, as plantas C4 desenvolveron un mecanismo para ceder eficientemente o CO
2 á RuBisCO. Utilizan unha anatomía das follas específica para separar no espazo a fixación inicial de carbono da fixación final. Teñen cloroplastos non só nas células do mesofilo foliar, senón tamén nas células da vaíña vascular. En vez de dirixir a fixación do C directamente á RuBisCO no ciclo de Calvin, o CO
2 é incorporado primeiro nun ácido orgánico de 4 carbonos no mesofilo, que despois soltará o CO2 que previamente incorporou nas células da vaíña vascular, para que se incorpore alí ao ciclo e Calvin seguindo a vía C3 convencional. Isto asegura un nivel alto de CO2 nas células da vaíña vascular onde actúa a RuBisCO, o cal evita a súa actividade oxidativa e a fotorrespiración.
Como na vía C4 o CO2 se fixa inicialmente no fosfoenolpiruvato, un paso previo desta vía é a produción de fosfoenolpiruvato; isto conséguese mediante a conversión do piruvato en fosfoenolpiruvato (PEP), polo encima piruvato ortofosfato diquinase. Esta reacción require fosfato inorgánico e ATP ademais de piruvato, producindo fosfoenolpiruvato, AMP, e pirofosfato inorgánico (PPi). O seguinte paso é a fixación do CO2 en oxalacetato polo encima PEP carboxilase. Ambos os pasos ocorren nas células do mesofilo:
- piruvato + Pi + ATP → PEP + AMP + PPi
- PEP + CO
2 → oxalacetato
A PEP carboxilase ten unha menor KM para o HCO3- (e, por tanto, unha alta afinidade) que a RuBisCO. Ademais, o O2 é un substrato moi malo para este encima (a diferenza do que ocorre coa RuBisCO). Deste modo, a concentracións relativamente baixas de CO2, a maioría do CO2 pode ser fxado por esta vía.
O produto, oxalacetato, é xeralmente convertido en malato, outro composto orgánico simple de 4C, que é transportado ás células da vaíña vascular que rodean os vasos condutores da folla, e leva nel os carbonos que foron fixados na vía a partir do CO2. Alí, o malato é descarboxilado para producir piruvato e CO2. O CO2 pode agora incorpoararse ao ciclo de Calvin dos cloroplastos das células da vaíña vascular, mentres que o piruvato é transportado de volta ás células do mesofilo.
Como cada molécula de CO2 debe ser fixada dúas veces (na fixación inicial na molécula de 4 C e na definitiva feita pola RiBisCO), a vía C4 usa máis enerxía que a vía C3. A vía C3 require 18 moléculas de ATP para a síntese dunha molécula de glicosa, mentres que a C4 require 30 moléculas de ATP. Pero ten a vantaxe que evita o gasto enerxético da fotorrespiración, o que dá un rendemento global neto positivo, e o fai un mecanismo moi adaptativo nas plantas de climas tropicais.
Hai varias variantes desta vía:
- O ácido de 4 carbonos transportado desde o mesofilo á vaíña vascular pode ser malato ou aspartato.
- O ácido de 3 carbonos transportado de regreso desde a vaíña vascular ao mesofilo pode ser piruvato ou alanina.
- O encima que cataliza a descarboxilación na vaíña vascular varía. No millo e cana de azucre o encima é o encima NADP-málico; en paínzo é o encima NAD-málico; e en Panicum maximum é a PEP carboxiquinase.
Anatomía das follas das plantas C4
[editar | editar a fonte]
As plantas C4 adoitan a posuír unha anatomía das follas característica chamada anatomía kranz, pola palabra alemá que significa 'coroa (de flores)'. Os seus feixes vasculares están rodeados por dous aneis de células; o anel interno, chamado de células da vaíña do feixe vascular, contén cloroplastos con abondoso amidón que carecen de grana, o que diferenza ests células das células do mesofilo presentes no anel externo. A principal función desta anatomía é proporcionar un sitio no que o CO2 se pode concentrar arredor da RuBisCO, e así evitar a fotorrespiración. Para manter unha concentración de CO2 significativamente maior na vaíña vascular en comparación co mesofilo, a capa limitante do kranz ten unha baixa difusión do CO2, unha propiedade que pode ser potenciada pola presenza de suberina.[4]
Aínda que a maioría das plantas C4 mostran esta anatomía, hai tamén unhas poucas especies que funcionan cun ciclo C4 limitado sen ter tecido diferenciado en vaíña vascular. Suaeda aralocaspica, Bienertia cycloptera, Bienertia sinuspersici e Bienertia kavirense (todas Chenopodioideae) son plantas terrestres que habitan en depresións salinas secas de desertos do Oriente Próximo. Estas plantas presentan mecanismos de concentración de CO2 C4 que operan cunha soa célula, que son únicos entre os mecanismos C4 coñecidos.[5][6][7][8] Aínda que a citoloxía de ambos os xéneros difire lixeiramente, o principio básico é que utilizan vacúolos cheos de fluído para dividir a célula en dúas áreas separadas. Os encimas carboxilativos no citosol poden así manterse separados dos encimas descarboxilases e RuBisCO nos cloroplastos, e pódese establecer unha barreira de difusión entre os cloroplastos (que conteñen RuBisCO) e o citosol. Isto permite que se estableza unha área de tipo feixe vascular e outra área de tipo mesofilo nunha soa célula. Aínda que isto permite que funcione un ciclo limitado C3, é relativamente ineficaz, xa que se perde moito CO2 na zona arredor da RuBisCO. Hai tamén evidencias de fotosíontese C4 inducible en macrófitas acuáticas non kranz como Hydrilla verticillata en condicións cálidas, aínda que o mecanismo polo cal se minimiza a perda de CO2 da zona arredor da RuBisCO é actualmente pouco claro.[9]
Evolución e vantaxes da vía C4
[editar | editar a fonte]- Véxase tamén: Historia evolutiva das plantas.
As plantas C4 teñen unha vantaxe competitiva sobre as plantas que posúen a vía de fixación C3 máis común en codicións de seca, alta temperatura, e limitacións de nitróxeno ou CO2. Cando as plantas C3 e C4 crecen no mesmo ambiente, a 30 °C, as herbáceas C3 perden aproximadamente 833 moléculas de auga por molécula de CO2 que foi fixado, mentres que as herbáceas C4 perden só 277. Isto incrementa o uso eficiente da auga das C4 e significa que se conserva a humidade do solo, permitíndolles crecer durante máis tempo en ambientes áridos.[10]
A fixación de carbono C4 evolucionou nunhas 40 ocasións independentes en diferentes familias de plantas, polo que é un excelente exemplo de evolución converxente.[11] Esta converxencia puido ser facilitada porque existen moitas vías evolutivas potenciais para que apareza o fenotipo C4, moitas das cales implican pasos evolutivos iniciais non directamente relacionadas coa fotosíntese.[12] As plantas C4 orixináronse hai uns 25 a 32 millóns de anos (Ma)[11] durante o Oligoceno (precisar máis cando é difícil de determinar) e non se fixeron ecoloxicamente significativas ata hai uns de 6 a 7 Ma, no período Mioceno.[11] O metabolismo C4 orixinouse cando as herbas migraron desde os bosques sombreados aos ambientes máis abertos,[13] onde a forte luz solar lles daba unha vantaxe sobre a vía C3.[14] As condicións de seca non eran necesarias para a esta innovación; senón que máis ben o incremento da resistencia ao estrés hídrico era un subproduto da vía e permitiu que as plantas C4 colonizasen máis rapidamente os ambientes áridos.[14]
Hoxe, as plantas C4 representan un 5% da biomasa de plantas da Terra e un 3% das especies de plantas coñecidas.[10][15] Malia a súa relativa escaseza son moi importantes, porque realizan un 30% da fixación do carbono terrestre.[11] Un incremento da proporción das plantas C4 na Terra podería axudar ao biosecuestro do CO2 e representaría un importante estratexia para evitar o cambio climático. As plantas C4 que viven hoxe están concentradas nos trópicos e subtrópicos (por debaixo das latitudes de 45º), onde as altas temperaturas do aire contribúen a niveis posibles máis altos de actividade oxixenase pola RuBisCO, que incrementa a taxa de fotorrespiración nas plantas C3, pero que as C4 evitan.
Plantas que usan a fixación do carbono C4
[editar | editar a fonte]Unhas 7.600 especies de plantas usan a fixación do carbono C4, o cal representa o 3% e todas as especies de plantas. Todas elas son anxiospermas. A fixación do carbono C4 é menos común en dicotiledóneas que en monocotiledóneas, xa que só un 4,5% das dicotiledóneas usan a vía C4, en comparación cun 40% de monocotiledóneas. A pesar disto, só tres familias de monocotiledóneas utilizan a fixación C4, fronte a 15 familias de dicotiledóneas. Dos clados de monocotiledóneas que conteñen plantas C4, as herbáceas Poaceae usan principalmente a vía fotosintética C4. O 40% das herbas son C4 e xuntas supoñen o 61% das especies C4. Estas inclúen importantes plantas agrícolas como o millo, cana de azucre, paínzo, e sorgo.[16][17] Dos clados de dicotiledóneas que conteñen especies C4, a orde Caryophyllales contén a maioría das especies. Das familias da orde Caryophyllales, as que máis usan a fixación C4 son as Chenopodiaceae, xa que a usan 550 das súas especies dun total de 1.400. Unhas 250 das 1.000 especies da familia relacionada das Amaranthaceae tamén usan a fixación C4.[10][18]
Membros da familia dos xuncos (Cyperaceae), e numerosas familias de eudicotiledóneas, incluíndo as margaridas (Asteraceae), coles (Brassicaceae), e euforbias (Euphorbiaceae) tamén usan a vía C4.
Converter plantas C3 en C4
[editar | editar a fonte]Dada a vantaxe no rendemento que presentan as C4, un grupo de científicos de institucións de todo o mundo están traballando no C4 Rice Project para converter o arroz, que é unha planta C3, nunha planta C4, para o cal están estudando primeiro plantas C4 do millo e Brachypodium.[19] Como o arroz é o alimento humano máis importante no mundo, e é o alimento básico para máis da metade dos habitantes do planeta, se se fai que o arroz sexa unha planta máis eficiente na conversión de luz solar en grans de arroz, isto podería ter beneficios globais moi importantes para mellorar a seguridade alimentaria (produción de alimentos suficiente para a humanidade). O equipo de investigadores considera que un arroz C4 podería producir ata un 50% máis de grans, e podería facelo consumindo menos auga e nutrientes.[20][21][22]
Os investigadores xa identificaron os xenes necesarios para a fotosíntese C4 no arroz e agora están tratando de desenvolver un prototipo de planta de arroz C4. En 2012, o goberno do Reino Unido xunto coa Fundación Bill e Melinda Gates financiou con 14 millóns de dólares en 3 anos este proxecto do arroz C4 do International Rice Research Institute.[23]
Notas
[editar | editar a fonte]- ↑ Nickell, Louis G. (1993). "A tribute to Hugo P. Kortschak: The man, the scientist and the discoverer of C4 photosynthesis". Photosynthesis Research 35 (2): 201–204. doi:10.1007/BF00014751.
- ↑ Hatch, Marshall D. (2002). "C(4) photosynthesis: Discovery and resolution". Photosynthesis Research 73 (1–3): 251–6. PMID 16245128. doi:10.1023/A:1020471718805.
- ↑ Slack, CR; Hatch, MD (1967). "Comparative studies on the activity of carboxylases and other enzymes in relation to the new pathway of photosynthetic carbon dioxide fixation in tropical grasses" (PDF). The Biochemical Journal 103 (3): 660–5. PMC 1270465. PMID 4292834. doi:10.1042/bj1030660. Consultado o 2010-04-08.
- ↑ Laetsch (1971) Photosynthesis and Photorespiration, eds Hatch, Osmond and Slatyer
- ↑ Freitag, H; Stichler, W (2000). "A remarkable new leaf type with unusual photosynthetic tissue in a central Asiatic genus of Chenopodiaceae". Plant Biol 2: 154–160. doi:10.1055/s-2000-9462.
- ↑ Voznesenskaya, Elena; Vincent R. Franceschi; Olavi Kiirats; Elena G. Artyusheva; Helmut Freitag; Gerald E. Edwards (2002). "Proof of C4 photosynthesis without Kranz anatomy in Bienertia cycloptera (Chenopodiaceae)". The Plant Journal 31 (5): 649–662. PMID 12207654. doi:10.1046/j.1365-313X.2002.01385.x.
- ↑ Akhani, Hossein; Barroca, João; Koteeva, Nuria; Voznesenskaya, Elena; Franceschi, Vincent; Edwards, Gerald; Ghaffari, Seyed Mahmood; Ziegler, Hubert (2005). "Bienertia sinuspersici (Chenopodiaceae): A New Species from Southwest Asia and Discovery of a Third Terrestrial C4 Plant Without Kranz Anatomy". Systematic Botany 30 (2): 290–301. doi:10.1600/0363644054223684.
- ↑ Akhani, H; Chatrenoor, T; Dehghani, M; Khoshravesh, R; Mahdavi, P.; Matinzadeh, Z. (2012). "A new species of Bienertia (Chenopodiaceae) from Iranian salt deserts: a third species of the genus and discovery of a fourth terrestrial C4 plant without Kranz anatomy". Plant Biosystems 146: 550–559. doi:10.1080/11263504.2012.662921.
- ↑ Holaday, A. S.; Bowes, G. (1980). "C4 Acid Metabolism and Dark CO2 Fixation in a Submersed Aquatic Macrophyte (Hydrilla verticillata)". Plant Physiology 65 (2): 331–5. PMC 440321. PMID 16661184. doi:10.1104/pp.65.2.331.
- ↑ 10,0 10,1 10,2 Sage, Rowan; Russell Monson (1999). "7". C4 Plant Biology. pp. 228–229. ISBN 0-12-614440-0.
- ↑ 11,0 11,1 11,2 11,3 Osborne, C. P.; Beerling, D. J. (2006). "Nature's green revolution: the remarkable evolutionary rise of C4 plants". Philosophical Transactions of the Royal Society B: Biological Sciences 361 (1465): 173–194. PMC 1626541. PMID 16553316. doi:10.1098/rstb.2005.1737.
- ↑ Williams BP, Johnston IG, Covshoff S, Hibberd JM (September 2013). "Phenotypic landscape inference reveals multiple evolutionary paths to C₄ photosynthesis". eLife 2: e00961. PMID 24082995. doi:10.7554/eLife.00961.
- ↑ Edwards, E. J.; Smith, S. A. (2010). "Phylogenetic analyses reveal the shady history of C4 grasses". Proceedings of the National Academy of Sciences 107 (6): 2532–7. Bibcode:2010PNAS..107.2532E. PMC 2823882. PMID 20142480. doi:10.1073/pnas.0909672107.
- ↑ 14,0 14,1 Osborne, C. P.; Freckleton, R. P. (2009). "Ecological selection pressures for C4 photosynthesis in the grasses". Proceedings of the Royal Society B: Biological Sciences 276 (1663): 1753–60. PMC 2674487. PMID 19324795. doi:10.1098/rspb.2008.1762.
- ↑ Bond, W. J.; Woodward, F. I.; Midgley, G. F. (2005). "The global distribution of ecosystems in a world without fire". New Phytologist 165 (2): 525–538. PMID 15720663. doi:10.1111/j.1469-8137.2004.01252.x.
- ↑ Sage, Rowan; Russell Monson (1999). "16". C4 Plant Biology. pp. 551–580. ISBN 0-12-614440-0.
- ↑ Zhu XG, Long SP, Ort DR (2008). "What is the maximum efficiency with which photosynthesis can convert solar energy into biomass?". Current Opinion in Biotechnology 19 (2): 153–159. PMID 18374559. doi:10.1016/j.copbio.2008.02.004.
- ↑ Kadereit, G; Borsch, T; Weising, K; Freitag, H (2003). "Phylogeny of Amaranthaceae and Chenopodiaceae and the Evolution of C4 Photosynthesis". International Journal of Plant Sciences 164 (6): 959–86. doi:10.1086/378649.
- ↑ Slewinski. "Scarecrow Plays a Role in Establishing Kranz Anatomy in Maize Leaves" (PDF).
- ↑ Gilles van Kote (2012-01-24). "Researchers aim to flick the high-carbon switch on rice". The Guardian. Consultado o 2012-11-10.
- ↑ Von Caemmerer, S.; Quick, W. P.; Furbank, R. T. (2012). "The Development of C4 Rice: Current Progress and Future Challenges". Science 336 (6089): 1671–1672. Bibcode:2012Sci...336.1671V. PMID 22745421. doi:10.1126/science.1220177.
- ↑ Hibberd, J. M.; Sheehy, J. E.; Langdale, J. A. (2008). "Using C4 photosynthesis to increase the yield of rice—rationale and feasibility". Current Opinion in Plant Biology 11 (2): 228–231. PMID 18203653. doi:10.1016/j.pbi.2007.11.002.
- ↑ Munawan Hasan (2012-11-06). "C4 rice project gets financial boost". The News. Arquivado dende o orixinal o 10 de novembro de 2012. Consultado o 2012-11-10.
