Isopentenil-difosfato delta isomerase
| Isopentenil-difosfato delta-isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Octámero de isopentenil-difosfato delta isomerase, Thermus thermophilus | |||||||||
| Identificadores | |||||||||
| Número EC | 5.3.3.2 | ||||||||
| Número CAS | 9033-27-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
Isopentenil-pirofosfato delta isomerase 1
| |
| Identificadores | |
| Símbolo | IDI1 |
| Entrez | 3422 |
| HUGO | 5387 |
| OMIM | |
| RefSeq | NM_004508 |
| UniProt | Q13907 |
| Outros datos | |
| Número EC | 5.3.3.2 |
| Locus | Cr. 10 p15.3 |
A isopentenil-difosfato delta isomerase, tamén chamada isopentenil pirofosfato isomerase (IPP isomerase),[1] é unha isomerase que cataliza a conversión da molécula relativamente pouco reactiva isopentenil pirofosfato (IPP) no electrófilo máis reactivo dimetilalil pirofosfato (DMAPP). Esta isomerización é un paso clave na biosíntese de isoprenoides por medio das vías do mevalonato e MEP.
- isopentenil difosfato dimetilalil difosfato
Este encima pertence á familia das isomerases, especificamente ás oxidorredutases intramoleculares que transpoñen enlaces C=C. O nome sistemático desta clase de encimas é isopentenil-difosfato Delta3-Delta2-isomerase. Outros nomes de uso común son isopentenilpirofosfato Delta-isomerase, metilbutenilpirofosfato isomerase e isopentenilpirofosfato isomerase.[2][3][4]
Mecanismo encimático
[editar | editar a fonte]A IPP isomerase cataliza a isomerización do IPP a DMAPP por medio dunha transposición antarafacial de hidróxeno.[5][6] As probas empíricas indican que esta reacción se produce por un mecanismo de protonación/desprotonación, coa adición dun protón á cara cara re do dobre enlace inactivado C3-C4 orixinando un intermediario transitorio carbocatión.[7][8] A retirada do protón pro-R de C2 forma o dobre enlace C2-C3 do DMAPP.

Estrutura encimática
[editar | editar a fonte]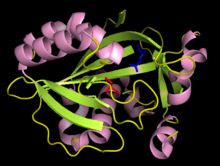
Os estudos cristalográficos indicaron que a forma activa da IPP isomerase é un monómero con hélices α e follas β alternantes.[9][10] O sitio activo da IPP isomerase está moi enterrado dentro do encima e consta dun residuo de ácido glutámico e outro de cisteína que interaccionan cos lados opostos do substrato IPP, consistentemente coa estereoquímica antarafacial da isomerización.[9][11] A orixe do paso de protonación inicial non foi establecido concluintemente. Probas recentes indican que o residuo de ácido glutámico está implicado no paso de protonación malia a observación de que a súa cadea lateral de ácido carboxílico está estabilizada na súa forma carboxilato.[12] Outro descubrimento foi que existe unha molécula de auga no sitio activo da IPP isomerase humana, que suxire un mecanismo no cal a molécula de auga podería ser o doante directo de protóns.[13]
A IPP isomerase tamén necesita un catión divalente para pregarse na súa conformación activa. O encima contén varios aminoácidos, incluíndo o glutamato catalítico, que están implicados na coordinación cun Mg2+ ou Mn2+.[9][14] A coordinación do catión metálico co residuo de glutamato estabiliza o intermediario carbocatión despois da protonación.
Estudos estruturais
[editar | editar a fonte]A finais de 2007, resolvéranse 25 estruturas desta clase de encimas, cos seguintes códigos de acceso en PDB: PDB 1HX3, PDB 1HZT, PDB 1I9A, PDB 1NFS, PDB 1NFZ, PDB 1OW2, PDB 1P0K, PDB 1P0N, PDB 1PPV, PDB 1PPW, PDB 1PVF, PDB 1Q54, PDB 1R67, PDB 1VCF, PDB 1VCG, PDB 1X83, PDB 1X84, PDB 2B2K, PDB 2DHO, PDB 2G73, PDB 2G74, PDB 2I6K, PDB 2ICJ, PDB 2ICK e PDB 2PNY.
Función biolóxica
[editar | editar a fonte]A protonación do dobre enlace inactivo raramente se ve na natureza, o que salienta o mecanismo catalítico único da isomerase IPP. A isomerización do IPP ao DMAPP é un paso crucial na síntese de isoprenoides e derivados de isoprenoides, compostos que desempeñan funcións vitais nas vías biosintéticas de todos os organismos vivos.[15] Debido á importancia da vía do melavonato na biosíntese de isoprenoides, a IPP isomerase encóntrase en diversos compartimentos celulares, como os plastidios e as mitocondrias de mamíferos.[16]

Importancia en enfermidades
[editar | editar a fonte]As mutacións en IDI1, o xene que codifica a IPP isomerase 1, foron implicadas no descenso da viabilidade en diversos organismos, incluíndo os lévedos Saccharomyces cerevisiae, o nematodo Caenorhabditis elegans e a planta Arabidopsis thaliana.[17][18][19] Aínda que non hai evidencias directas da implicación das mutacións en IDI1 en enfermidades humanas, a análise xenómica identificou unha ganancia de número de copias preto de dous xenes de IPP isomerase nunha proporción substancial de pacientes de esclerose lateral amiotrófica esporádica, o que suxire que esta isomerase pode xogar un papel decisivo nesta doenza.[20]
Notas
[editar | editar a fonte]- ↑ "IDI1 - Isopentenyl-diphosphate Delta-isomerase - Saccharomyces cerevisiae (strain ATCC 204508 / S288c) (Baker's yeast) - IDI1 gene & protein". UniProt. Consultado o 6 de xuño de 2016.
- ↑ Kaneda K, Kuzuyama T, Takagi M, Hayakawa Y, Seto H (2001). "An unusual isopentenyl diphosphate isomerase found in the mevalonate pathway gene cluster from Streptomyces sp. strain CL190". Proc. Natl. Acad. Sci. U.S.A. 98 (3): 932–7. PMC 14687. PMID 11158573. doi:10.1073/pnas.020472198.
- ↑ Bishop JM (1983). "Cellular oncogenes and retroviruses". Annu. Rev. Biochem. 52: 301–54. PMID 6351725. doi:10.1146/annurev.bi.52.070183.001505.
- ↑ Agranoff BW, Eggerer H, Henning U, Lynen F (1960). "Biosynthesis of terpenes. VII. Isopentenyl pyrophosphate isomerase". J. Biol. Chem. 235 (2): 326–32. PMID 13792054. doi:10.1016/S0021-9258(18)69523-7.
- ↑ Cornforth JW, Cornforth RH, Popják G, Yengoyan L (setembro de 1966). "Studies on the biosynthesis of cholesterol. XX. Steric course of decarboxylation of 5-pyrophosphomevalonate and of the carbon to carbon bond formation in the biosynthesis of farnesyl pyrophosphate". The Journal of Biological Chemistry 241 (17): 3970–3987. PMID 4288360. doi:10.1016/S0021-9258(18)99800-5.
- ↑ Cornforth, R. H.; Popják, G. (1969). "Chemical syntheses of substrates of sterol biosynthesis". En Raymond, B. C. Methods in Enzymology 15. Academic Press. pp. 359–390.
- ↑ Reardon JE, Abeles RH (setembro de 1986). "Mechanism of action of isopentenyl pyrophosphate isomerase: evidence for a carbonium ion intermediate". Biochemistry 25 (19): 5609–5616. PMID 3022798. doi:10.1021/bi00367a040.
- ↑ Street IP, Christensen DJ, Poulter CD (1990). "Hydrogen exchange during the enzyme-catalyzed isomerization of isopentenyl diphosphate and dimethylallyl diphosphate". Journal of the American Chemical Society 112 (23): 8577–8578. doi:10.1021/ja00179a049.
- ↑ 9,0 9,1 9,2 Hall NR, Fish DE, Hunt N, Goldin RD, Guillou PJ, Monson JR (xuño de 1992). "Is the relationship between angiogenesis and metastasis in breast cancer real?". Surgical Oncology 1 (3): 223–229. PMID 1285217. doi:10.1016/0960-7404(92)90068-v.
- ↑ Zheng W, Sun F, Bartlam M, Li X, Li R, Rao Z (marzo de 2007). "The crystal structure of human isopentenyl diphosphate isomerase at 1.7 A resolution reveals its catalytic mechanism in isoprenoid biosynthesis". Journal of Molecular Biology 366 (5): 1447–1458. PMID 17250851. doi:10.1016/j.jmb.2006.12.055.
- ↑ Street IP, Coffman HR, Baker JA, Poulter CD (abril de 1994). "Identification of Cys139 and Glu207 as catalytically important groups in the active site of isopentenyl diphosphate:dimethylallyl diphosphate isomerase". Biochemistry 33 (14): 4212–4217. PMID 7908830. doi:10.1021/bi00180a014.
- ↑ Wouters J, Oudjama Y, Barkley SJ, Tricot C, Stalon V, Droogmans L, Poulter CD (abril de 2003). "Catalytic mechanism of Escherichia coli isopentenyl diphosphate isomerase involves Cys-67, Glu-116, and Tyr-104 as suggested by crystal structures of complexes with transition state analogues and irreversible inhibitors". The Journal of Biological Chemistry 278 (14): 11903–11908. PMID 12540835. doi:10.1074/jbc.M212823200.
- ↑ Zhang C, Liu L, Xu H, Wei Z, Wang Y, Lin Y, Gong W (marzo de 2007). "Crystal structures of human IPP isomerase: new insights into the catalytic mechanism". Journal of Molecular Biology 366 (5): 1437–1446. PMID 17137593. doi:10.1016/j.jmb.2006.10.092.
- ↑ Bonanno JB, Edo C, Eswar N, Pieper U, Romanowski MJ, Ilyin V, Gerchman SE, Kycia H, Studier FW, Sali A, Burley SK (Nov 2001). "Structural genomics of enzymes involved in sterol/isoprenoid biosynthesis". Proceedings of the National Academy of Sciences of the United States of America 98 (23): 12896–12901. Bibcode:2001PNAS...9812896B. PMC 60796. PMID 11698677. doi:10.1073/pnas.181466998.
- ↑ Bach TJ (Mar 1995). "Some new aspects of isoprenoid biosynthesis in plants--a review". Lipids 30 (3): 191–202. PMID 7791527. doi:10.1007/BF02537822.
- ↑ Ramos-Valdivia AC, van der Heijden R, Verpoorte R (decembro de 1997). "Isopentenyl diphosphate isomerase: a core enzyme in isoprenoid biosynthesis. A review of its biochemistry and function". Natural Product Reports 14 (6): 591–603. PMID 9418296. doi:10.1039/np9971400591.
- ↑ Mayer MP, Hahn FM, Stillman DJ, Poulter CD (setembro de 1992). "Disruption and mapping of IDI1, the gene for isopentenyl diphosphate isomerase in Saccharomyces cerevisiae". Yeast 8 (9): 743–748. PMID 1441751. doi:10.1002/yea.320080907.
- ↑ Yochem J, Hall DH, Bell LR, Hedgecock EM, Herman RK (abril de 2005). "Isopentenyl-diphosphate isomerase is essential for viability of Caenorhabditis elegans". Molecular Genetics and Genomics 273 (2): 158–166. PMID 15765206. doi:10.1007/s00438-004-1101-x.
- ↑ Okada K, Kasahara H, Yamaguchi S, Kawaide H, Kamiya Y, Nojiri H, Yamane H (abril de 2008). "Genetic evidence for the role of isopentenyl diphosphate isomerases in the mevalonate pathway and plant development in Arabidopsis". Plant & Cell Physiology 49 (4): 604–616. PMID 18303110. doi:10.1093/pcp/pcn032.
- ↑ Kato T, Emi M, Sato H, Arawaka S, Wada M, Kawanami T, Katagiri T, Tsuburaya K, Toyoshima I, Tanaka F, Sobue G, Matsubara K (novembro de 2010). "Segmental copy-number gain within the region of isopentenyl diphosphate isomerase genes in sporadic amyotrophic lateral sclerosis". Biochemical and Biophysical Research Communications 402 (2): 438–442. PMID 20955688. doi:10.1016/j.bbrc.2010.10.056.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- isopentenyldiphosphate delta-isomerase Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.

