Tilacoide

Un tilacoide (do grego thylakos, saco, bolsa) é un compartimento limitado por membranas situado dentro dos cloroplastos das plantas e algas e no interior das cianobacterias. Os tilacoides son o lugar onde teñen lugar as reaccións da fase luminosa da fotosíntese. Os tilacoides constan dunha membrana tilacoidal que limita un espazo chamado lume tilacoidal. Os tilacoides dos cloroplastos xeralmente forman moreas de discos membranosos, e cada unha destas moreas recibe o nome de granum,[1] que en plural latino é grana, polo que os tilacoides da grana son os que están formando ditas moreas de discos. Cada granum está conectado con outros por outros tilacoides máis longos e non amontoados chamados tilacoides estromáticos, tilacoides intergranais ou lamelas, que interconectan todos os tilacoides formando un espazo intratilacoidal funcional continuo único.
Estrutura do tilacoide
[editar | editar a fonte]

Membrana
[editar | editar a fonte]A membrana tilacoidal é o lugar onde se producen as reaccións da fase luminosa da fotosíntese e onde están integrados os pigmentos fotosintéticos e a ATP sintetase tilacoidal. Presenta un patrón alternante de bandas claras e escuras que miden 1 nanómetro cada unha.[2] A bicapa lipídica do tilacoide comparte certas características distintivas coas membranas procarióticas e coa membrana interna do cloroplasto. Por exemplo, os lípidos ácidos están presentes tanto nas membranas tilacoidais coma nas das cianobacterias e outras bacterias fotosintéticas e están implicados na integridade funcional dos fotosistemas.[3] As membranas tilacoidais das plantas superiores están compostas principalmente de fosfolípidos [4] e galactolípidos, que están dispostos asimetricamente nas membranas tanto en cada capa da membrana coma entre a capa superior e a inferior.[5] Os lípidos das membranas tilacoidais sintetízanse por unha ruta complexa que implica o intercambio de precursores lipídicos entre o retículo endoplasmático e a membrana interna da envoltura do plasto e transportados desde a membrana interna aos tilacoides por medio de vesículas.[6]
Lume
[editar | editar a fonte]O lume tilacoidal é o espazo interno encerrado pola membrana tilacoidal. Desempeña un papel importante na fotofosforilación durante a fotosíntese, xa que nel se acumulan os protóns bombeados desde o estroma a través da membrana tilacoidal e os producidos pola rotura de moléculas de auga no fotosistema II. Como acumula protóns, durante a fase luminosa ten un pH de 4.
Granum
[editar | editar a fonte]Un granum (plural grana, en latín, ou gra, en galego) é unha morea de discos tilacoidais. Os cloroplastos poden conter de 10 a 100 destas moreas. Os tilacoides estromáticos, intergranais ou lamelas conectan cada granum cos demais. Os tilacoides da grana poden distinguirse dos estromáticos pola súa diferente composición en proteínas. A grana contribúe a que o cloroplasto teña unha grande área superficial en relación ao seu volume. As diferentes interpretacións que se fixeron das imaxes de tomografía electrónica das membranas tilacoidais orixinaron dous modelos para explicar a estrutura da grana. Ambos os dous postulan que as lamelas intersectan as moreas de tilacoides en láminas paralelas, aínda que se debate se estas láminas intersectan o eixe do granum en planos perpendiculares ou están dispostos formando unha hélice dextroxira.[7]
Formación dos tilacoides
[editar | editar a fonte]Os cloroplastos desenvólvense a partir de proplastos cando a plántula emerxe do chan. A formación dos tilacoides require luz. No embrión da planta e en ausencia de luz, os proplastos desenvólvense en etioplastos, os cales conteñen estruturas membranosas semicristalinas chamadas corpos prolamelares. Cando se expoñen á luz, estes corpos prolamelares transfórmanse en tilacoides. Isto non ocorre nas plántulas que medran na escuridade, que sofren etiolación. Unha baixa exposición á luz pode facer que os tilacoides perdan a súa funcionalidade. Isto causa que os cloroplastos non funcionen e a planta morra.
A formación de tilacoides require a acción da chamada proteína de plástidos inducida por vesículas 1 (vesicle-inducing protein in plastids 1 ou VIPP1). As plantas non poden sobrevivir sen esta proteína, e niveis reducidos de VIPP1 producen plantas cun crecemento máis lento e máis pálidas, e cunha capacidade de fotosintetizar reducida. O VIPP1 requírese para a formación básica da membrana dos tilacoides, pero non para a ensamblaxe dos complexos proteicos da membrana tilacoidal.[8] É unha proteína conservada en todos os organismos que conteñen tilacoides, incluíndo as cianobacterias,[9] algas verdes, como Chlamydomonas,[10] e plantas superiores, como Arabidopsis thaliana.[11]
Illamento e fraccionamento de tilacoides
[editar | editar a fonte]Os tilacoides poden ser purificados das células das plantas utilizando unha combinación de centrifugación diferencial e de gradiente.[12] A rotura dos tilacoides illados, por exemplo por rotura mecánica, libera a fracción luminal. As fraccións de membrana integral e periférica poden extraerse da fracción de membrana restante. O tratamento con carbonato de sodio (Na2CO3) separa as proteínas de membrana periféricas, e o tratamento con deterxentes e solventes orgánicos solubiliza as proteínas integrais de membrana.
Proteínas tilacoidais
[editar | editar a fonte]Os tilacoides conteñen moitas proteínas de membrana periféricas e integrais, e proteínas luminais. Estudos recentes de proteómica de fraccións tilacoidais proporcionaron moitos detalles sobre a composición proteica dos tilacoides.[13] Estes datos foron resumidos en varias bases de datos de proteínas dos plastos que están dispoñibles en liña.[14][15]
Segundo estes estudos, o proteoma do tilacoide consta de polo menos 335 proteínas diferentes. Delas, 89 están no lume, 116 son proteínas integrais de membrana, 62 son proteínas periféricas situadas no lado estromático da membrana, e 68 son proteínas periféricas do lado luminal. Ademais, predícese por métodos computacionais a existencia doutras proteínas luminais pouco abundantes.[12][16] Entre as proteínas tilacoidais con funcións coñecidas, o 42% están implicadas na fotosíntese. O seguinte grupo funcional máis grande de proteínas comprende as proteínas implicadas no transporte ao obxectivo, procesamento e pregamento de proteínas co 11% do total, resposta ao estrés oxidativo (9%) e tradución de proteínas (8%).[14]
Proteínas integrais de membrana
[editar | editar a fonte]A membrana dos tilacoides contén proteínas integrais de membrana que xogan un importante papel na captación de luz (están asociadas ás clorofilas) e nas reaccións luminosas da fotosíntese. Na membrana tilacoidal hai catro complexos proteicos principais:
O fotosistema II está localizado principalmente nos tilacoides da grana, e o fotosistema I e a ATP sintase está localizado principalmente nos tilacoides do estroma e as capas externas da grana. O complexo do citocromo b6f está distribuído por igual en todas as membranas tilacoidais. Debido a esta localización preferente en sitios distintos dos dous fotosistemas, requírense transportadores de electróns móbiles para transportar electróns entre eles. Estes transportadores son a plastoquinona e a plastocianina. As plastoquinonas transportan electróns do fotosistema II ao complexo do citocromo b6f, e a plastocianina transpórtaos desde o complexo do citocromo b6f ao fotosistema I.
Entre todas, estas proteína utilizan a enerxía da luz para facer funcionar a cadea de transporte de electróns cloroplástica que xera un potencial quimiósmótico a través da membrana tilacoidal (necesario para a produción de ATP) e forma NADPH, un produto da reacción redox terminal da cadea. A ATP sintase utiliza o potencial quimioosmótico para producir ATP durante a fotofosforilación.
Fotosistemas
[editar | editar a fonte]- Artigo principal: Fotosistema.
Os fotosistemas son centros redox captadores de luz, cada un dos cales consta dun complexo antena que utiliza clorofilas e pigmentos fotosintéticos accesorios, como carotenoides e ficobiliproteínas para captar luz de varias lonxitudes de onda. Cada complexo antena ten entre 250 e 400 moléculas de pigmentos e a enerxía que absorben é transportada por resonancia a unha clorofila a especializada no centro de reacción de cada fotosistema. Cando unha clorofila a do centro de reacción absorbe enerxía, excítase un electrón, que é transferido a unha molécula aceptora de electróns. O fotosistema I contén un par de moléculas de clorofila a denominadas P700, xa que este centro de reacción absorbe luz cunha lonxitude de onda de 700 nm . O fotosistema II contén a clorofila P680 que absorbe luz de 680 nm (estas lonxitudes de onda corresponden co vermello profundo do espectro visible). O P é a abreviación de pigmento e o número é o pico de absorción específico de luz desa lonxitude de onda en nanómetros que fan as moléculas de clorofila en cada centro de reacción.
Complexo do citocromo b6f
[editar | editar a fonte]- Artigo principal: complexo do citocromo b6f.
O complexo do citocromo b6f é parte da cadea de transporte electrónico tilacoidal e combina o transporte de electróns co bombeo de protóns cara ao interior do tilacoide. Para este bombeo está asociado con plastoquinonas. Enerxeticamente, está situado entre os dous fotosistemas e transfire electróns do fotosistema II-plastoquinona ao fotosistema I-plastocianina.
ATP sintase
[editar | editar a fonte]- Artigo principal: ATP sintase.
A ATP sintase tilacoidal é unha CF1FO-ATP sintase similar á ATPase mitocondrial. Está integrada na membrana tilacoidal coa porción CF1 asomando ao estroma. Deste modo, a síntese de ATP ten lugar no lado estromático dos tilacoides onde se necesita ATP para as reaccións da fase escura da fotosíntese.
Proteínas do lume tilacoidal
[editar | editar a fonte]A proteína de transporte electrónico plastocianina está presente no lume e transporta electróns entre o complexo proteico do citocromo b6f ao fotosistema I. Polo contrario, as plastoquinonas son liposolubles e móvense dentro da membrana do tilacoide.
O lume dos tilacoides é tamén o sitio da oxidación de auga polo complexo liberador de osíxeno asociado co lado luminal do fotosistema II.
As proteínas luminais poden ser preditas computacionalmente baseándose nos seus sinais de destino (targeting signals). En Arabidopsis, á parte das proteínas luminais preditas que presentan o sinal Tat, o grupo máis grande de proteínas con función coñecida están implicadas o 19% no procesamento de proteínas (proteólise e pregamento), o 18% na fotosíntese, o 11% no metabolismo, e o 7% no transporte de electróns e defensa.[12]
Expresión das proteínas tilacoidais
[editar | editar a fonte]Os cloroplastos teñen o seu propio xenoma, que codifica varias proteínas dos tilacoides. Porén, durante o decurso da evolución dos plastos a partir dos seus antepasados cianobacterianos endosimbióticos, produciuse unha extensa transferencia de xenes do xenoma do cloroplasto ao núcleo celular. Isto deu lugar a que catro complexos proteicos principais dos tilacoides sexan codificados en parte polo xenoma dos cloroplastos e en parte polo xenoma nuclear. As plantas desenvolveron varios mecanismos que corregulan a expresión de diferentes subunidades codificadas en dous orgánulos diferentes para asegurar unha estequiometría axeitada e a correcta ensamblaxe destes complexos proteicos. Por exemplo, a transcrición de xenes nucleares que codifican partes do aparato fotosintético está regulada pola luz. A bioxénese, estabilidade e reciclaxe dos complexos proteicos tilacoidais está regulada pola fosforilación por medio de quinases sensibles a redox das membranas tilacoidais.[17] A velocidade da tradución de proteínas codificadas nos cloroplastos está controlada pola presenza ou ausencia das subunidades coas que se teñen que ensamblar (control por epistase de síntese).[18] Este mecanismo implica unha retroalimentación negativa por medio da unión das proteínas en exceso á rexión 5' UTR do ARNm do cloroplasto.[19] Os cloroplastos tamén necesitan equilibrar as proporcións de fotosistemas I e II para o funcionamento da cadea de transporte de electróns. O estado redox do transportador de electróns plastoquinona na membrana tilacoidal afecta directamente a transcrición de xenes do cloroplasto que codifican proteínas dos centros de reacción dos fotosistemas, para contrarrestar así os desequilibrios na cadea de transporte electrónico.[20]
Envío ao seu destino das proteínas tilacoidais
[editar | editar a fonte]
As proteínas dos tilacoides son dirixidas ao seu destino por medio de péptidos sinal e por vías secretoras de tipo procariótico do interior do cloroplasto. A maioría das proteínas dos tilacoides codificadas no xenoma nuclear das plantas necesitan dúas marcas para a súa correcta chegada ao destino: Un péptido sinal de destino cloroplástico N-terminal (en amarelo na figura), e un péptido sinal de destino tilacoidal (mostrado en azul). As proteínas impórtanse a través dos complexos translocón das membranas interna e externa (complexos TIC e TOC).
As proteínas enviadas aos tilacoides poden estar destinadas á membrana tilacoidal ou ao lume tilacoidal. As destinadas á membrana tilacoidal, unha vez que entran no cloroplasto, sofren a separación do seu primeiro péptido sinal de destino (amarelo) pola acción dunha protease que procesa proteínas importadas. Isto deixa exposto o segundo péptido sinal de destino (azul) e a proteína é exportada desde o estroma ao tilacoide nun segundo paso. Este segundo paso require a actuación de compoñentes de translocación de certas proteínas dos tilacoides e é dependente de enerxía. As proteínas son inseridas na membrana pola vía dependente de SRP (1 na figura), ou pola vía dependente de Tat (2), ou espontaneamente por medio dos seus dominios transmembrana (non mostrados na figura). As proteínas destinadas ao lume expórtanse a través das membranas tilacoidais cara ao lume por dúas posibles vías: pola vía dependente de Tat (2) ou pola dependente de Sec (3), e liberadas por corte (clivaxe) do péptido sinal de destino tilacoidal (azul).
As diferentes vías utilizan diferentes sinais e fontes de enerxía. A vía Sec (secretora) require ATP como fonte de enerxía e consta de SecA, que se une á proteína importada, e un complexo de membrana Sec para transportar a proteína a través da membrana. As proteínas cun motivo de arxinina xemelga no seu péptido sinal tilacoidal son transportadas pola vía Tat (translocación de arxinina xemelga, twin arginine translocation), que require un complexo Tat unido a membranas e un gradiente de pH como fonte de enerxía. Algunhas outras proteínas son inseridas na membrana pola vía SRP (partícula de recoñecemento do sinal, signal recognition particle). A SRP do cloroplasto pode interaccionar coas proteínas diana que ten que transportar de modo postraducional ou cotraducional, transportando así proteínas importadas e tamén as que son traducidas dentro do propio cloroplasto. A vía SRP require GTP e un gradiente de pH como fontes de enerxía. Algunhas proteínas transmembrana poden tamén inserirse espontaneamente na membrana desde o lado estromático sen requirimento de enerxía.[21]
Funcións dos tilacoides
[editar | editar a fonte]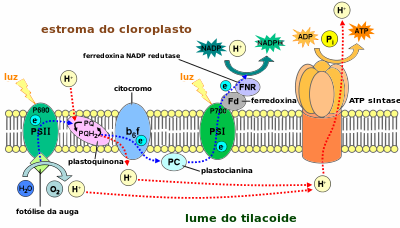
Os tilacoides son o lugar onde se producen as reaccións da fase luminosa da fotosíntese. Estas inclúen a oxidación da auga (fotólise da auga) e liberación de osíxeno, o bombeo de protóns a través da membrana tilacoidal combinado co transporte de electróns por unha cadea de transportadores entre os fotosistemas (fotosistema II-plastoquinonas-complexo do citocromo b6f-plastocianina-fotosistema I-ferredoxina-ferredoxina-NADP+ redutase), e a síntese de ATP na ATP sintase tilacoidal utilizando o gradiente de protóns xerado (fotofosforilación).
Fotólise da auga
[editar | editar a fonte]O primeiro paso da fotosíntese é a fotólise da auga, na cal a molécula de auga se oxida e desfai orixinando O2 (que se libera á atmosfera), electróns (que circularán pola cadea de transportadores de electróns tilacoidais) e protóns (que quedan no interior do tilacoide e axudan á formación do gradiente de protóns). A reacción ocorre no lado luminal da membrana tilacoidal, está impulsada pola luz, e ten lugar no complexo liberador de osíxeno asociado ao fotosistema II.
Cadea de transporte de electróns
[editar | editar a fonte]- Artigos principais: cadea de transporte de electróns, fase luminosa e fotofosforilación.
Durante a fotosínte utilízanse dúas variantes do transporte de electróns, que son:
- Transporte electrónico acíclico ou fotofosforilación acíclica, que produce NADPH + H+ e ATP. Nela interveñen os dous fotosistemas, polo que se desprenden electróns nas clorofilas de ambos os fotosistemas, que son recuperados cos electróns procedentes da fotólise da auga. Os electróns flúen desde a auga ao NADP+ pasando polos dous fotosistemas.
- Transporte electrónico cíclico ou fotofosforilación cíclica produce só ATP. Nela só intervén o fotosistema I, polo que só circulan electróns procedentes das clorofilas deste fotosistema. Os electróns non chegan ao NADP+, senón que regresan ao fotosistema I. Hai bombeo de protóns e, por tanto, produción de ATP.
Quimioósmose
[editar | editar a fonte]- Artigo principal: Quimiosmose.
A principal función da membrana tilacoidal e os seus fotosistemas e transportadores de electróns é establecer un potencial quimioosmótico. Os transportadores da cadea de transportadores de electróns utilizan parte da enerxía dos electróns para transportar protóns activamente desde o estroma ao lume do tilacoide. Durante a fotosíntese, o lume tilacoidal faise ácido (pH 4) comparado co estroma (pH 8). Esta diferenza representa un gradiente de concentración de protóns de 10.000 veces a un lado e outro da membrana tilacoidal.
Fonte do gradiente de protóns
[editar | editar a fonte]Os protóns que se acumulan no lume teñen dúas procedencias:
- A fotólise da auga libera protóns procedentes da rotura das moléculas de auga que estaban no interior do tilacoide, que ten lugar no complexo asociado ao fotosistema II.
- Durante a transferencia de electróns acíclica, as plastoquinonas toman protóns do estroma reducíndose a plastoquinol, e cando este é oxidado no complexo do citocromo b6f os protóns son liberados no lume tilacoidal.
- Durante o transporte de electróns cíclico a única fonte de protóns para crear o gradiente son os que as plastoquinonas transfiren desde o estroma ao lume tilacoidal cando son reducidas pola ferredoxina.
Ademais, a diferenza na concentración de protóns tamén está incrementada polo consumo de protóns do estroma que se fai cando se forma NADPH a partir do NADP+ na ferredioxina-NADP+ redutase.
Xeración de ATP
[editar | editar a fonte]O mecanismo molecular para a xeración de ATP nos tilacoides é similar ao mitocondrial, e utiliza a enerxía da forza protón motriz. Porén, os cloroplastos dependen máis do potencial químico da forza protón motriz para xerar o potencial de enerxía requirido para a síntese de ATP. A forza protón motriz é a suma do potencial químico protónico (dado polo gradiente de concentración de protóns) e do potencial eléctrico transmembrana (dado pola separación de cargas eléctricas a ambos os lados da membrana). Comparadas coa membrana interna mitocondrial, que ten un potencial de membrana significativamente maior debido á separación de cargas, as membranas tilacoidais carecen deste gradiente de carga. Para compensar isto, o gradiente de concentración de protóns de 10.000 veces que hai na membrana tilacoidal é moito maior ca o de só 10 veces existente na membrana mitocondrial interna. O potencial quimiosmótico resultante entre o lume e o estroma é grande dabondo como para impulsar a síntese de ATP na ATP sintase.
Membranas tilacoidais en cianobacterias
[editar | editar a fonte]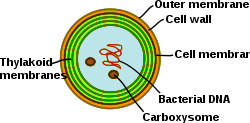
As cianobacterias son procariotas fotosintéticos con sistemas membranosos internos moi diferenciados, que reciben o nome de tilacoides. Non teñen cloroplastos (o propio cloroplasto orixinouse endosimbioticamente a partir dunha bacteria completa) pero si estes sistemas membranosos onde se encontra o seu sistema fotosintético. Nestes sistemas de membrana encóntranse os transportadores de electróns fotosintéticos e os da respiración celular. Os diferentes sistemas de membranas que posúen teñen nelas unha complexidade única entre as bacterias. As cianobacterias deben poder reorganizar as membranas, sintetizar novos lípidos de membrana, e destinar axeitadamente as proteínas ao sistema de membranas correcto. A membrana bacteriana externa (ou capa externa da parede gramnegativa), a membrana plasmática, e as membranas tilacoidais teñen cada unha funcións especializadas nas cianobacterias, e algúns aspectos do seu funcionamento aínda non se coñecen ben.[22]
Notas
[editar | editar a fonte]- ↑ Coordinadores: Jaime Gómez Márquez, Ana Mª Viñas Díaz e Manuel González González. Redactores: David Villar Docampo e Luís Vale Ferreira. Revisores lingüísticos: Víctor Fresco e Mª Liliana Martínez Calvo. (2010). Dicionario de bioloxía galego-castelán-inglés. (PDF). Xunta de Galicia. p. 90. ISBN 978-84-453-4973-1.
- ↑ "Photosynthesis" McGraw Hill Encyclopedia of Science and Technology, 10th ed. 2007. Vol. 13 p. 469
- ↑ Sato N (2004). "Roles of the acidic lipids sulfoquinovosyl diacylglycerol and phosphatidylglycerol in photosynthesis: their specificity and evolution". J Plant Res 117 (6): 495–505. PMID 15538651. doi:10.1007/s10265-004-0183-1.
- ↑ "photosynthesis."Encyclopædia Britannica. 2008. Encyclopædia Britannica 2006 Ultimate Reference Suite DVD 9 Apr. 2008
- ↑ Spraque SG (1987). "Structural and functional organization of galactolipids on thylakoid membrane organization". J Bioenerg Biomembr 19 (6): 691–703. PMID 3320041. doi:10.1007/BF00762303.
- ↑ Benning C; Xu C; Awai K (2006). "Non-vesicular and vesicular lipid trafficking involving plastids". Curr Opin Plant Biol 9 (3): 241–7. PMID 16603410. doi:10.1016/j.pbi.2006.03.012.
- ↑ and Garab; Mustardy, L., Buttle, K., Steinbach, G., G.; Steinbach, G; Garab, G (2008). "The Three-Dimensional Network of the Thylakoid Membranes in Plants: Quasihelical Model of the Granum-Stroma Assembly". Plant Cell 20 (10): 2552–2557. PMC 2590735. PMID 18952780. doi:10.1105/tpc.108.059147.
- ↑ Aseeva E; hl F; Sippel C; Cho W; Stein B; Eichacker L; Meurer J; Wanner G; Westhoff P (2007). "Vipp1 is required for basic thylakoid membrane formation but not for the assembly of thylakoid protein complexes". Plant Physiol Biochem 45 (2): 119–28. PMID 17346982. doi:10.1016/j.plaphy.2007.01.005.
- ↑ Westphal S; Heins L; Soll J; Vothknecht U (2001). "Vipp1 deletion mutant of Synechocystis: A connection between bacterial phage shock and thylakoid biogenesis?". Proc Natl Acad Sci USA 98 (7): 4243–8. PMC 31210. PMID 11274448. doi:10.1073/pnas.061501198.
- ↑ Liu C; Willmund F; Golecki J; Cacace S; Markert C; Heß B, Schroda M; Schroda, M (2007). "The chloroplast HSP70B-CDJ2-CGE1 chaperones catalyse assembly and disassembly of VIPP1 oligomers in Chlamydomonas". Plant J. Epub ahead of print (2): 265–77. PMID 17355436. doi:10.1111/j.1365-313X.2007.03047.x.
- ↑ Kroll D; Meierhoff K; Bechtold N; Kinoshita M; Westphal S; Vothknecht U; Soll J; Westhoff P (2001). "VIPP1, a nuclear gene of Arabidopsis thaliana essential for thylakoid membrane formation". Proc Natl Acad Sci USA 98 (7): 4238–42. PMC 31209. PMID 11274447. doi:10.1073/pnas.061500998.
- ↑ 12,0 12,1 12,2 Peltier J; Emanuelsson O; Kalume D; Ytterberg J; Friso G; Rudella A; Liberles D; derberg L; Roepstorff P (2002). "Central Functions of the Lumenal and Peripheral Thylakoid Proteome of Arabidopsis Determined by Experimentation and Genome-Wide Prediction". Plant Cell 14 (1): 211–36. PMC 150561. PMID 11826309. doi:10.1105/tpc.010304.
- ↑ van Wijk K (2004). "Plastid proteomics". Plant Physiol Biochem 42 (12): 963–77. PMID 15707834. doi:10.1016/j.plaphy.2004.10.015.
- ↑ 14,0 14,1 Friso G; Giacomelli L; Ytterberg A; Peltier J; Rudella A; Sun Q; Wijk K (2004). "In-Depth Analysis of the Thylakoid Membrane Proteome of Arabidopsis thaliana Chloroplasts: New Proteins, New Functions, and a Plastid Proteome Database". Plant Cell 16 (2): 478–99. PMC 341918. PMID 14729914. doi:10.1105/tpc.017814.- The Plastid Proteome Database
- ↑ Kleffmann T; Hirsch-Hoffmann M; Gruissem W; Baginsky S (2006). "plprot: a comprehensive proteome database for different plastid types". Plant Cell Physiol 47 (3): 432–6. PMID 16418230. doi:10.1093/pcp/pcj005. – Plastid Protein Database
- ↑ Peltier J; Friso G; Kalume D; Roepstorff P; Nilsson F; Adamska I; van Wijk K (2000). "Proteomics of the Chloroplast: Systematic Identification and Targeting Analysis of Lumenal and Peripheral Thylakoid Proteins". Plant Cell 12 (3): 319–41. PMC 139834. PMID 10715320. doi:10.1105/tpc.12.3.319.
- ↑ Vener AV; Ohad I; Andersson B (1998). "Protein phosphorylation and redox sensing in chloroplast thylakoids". Curr Opin Plant Biol 1 (3): 217–23. PMID 10066592. doi:10.1016/S1369-5266(98)80107-6.
- ↑ Choquet Y; Wostrikoff K; Rimbault B; Zito F; Girard-Bascou J; Drapier D; Wollman F (2001). "Assembly-controlled regulation of chloroplast gene translation". Biochem Soc Trans 29 (Pt 4): 421–6. PMID 11498001. doi:10.1042/BST0290421.
- ↑ Minai L; Wostrikoff K; Wollman F; Choquet Y (2006). "Chloroplast Biogenesis of Photosystem II Cores Involves a Series of Assembly-Controlled Steps That Regulate Translation". Plant Cell 18 (1): 159–75. PMC 1323491. PMID 16339851. doi:10.1105/tpc.105.037705.
- ↑ Allen J; Pfannschmidt T (2000). "Balancing the two photosystems: photosynthetic electron transfer governs transcription of reaction centre genes in chloroplasts". Philos Trans R Soc Lond B Biol Sci 355 (1402): 1351–9. PMC 1692884. PMID 11127990. doi:10.1098/rstb.2000.0697.
- ↑ Gutensohn M; Fan E; Frielingsdorf S; Hanner P; Hou B; Hust B; Klösgen R (2006). "Toc, Tic, Tat et al.: structure and function of protein transport machineries in chloroplasts". J. Plant Physiol. 163 (3): 333–47. PMID 16386331. doi:10.1016/j.jplph.2005.11.009.
- ↑ Herrero A and Flores E (editor). (2008). Caister Academic Press, ed. The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st ed.). ISBN 1-904455-15-8. [1].
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Heller, H. Craig; Orians, Gordan H.; Purves, William K.; & Sadava, David (2004). Sinauer Associates, Inc., ed. LIFE: The Science of Biology (7th ed.). ISBN 0-7167-9856-5.
- Raven, Peter H.; Ray F. Evert; Susan E. Eichhorn (2005). W.H. Freeman and Company Publishers, ed. Biology of Plants (7th ed.). New York. pp. 115–127. ISBN 0-7167-1007-2.
- Herrero A and Flores E (editors). (2008). Caister Academic Press, ed. The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st ed.). ISBN 978-1-904455-15-8.
