Fotosistema I
| Fotosistema I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Fotosistema I das plantas con LHC I | |||||||||
| Identificadores | |||||||||
| Número EC | 1.97.1.12 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| |||||||||

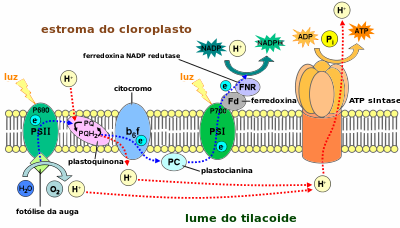
O fotosistema I (FSI ou PSI polas súas siglas en inglés) ou plastocianina–ferredoxina oxidorredutase) é un dos dous fotosistemas que interveñen nas reaccións luminosas da fotosíntese de plantas, algas e cianobacterias. O fotosistema I [1] é un complexo proteico integral de membrana que usa a enerxía da luz para catalizar unha transferencia de electróns a través da membrana dos tilacoides desde a plastocianina á ferredoxina. Finalmente, os electróns que son transferidos polo fotosistema I utilízanse para producir o carrexador de hidróxenos de enerxía moderada NADPH.[2] A enerxía do fotón absorbida polo fotosistema I tamén produce unha forza protón-motriz que se utiliza para xerar ATP. O fotosistema I está composto por máis de 110 cofactores, que son bastantes máis que os do fotosistema II.[3]
Historia[editar | editar a fonte]
Este fotosistema coñécese como I porque foi descuberto antes que o fotosistema II, aínda que posteriores experimentos mostraron que, en realidade, o fotosistema II é o primeiro dos encimas da cadea de transporte de electróns fotosintética. Varias características do fotosistema I descubríronse na década de 1950, pero a importancia destes descubrimentos non se recoñeceu naquel momento.[4] Louis Duysens foi o que propuxo primeiro os conceptos de fotosistemas I e II en 1960 e, ese mesmo ano, Fay Bendall e Robert Hill utilizaron os anteriores coñecementos para elaborar unha teoría coherente da serie de reaccións fotosintéticas.[4] A hipótese de Hill e Bendall foi despois confirmada en experimentos realizados en 1961 polos grupos de Duysens e Witt.[4]
Compoñentes e acción[editar | editar a fonte]
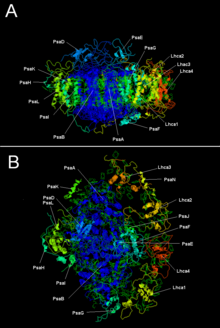
Dúas das subunidades principais do fotosistema I chamadas PsaA e PsaB son proteínas estreitamente relacionadas implicadas na unión dos cofactores de transferencia de electróns vitais P700, Acc, A0, A1 e Fx. As subunidades PsaA e PsaB son ambas proteínas integrais de membranas de 730 a 750 aminoácidos que conteñen 11 segmentos transmembrana. Un grupo ferrosulfurado [4Fe-4S] chamado Fx está coordinado por catro cisteínas; da cales dúas as proporcionan cada unha das subunidades. Esas dúas cisteínas de cada subunidade están en posición proximal e localizadas nun bucle entre o noveno e o décimo segmentos transmembrana. Augas abaixo das cisteínas parece que hai un motivo de cremalleira de leucina[5] que podería contribuír á dimerización de PsaA/PsaB. Os aceptores de electróns terminais FA e FB e tamén o grupo ferrosulfurado [4Fe-4S] están localizados nunha proteína de 9-kDa chamada PsaC que se une ao núcleo PsaA/PsaB preto de FX.[6][7]
| Subunidades proteicas | Descrición |
|---|---|
| PsaA | Proteínas transmembrana grandes relacionadas implicadas na unión de P700, A0, A1 e Fx. Parte da familia de proteínas do centro de reacción fotosintético. |
| PsaB | |
| PsaC | Centro ferrosulfurado; apoproteína para Fa e Fb |
| PsaD | Necesario para a ensamblaxe, axuda á unión da ferredoxina. IPR003685 |
| PsaE | IPR003375 |
| PsaI | Pode estabilizar a PsaL. Estabiliza a unión do complexo captador de luz das plantas verdes II.[9] IPR001302 |
| PsaJ | IPR002615 |
| PsaK | IPR035982 |
| PsaL | IPR036592 |
| PsaM | IPR010010 |
| PsaX | IPR012986 |
| complexo do citocromo b6f | Proteína soluble |
| Fa | De PsaC; na cadea de transporte de electróns (CTE) |
| Fb | De PsaC; na CTE |
| Fx | De PsaAB; na CTE |
| Ferredoxina | Transportador de electróns na CTE |
| Plastocianina | Proteínas solubles |
| Lípidos | Descrición |
| MGDG II | Lípido monogalactosildiglicérido |
| PG I | Fosfolípido fosfatidilglicerol |
| PG III | Fosfolípido fosfatidilglicerol |
| PG IV | Fosfolípido fosfatidilglicerol |
| Pigmentos | Descrición |
| Clorofila a | 90 moléculas de pigmentos no sistema antena |
| Clorofila a | 5 moléculas de pigmentos na CTE |
| Clorofila a0 | Aceptor electrónico temperán de clorofilas modificadas na CTE |
| Clorofila a′ | 1 molécula de pigmento na CTE |
| β-Caroteno | 22 moléculas de pigmentos carotenoides |
| Coencimas e cofactores | Descrición |
| QK-A | Aceptor electrónico temperán vitamina K1 filoquinona na CTE |
| QK-B | Aceptor electrónico temperán vitamina K1 filoquinona na CTE |
| FNR | Encima ferredoxina-NADP+ oxidorreductase |
| Ca2+ |
Ión calcio |
| Mg2+ |
Ión magnesio |
Fotón[editar | editar a fonte]
A fotoexcitación de moléculas de pigmentos no complexo antena induce a transferencia de electróns e enerxía.[10]
Complexo antena[editar | editar a fonte]
O complexo antena está composto por moléculas de clorofila e carotenoides asociadas a dúas proteínas.[11] Estas moléculas de pigmento transmiten a enerxía de resonancia dos fotóns cando son fotoexcitadas. As moléculas antena poden absorber todas as lonxitudes de onda da luz do espectro visible.[12] O número destas moléculas de pigmentos varía de organismo en organismo. Por exemplo, a cianobacteria Synechococcus elongatus (Thermosynechococcus elongatus) ten unhas 100 clorofilas e 20 carotenoides, mentres que aos cloroplastos das espinacas teñen unhas 200 clorofilass e 50 carotenoides.[12][3] Dentro do complexo antena do fostosistema I hai moléculas de clorofila chamadas centros de reacción P700. A enerxía que pasa polas moléculas da antena é dirixida ao centro de reacción. Pode haber desde unhas 120 a só 25 moléculas de clorofila por cada P700.[13]
Centro de reacción P700[editar | editar a fonte]
- Artigo principal: P700.
O centro de reacción P700 está composto por unha clorofilla a modificada que absorbe mellor a luz a unha lonxitude de onda de 700 nm.[14] O P700 recibe enerxía das moléculas antena e usa a enerxía de cada fotón para elevar un electrón a un nivel de enerxía máis alto (P700*). Estes electróns móvense en pares nun proceso de oxidación/redución desde o P700* a aceptores electrónicos, deixando un P700+. O par P700* - P700+ ten un potencial eléctrico duns −1,2 volts. O centro de reacción está feito de dúas moléculas de clorofilas e, por tanto, denomínase dímero.[11] O dímero pénsase que está composto por unha molécula de clorofila a e mais unha clorofila a′. Porén, se o P700 forma un complexo con outras moléculas antena, xa non pode ser un dímero.[13]
Clorofilas A0 e A1 modificadas[editar | editar a fonte]
As dúas moléculas de clorofila modificadas son aceptores de electróns temperáns do fotosistema I. Hai unha a cada lado do PsaA/PsaB, formando dúas ramas que os electróns poden utilizar para chegar a Fx. A0 acepta electróns de P700*, pásaos a A1 do mesmo lado, que despois pasa o electrón á quinona do mesmo lado. Diferentes especies parecen ter distintas preferencias polas ramas A ou B.[15]
Filoquinona[editar | editar a fonte]
Unha filoquinona, ás veces chamada vitamina K1,[16] é o seguinte aceptor de electróns temperán do fotosistema I. Oxida A1 para recibir o electrón e á súa vez é reoxidado por Fx, desde o cal o electrón pasa a Fb e Fa.[16][17] A redución de Fx parece ser o paso limitante da velocidade do proceso.[15]
Complexo ferro-xofre[editar | editar a fonte]
No fotosistema I encóntranse tres centros de reacción ferrosulfurados proteicos. Denomínanse Fx, Fa e Fb e funcionan como relés electrónicos.[18] Fa e Fb únense a subunidades proteicas do complexo do fotosistema I e Fx está ligado ao complexo do fotosistema I.[18] Varios experimentos mostran certa disparidade entre teorías da orientación do cofactor ferrosulfurado e a orde de operación.[18] Nun modelo, Fx pasa un electrón a Fa, que o pasa a Fb para chegar á ferredoxina.[15]
Ferredoxina[editar | editar a fonte]
A ferredoxina (Fd) é unha proteína soluble que facilita a redución do NADP+
a NADPH.[19] A ferredoxina móvese para transportar un electrón ou a un tilacoide solitario ou a un encima que reduce o NADP+
.[19] As membranas tilacoidais teñen un sitio de unión para cada función da ferredoxina.[19] A principal función da ferredoxina é transportar un electrón desde o complexo ferrosulfurado ao encima ferredoxina–NADP+
redutase.[19]
Ferredoxina–NADP+
redutase (FNR)[editar | editar a fonte]
Este encima transfire o electrón desde a ferredoxina reducida ao NADP+
para completar a redución do NADPH.[20] A FNR pode tamén aceptar un electrón do NADPH ao unirse a esta molécula.[20]
Plastocianina[editar | editar a fonte]
A plastocianina é un transportador de electróns que transfire o electrón desde o citocromo b6f ao cofactor P700 do fotosistema I no seu estado ionizado P700+.[10][21]
Proteína Ycf4[editar | editar a fonte]
A proteína Ycf4, que se atopa na membrana do tilacoide, é vital para o fotosistema I. Esta proteína transmembrana tilacoidal axuda a ensamblar os compoñentes do fotosistema I. Sen ela, a fotosíntese sería ineficaz.[22]
Evolución[editar | editar a fonte]
Os datos moleculares mostran que o fotosistema I probablemente evolucionou dos fotosistemas das bacterias verdes do xofre. Os fotosistemas das bacterias verdes do xofre e os das cianobacterias, algas e plantas superiores non son iguais, pero hai moitas funcións análogas e estruturas similares. Outras tres características son similares nos diferentes fotosistemas.[23] Primeiro, o potencial redox é suficientemente negativo como para poder reducir a ferredoxina.[23] Despois, os centros de reacción aceptores de electróns inclúen as proteínas ferrosulfurados.[23] Por último, os centros redox dos complexos de ambos os fotosistemas están construídos sobre un dímero de subunidades proteicas.[23] O fotosistema das bacterias verdes do xofre mesmo contén todos os mesmos cofactores da cadea de transporte de electróns do fotosistema I.[23] O número e grao de semellanza entre os dous fotosistemas indica fortemente que o fotosistema I e o fotosistema análogo das bacterias verdes do xofre evolucionaron a partir dun fotosistema ancestral común.
Notas[editar | editar a fonte]
- ↑ Golbeck JH (1987). "Structure, function and organization of the Photosystem I reaction center complex". Biochimica et Biophysica Acta (BBA) - Reviews on Bioenergetics 895 (3): 167–204. PMID 3333014. doi:10.1016/s0304-4173(87)80002-2.
- ↑ Yamori W, Shikanai T (abril de 2016). "Physiological Functions of Cyclic Electron Transport Around Photosystem I in Sustaining Photosynthesis and Plant Growth". Annual Review of Plant Biology 67: 81–106. PMID 26927905. doi:10.1146/annurev-arplant-043015-112002.
- ↑ 3,0 3,1 Nelson N, Yocum CF (2006). "Structure and function of photosystems I and II". Annual Review of Plant Biology 57: 521–65. PMID 16669773. doi:10.1146/annurev.arplant.57.032905.105350.
- ↑ 4,0 4,1 4,2 Fromme P, Mathis P (2004). "Unraveling the photosystem I reaction center: a history, or the sum of many efforts". Photosynthesis Research 80 (1–3): 109–24. PMID 16328814. doi:10.1023/B:PRES.0000030657.88242.e1.
- ↑ Webber AN, Malkin R (maio de 1990). "Photosystem I reaction-centre proteins contain leucine zipper motifs. A proposed role in dimer formation". FEBS Letters 264 (1): 1–4. PMID 2186925. doi:10.1016/0014-5793(90)80749-9.
- ↑ Jagannathan B, Golbeck JH (abril de 2009). "Breaking biological symmetry in membrane proteins: the asymmetrical orientation of PsaC on the pseudo-C2 symmetric Photosystem I core". Cellular and Molecular Life Sciences 66 (7): 1257–70. PMID 19132290. doi:10.1007/s00018-009-8673-x.
- ↑ Jagannathan B, Golbeck JH (xuño de 2009). "Understanding of the binding interface between PsaC and the PsaA/PsaB heterodimer in photosystem I". Biochemistry 48 (23): 5405–16. PMID 19432395. doi:10.1021/bi900243f.
- ↑ Saenger W, Jordan P, Krauss N (abril de 2002). "The assembly of protein subunits and cofactors in photosystem I". Current Opinion in Structural Biology 12 (2): 244–54. PMID 11959504. doi:10.1016/S0959-440X(02)00317-2.
- ↑ Plöchinger, Magdalena; Torabi, Salar; Rantala, Marjaana; Tikkanen, Mikko; Suorsa, Marjaana; Jensen, Poul-Erik; Aro, Eva Mari; Meurer, Jörg (setembro de 2016). "The Low Molecular Weight Protein PsaI Stabilizes the Light-Harvesting Complex II Docking Site of Photosystem I". Plant Physiology 172 (1): 450–463. PMC 5074619. PMID 27406169. doi:10.1104/pp.16.00647.
- ↑ 10,0 10,1 Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). "Photosynthesis, Light, and Life". Biology of Plants (7ª ed.). Nova York: W. H. Freeman. pp. 121–127. ISBN 978-0-7167-1007-3.
- ↑ 11,0 11,1 Zeiger, Eduardo; Taiz, Lincoln (2006). "Ch. 7: Topic 7.8: Photosystem I". Plant Physiology (4th ed.). Sunderland, MA: Sinauer Associates. ISBN 0-87893-856-7.[Ligazón morta]
- ↑ 12,0 12,1 "The Photosynthetic Process". Arquivado dende o orixinal o 2009-02-19.
- ↑ 13,0 13,1 Shubin VV, Karapetyan NV, Krasnovsky AA (xaneiro de 1986). "Molecular arrangement of pigment-protein complex of photosystem 1". Photosynthesis Research 9 (1–2): 3–12. PMID 24442279. doi:10.1007/BF00029726.
- ↑ Rutherford AW, Heathcote P (decembro de 1985). "Primary photochemistry in photosystem-I". Photosynthesis Research 6 (4): 295–316. PMID 24442951. doi:10.1007/BF00054105.
- ↑ 15,0 15,1 15,2 Grotjohann, I; Fromme, P (2013). "Photosystem I". Encyclopedia of biological chemistry (Second ed.). Londres. pp. 503–507. ISBN 978-0-12-378630-2. doi:10.1016/B978-0-12-378630-2.00287-5.
- ↑ 16,0 16,1 Itoh, Shigeru; Iwaki, Masayo (1989). "Vitamin K1 (Phylloquinone) Restores the Turnover of FeS centers of Ether-extracted Spinach PSI Particles". FEBS Letters 243 (1): 47–52. doi:10.1016/0014-5793(89)81215-3.
- ↑ Palace GP, Franke JE, Warden JT (maio de 1987). "Is phylloquinone an obligate electron carrier in photosystem I?". FEBS Letters 215 (1): 58–62. PMID 3552735. doi:10.1016/0014-5793(87)80113-8.
- ↑ 18,0 18,1 18,2 Vassiliev IR, Antonkine ML, Golbeck JH (outubro de 2001). "Iron-sulfur clusters in type I reaction centers". Biochimica et Biophysica Acta (BBA) - Bioenergetics 1507 (1–3): 139–60. PMID 11687212. doi:10.1016/S0005-2728(01)00197-9.
- ↑ 19,0 19,1 19,2 19,3 Forti, Georgio; Maria, Paola; Grubas, Giovanna (1985). "Two Sites of Interaction of Ferredoxin with thylakoids". FEBS Letters 186 (2): 149–152. doi:10.1016/0014-5793(85)80698-0.
- ↑ 20,0 20,1 Madoz J, Fernández Recio J, Gómez Moreno C, Fernández VM (novembro de 1998). "Investigation of the Diaphorase Reaction of Ferredoxin–NADP+
Reductase by Electrochemical Methods" (PDF). Bioelectrochemistry and Bioenergetics 47 (1): 179–183. doi:10.1016/S0302-4598(98)00175-5. - ↑ Hope AB (xaneiro de 2000). "Electron transfers amongst cytochrome f, plastocyanin and photosystem I: kinetics and mechanisms". Biochimica et Biophysica Acta (BBA) - Bioenergetics 1456 (1): 5–26. PMID 10611452. doi:10.1016/S0005-2728(99)00101-2.
- ↑ Boudreau E, Takahashi Y, Lemieux C, Turmel M, Rochaix JD (outubro de 1997). "The chloroplast ycf3 and ycf4 open reading frames of Chlamydomonas reinhardtii are required for the accumulation of the photosystem I complex". The EMBO Journal 16 (20): 6095–104. PMC 1326293. PMID 9321389. doi:10.1093/emboj/16.20.6095.
- ↑ 23,0 23,1 23,2 23,3 23,4 Lockau, Wolfgang; Nitschke, Wolfgang (1993). "Photosystem I and its Bacterial Counterparts". Physiologia Plantarum 88 (2): 372–381. doi:10.1111/j.1399-3054.1993.tb05512.x.
