Célula ganglionar da retina fotosensible

As células ganglionares da retina fotosensibles (CGRf ou, en inglés, pRGC), tamén chamadas células ganglionares da retina intrinsecamente fotosensibles (CGRif ou, en inglés, ipRGC) ou células ganglionares da retina que conteñen melanopsina (CGRm ou, en inglés, mRGC), son un tipo de neuronas da retina do ollo dos mamíferos. Sospeitábase da presenza de células que podían ser do tipo das CGRf xa en 1927 cando se observou que ratos sen conos nin bastóns aínda podían responder ao estímulo luminoso contraendo a pupila.[1] Isto implicaba que os bastóns e os conos non eran as únicas neuronas sensibles á luz da retina.[2] Porén, a investigación sobre estas células non avanzou ata a década de 1980. Investigacións recentes mostraron que estas células ganglionares da retina, a diferenza doutras células ganglionares da retina, son intrinsecamente fotosensibles debido á presenza no seu interior de melanopsina, unha proteína sensible á luz. Por tanto, constitúen unha terceira clase de fotorreceptores, ademais dos conos e bastóns.[3]
Resumo
[editar | editar a fonte]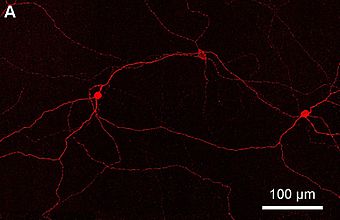
Comparadas cos conos e bastóns, as CGRf responden máis lentamente e sinalizan a presenza de luz durante un longo período.[5] Representan un subconxunto moi pequeno (~1%) das células ganglionares da retina.[6] O seu papel funcional non consiste en formar imaxes e é fundamentalmente diferente da visión de padróns; proporcionan unha representación estable da intensidade da luz ambiental. Teñen polo menos tres funcións primarias:
- Xogan un papel principal na sincronización dos ritmos circadianos do ciclo de 24 horas de luz/escuridade, proporcionando principalmente información sobre as lonxitudes do día e da noite. Envían información da luz a través do tracto retinohipotalámico directamente ao marcapasos circadiano do cerebro, o núcleo supraquiasmático do hipotálamo. As propiedades fisiolóxicas destas células ganglionares correspóndense coas propiedades coñecidas da luz diúrna do mecanismo do arrastre ou entrainment (sincronización) que regula os ritmos circadianos. Ademais, as CGRf poderían tamén influír nos tecidos periféricos como na rexeneración do folículo piloso por medio dun circuíto núcleo supraquiasmático-nervio simpático.[7]
- As CGRf inervan outros lugares do cerebro, como o centro do control pupilar, o núcleo pretectal olivar do mesencéfalo. Contribúen á regulación do tamaño pupilar e outras respostas de comportamento ás condicións lumínicas do ambiente.[8]
- Contribúen á regulación fótica e supresión fótica aguda da liberación da hormona melatonina.[8]
- En ratas, exercen algunha función na percepción da visión consciente, incluíndo a percepción de barrados regulares, niveis de luz e información espacial.[8]
As CGRf foron illadas tamén en humanos, onde, ademais de regularen os ritmos circadianos, funcionan como mediadoras no recoñecemento dun certo grao de luz en suxeitos sen bastóns nin conos que padecen trastornos dos fotorrecetores conos e bastóns.[9] Traballos realizados por Farhan H. Zaidi e colegas mostraron que as células ganglionares fotorreceptoras poden ter algunhas funcións visuais en humanos.
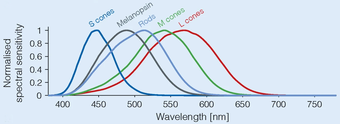
O fotopigmento das CGRf, a melanopsina, excítase pola luz principalmente na porción azul do espectro visible (picos de absorción de ~480 nanómetros[10]). O mecanismo de fototransdución nestas células non se comprende ben, mais parece probable que se asemelle ao dos fotorreceotores rabdoméricos de invertebrados. Ademais de responderen directamente á luz, estas células poden recibir influencias excitatorias e inhibitorias de bastóns e conos por medio de conexións sinápticas na retina.
Os axóns destes ganglios inervan rexións do cerebro relacionadas co recoñecemento de obxectos, como o colículo superior e o núcleo xeniculado lateral dorsal.[8]
Estrutura
[editar | editar a fonte]Receptor de CGRf
[editar | editar a fonte]
Estas células fotorreceptoras proxéctanse tanto cara á retina coma cara ao cerebro. Conteñen o fotopigmento melanopsina en cantidades variables ao longo da membrana plasmática, incluíndo a dos axóns ata o disco óptico, o soma e as dendritas da célula.[3] As CGRf conteñen receptores de membrana para os neurotransmisores glutamato, glicina e GABA.[11] As células ganglionares fotosensibles responden á luz despolarizándose, o que incrementa o ritmo ao que envían impulsos nerviosos, o cal é o comportamento oposto ao das outras células fotorreceptoras, as cales se hiperpolarizan en resposta á luz.[12]
Os resultados de estudos realizados en ratos indican que os axóns das CGRf non están mielinizados.[3]
Melanopsina
[editar | editar a fonte]A diferenza doutros pigmentos fotorreceptores, a melanopsina ten a capacidade de actuar tanto como un pigmento fotoexcitable coma unha fotoisomerase. A diferenza das opsinas visuais dos bastóns e conos, que dependen co ciclo visual estándar para recargar o todo-trans-retinal de novo no composto fotosensible 11-cis-retinal, a melanopsina pode isomerizar o all-trans-retinal a 11-cis-retinal cando é estimulada por outro fotón.[11] Por tanto, unha CGRf non depende de células de Müller ou de células do epitelio pigmentado da retina para esta conversión.
As dúas isoformas da melanopsina difiren na súa sensibilidade espectral, porque a isoforma 11-cis-retinal responde máis a lonxitudes de onda máis curtas da luz, mentres que a isoforma todo-trans responde máis a lonxitudes de onda máis longas.[13]
Entradas e saídas sinápticas
[editar | editar a fonte]
Entradas
[editar | editar a fonte]As CGRf son tanto pre- coma postsinápticas respecto ás células amácrinas dopaminérxicas por medio de sinapses recíprocas, de modo que as CGRf envían sinais excitatorios ás células amácrinas dopaminérxicas e as células amácrinas dopaminérxicas envían sinais inhibitorios ás CGRf. Estes sinais inhibitorios son mediados polo GABA, que é coliberado das células amácrinas dopaminérxicas xunto coa dopamina. A dopamina ten funcións no proceso de adaptación á luz ao regular á alza a transcrición da melanopsina nas CGRf, incrementando así a sensibilidade do fotorreceptor.[3] En paralelo coa inhibición das células amácrinas dopaminérxicas, as células amácrinas que liberan somatostatina, as cales son inhibidas polas células amácrinas dopaminérxicas, inhiben as CGRf.[14] Outras entradas sinápticas que reciben as dendritas das CGRf son as das células bipolares conos e bastóns.[11]
Saídas
[editar | editar a fonte]Unha diana postsináptica das CGRf é o núcleo supraquiasmático do hipotálamo, que funciona como un reloxo circadiano nun organismo. As CGRf liberan o polipéptido activador da adenilato ciclase da pituitaria (PACAP) e glutamato no núcleo supraquiasmático por medio dunha conexión monosináptica chamada tracto retinohipotalámico.[15] O glutamato ten un efecto excitatorio sobre as neuronas do núcleo supraquiasmático e a PACAP parece potenciar os efectos do glutamato no hipotálamo.[16]
Outras dianas postsinápticas das CGRf son: a folla interxeniculada, unha agrupación de neuronas localizadas no tálamo, que xogan un papel no arrastre circadiano; o núcleo pretectal olivar, unha agrupación de neuronas do mesencéfalo que controla o reflexo pupilar á luz; o núcleo preóptico ventrolateral, localizado no hipotálamo e é un centro de control do sono, así como a amígdala cerebral.[3]
Función
[editar | editar a fonte]Reflexo pupilar á luz
[editar | editar a fonte]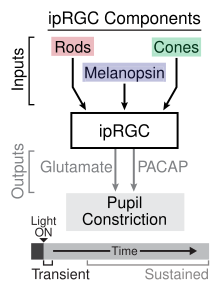
Usando varios ratos knockout para o fotorreceptor, identificouse o papel das CGRf na sinalización transitoria e sostida do reflexo pupilar á luz.[17] O reflexo pupilar á luz transitorio ocorre con intensidades de luz tenues ou moderadas e é un resultado da fototransdución que ocorre nos conos, que proporciona entradas sinápticas ás CGRf, que á súa vez depende da información do núcleo pretectal olivar do mesencéfalo.[18] O neurotransmisor que intervén no relevo da información cara ao mesencéfalo desde as CGRf no reflexo pupilar á luz transitorio é o glutamato. Con intensidades de luz máis fortes prodúcese o reflexo pupilar á luz sostido, que implica tanto a fototransdución dos bastóns proporcionando entradas ás CGRf e a fototransdución das propias CGRf por medio da melanopsina. Os investigadores suxeriron que o papel da melanopsina no reflexo pupilar á luz sostido débese á súa falta de adaptación aos estímulos luminosos en contraste cos bastóns, os cales mostran adaptación. O reflexo pupilar á luz sostido é mantido pola liberación de PACAP por parte das CGRf de maneira pulsátil.[17]
Posible papel na visión consciente
[editar | editar a fonte]Experimentos feitos con persoas carentes de conos e bastóns permitiron estudar outro posible papel do receptor. En 2007, atopouse unha nova función da célula ganglionar fotorreceptora. Zaidi e colegas mostraron que en humanos a CGRf contribúe á visión consciente, así como en funcións non formadoras de imaxes como os ritmos circadianos, comportamento de reaccións pupilares.[9] Como estas células respoden principalmente á luz azul, suxeriuse que teñen un papel na visión mesópica[Cómpre referencia] e que a vella teoría dunha retina puramente de función dobre, con visión da luz por medio de bastóns (na escuridade) e conos (na luz) era simplista. O traballo de Zaidi e colegas con humanos que carecían de conos e bastóns abriu a porta a atribuír un papel de formadoras de imaxe (visual) ás células ganglionares fotorreceptoras.
Descubriuse que hai vías paralelas para a visión: unha clásica baseada en conos e bastóns orixinada na retina externa, a outra un detector da claridade visual rudimentario orixinado na retina interna. Esta última parece ser activada pola luz antes que a primeira.[9] Os fotorreceptores clásicos tamén se alimentan do novo sistema fotorreceptor, e a constancia da cor pode ser unha importante tarefa na que interveñen, como suxeriu Foster.[19] [Cómpre referencia].
Os autores sinalaron que o modelo de persoas sen conos e bastóns que o receptor podería ser un instrumento para comprender moitas doenzas, como a principal causa da cegueira en todo o mundo, o glaucoma, unha doenza que afecta as células ganglionares.
Noutros mamíferos, os ganglios fotosensibles demostraron ter un verdadeiro papel na visión consciente. Os tests dirixidos por Jennifer Ecker et al. atoparon que as ratas que carecían de bastóns e conos podían aprender a nadar cara a secuencias de barras verticais iluminadsas en vez de a unha pantalla gris de luminiscencia homoxénea.[8]
Luz violeta a azul
[editar | editar a fonte]A maioría dos traballos indican que o pico de sensibilidade espectral do receptor está entre 460 e 484 nm. Lockley et al. en 2003[20] demostraron que as lonxitudes de onda de 460 nm (azul) da luz suprimen a melatonina o dobre que a luz de 555 nm (verde), o pico de sensibilidade do sistema visual fotópico. En investigacións feitas por Zaidi, Lockley e outros nas que se usaron persoas sen bastóns nin conos, atopouse que un estímulo moi intenso de 481 nm orixina algunha percepción da luz consciente, o que significa que se produciu algunha visión rudimentaria.[9]
Descubrimento
[editar | editar a fonte]En 1923, Clyde E. Keeler observou que as pupilas dos ollos de ratos cegos que el accidentalmente criara aínda respondían á luz.[2] A capacidade dos ratos sen conos nin bastóns de conservar un reflexo pupilar á luz suxería a presenza dunha célula fotorreceptora adicional.[11]
Na década de 1980, a investigación en ratas deficientes en conos e bastóns mostrou unha regulación da dopamina na retina, un coñecido neuromodulador para a adaptación á luz e fotoarrastre (photoentrainment).[3]
A investigación continuou en 1991, cando Russell G. Foster e colegas, incluíndo Ignacio Provencio, mostraron que os bastóns e conos non eran necesarios para o fotoarrastre, o impulsor visual do ritmo circadiano, nin para a regulación da secreción de melatonina da glándula pineal, en experimentos con ratos knocout para conos e bastóns.[21][11] Posteriores traballos feitos por Provencio e colegas mostraron que esta fotorresposta estaba mediada polo fotopigmento melanopsina, presente na capa de células ganglionares da retina.[22]
Os fotorreceptores identificounos en 2002 Samer Hattar, David Berson e colegas, e eran células ganglionares que expresaban melanopsina que posuían unha resposta á luz intrínseca e se proxectaban a varias áreas do cerebro implicadas na visión non formadora de imaxes.[23][24]
En 2005, Panda, Melyan, Qiu e colegas demonstraron que o fotopigmento melanopsina era un pigmento de fototransdución en células ganglionares.[25][26] Dennis Dacey e colegas mostraron nunha especie de mono do Vello Mundo que as células ganglionares xigantes expresan melanopsina proxectada ao núcleo xeniculado lateral.[27][6] Previamente só se coñecian as proxeccións ao mesencéfalo (núcleo pretectal) e hipotálamo (núcleos supraquiasmáticos). Porén, non se sospeitaba aínda nin estaba probado un papel visual do receptor.
Investigación
[editar | editar a fonte]Investigación en humanos
[editar | editar a fonte]Fixéronse intentos de encontrar o receptor en humanos, pero os humanos supoñían retos especiais e demandaban un novo modelo. A diferenza doutros animais, os investigadores non podían por razóns éticas inducir a perda de conos e bastóns xeneticamente ou con compostos químicos para así estudar directamente as células ganglionares. Durante moitos anos, só se podían facer inferencias sobre o receptor en humanos, aínda que estas ás veces eran pertinentes.
En 2007, Zaidi e colegas publicaron os seus traballos sobre humanos sen conos nin bastóns, mostrando que estas persoas conservaban rspostas retinianas normais a efectos non visuais da luz.[9][28] A identidade do fotorreceptor que non era cono nin bastón en humanos era a da célula ganglionar da retina interior como se mostrara previamente en modelos sen conos e bastóns doutros animais. O traballo realizouse utilizando pacientes con raras enfermidades que lles destruíran as funcións fotorreceptoras clásicas dos conos e bastóns pero que conservaran a función das células ganglionares.[9][28] Malia non teren conos nin bastóns, os pacientes continuaban mostrando fotoarranque circadiano, padróns de comportamento circadiano, supresión da melatonina e reaccións pupilares, cun pico de sensibilidades espectrais á luz ambiental e experimental que se corresponde co fotopigmento melanopsina. Os seus cerebros podían tamén asociar a visión coa luz desta frecuencia. Os médicos e científicos están agora intentando comprender o novo papel do receptor en enfermidades humanas e na cegueira.[29] As CGRf tamén foron implicadas na exacerbación da dor de cabeza pola luz durante os ataques de migrañas.[30]
Notas
[editar | editar a fonte]- ↑ Keeler, Clyde E. (1927). "Iris movements in blind mice". American Journal of Physiology 81 (1): 107–112. doi:10.1152/ajplegacy.1927.81.1.107.
- ↑ 2,0 2,1 Keeler CE (outubro de 1928). "Blind Mice". Journal of Experimental Zoology 51 (4): 495–508. doi:10.1002/jez.1400510404.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Do MT, Yau KW (outubro de 2010). "Intrinsically photosensitive retinal ganglion cells". Physiological Reviews 90 (4): 1547–81. PMC 4374737. PMID 20959623. doi:10.1152/physrev.00013.2010.
- ↑ Blume C, Garbazza C, Spitschan M (2019). "Effects of light on human circadian rhythms, sleep and mood.". Somnologie (Berl) 23 (3): 147–156. PMC 6751071. PMID 31534436. doi:10.1007/s11818-019-00215-x.
- ↑ Wong KY, Dunn FA, Berson DM (decembro de 2005). "Photoreceptor adaptation in intrinsically photosensitive retinal ganglion cells". Neuron 48 (6): 1001–10. PMID 16364903. doi:10.1016/j.neuron.2005.11.016.
- ↑ 6,0 6,1 Berson DM (xuño de 2003). "Strange vision: ganglion cells as circadian photoreceptors". Trends in Neurosciences 26 (6): 314–20. PMID 12798601. doi:10.1016/S0166-2236(03)00130-9.
- ↑ Fan SM, Chang YT, Chen CL, Wang WH, Pan MK, Chen WP, et al. (xullo de 2018). "External light activates hair follicle stem cells through eyes via an ipRGC-SCN-sympathetic neural pathway". Proceedings of the National Academy of Sciences of the United States of America 115 (29): E6880–E6889. PMC 6055137. PMID 29959210. doi:10.1073/pnas.1719548115.
- ↑ 8,0 8,1 8,2 8,3 8,4 Ecker JL, Dumitrescu ON, Wong KY, Alam NM, Chen SK, LeGates T, et al. (xullo de 2010). "Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision". Neuron 67 (1): 49–60. PMC 2904318. PMID 20624591. doi:10.1016/j.neuron.2010.05.023.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 Zaidi FH, Hull JT, Peirson SN, Wulff K, Aeschbach D, Gooley JJ, et al. (decembro de 2007). "Short-wavelength light sensitivity of circadian, pupillary, and visual awareness in humans lacking an outer retina". Current Biology 17 (24): 2122–8. PMC 2151130. PMID 18082405. doi:10.1016/j.cub.2007.11.034.
- "Blind humans lacking rods and cones retain normal responses to nonvisual effects of light". EurekAlert! (Nota de prensa). 13 de decembro de 2007.
- ↑ Berson DM (agosto de 2007). "Phototransduction in ganglion-cell photoreceptors". Pflügers Archiv 454 (5): 849–55. PMID 17351786. doi:10.1007/s00424-007-0242-2.
- ↑ 11,0 11,1 11,2 11,3 11,4 Kolb H, Fernandez E, Nelson R (1995-01-01). Kolb H, Fernandez E, Nelson R, eds. Webvision: The Organization of the Retina and Visual System. University of Utah Health Sciences Center. PMID 21413389.
- ↑ Do MT, Kang SH, Xue T, Zhong H, Liao HW, Bergles DE, Yau KW (xaneiro de 2009). "Photon capture and signalling by melanopsin retinal ganglion cells". Nature 457 (7227): 281–7. Bibcode:2009Natur.457..281D. PMC 2794210. PMID 19118382. doi:10.1038/nature07682.
- ↑ Chellappa SL, Ly JQ, Meyer C, Balteau E, Degueldre C, Luxen A, et al. (abril de 2014). "Photic memory for executive brain responses". Proceedings of the National Academy of Sciences of the United States of America 111 (16): 6087–91. Bibcode:2014PNAS..111.6087C. PMC 4000819. PMID 24616488. doi:10.1073/pnas.1320005111.
- ↑ Vuong HE, Hardi CN, Barnes S, Brecha NC (decembro de 2015). "Parallel Inhibition of Dopamine Amacrine Cells and Intrinsically Photosensitive Retinal Ganglion Cells in a Non-Image-Forming Visual Circuit of the Mouse Retina". The Journal of Neuroscience 35 (48): 15955–70. PMC 4666919. PMID 26631476. doi:10.1523/jneurosci.3382-15.2015.
- ↑ Colwell CS, Michel S, Itri J, Rodriguez W, Tam J, Lelièvre V, et al. (novembro de 2004). "Selective deficits in the circadian light response in mice lacking PACAP". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology 287 (5): R1194–201. PMID 15217792. doi:10.1152/ajpregu.00268.2004.
- ↑ Butcher GQ, Lee B, Cheng HY, Obrietan K (xuño de 2005). "Light stimulates MSK1 activation in the suprachiasmatic nucleus via a PACAP-ERK/MAP kinase-dependent mechanism". The Journal of Neuroscience 25 (22): 5305–13. PMC 6724997. PMID 15930378. doi:10.1523/jneurosci.4361-04.2005.
- ↑ 17,0 17,1 Keenan WT, Rupp AC, Ross RA, Somasundaram P, Hiriyanna S, Wu Z, et al. (setembro de 2016). "A visual circuit uses complementary mechanisms to support transient and sustained pupil constriction". eLife 5. PMC 5079752. PMID 27669145. doi:10.7554/eLife.15392.
- ↑ Gamlin PD, McDougal DH, Pokorny J, Smith VC, Yau KW, Dacey DM (marzo de). "Human and macaque pupil responses driven by melanopsin-containing retinal ganglion cells". Vision Research 47 (7): 946–54. PMC 1945238. PMID 17320141. doi:10.1016/j.visres.2006.12.015.
- ↑ David H. Foster. Color constancy. Vision Research, 51(7):674–700, abril de 2011. ISSN 0042-6989. doi:10.1016/j.visres.2010.09.006. URL [http://www.sciencedirect.com/science/article/pii/ S0042698910004402].
- ↑ Lockley SW, Brainard GC, Czeisler CA (setembro de 2003). "High sensitivity of the human circadian melatonin rhythm to resetting by short wavelength light". The Journal of Clinical Endocrinology and Metabolism 88 (9): 4502–5. PMID 12970330. doi:10.1210/jc.2003-030570.
- ↑ Foster RG, Provencio I, Hudson D, Fiske S, De Grip W, Menaker M (xullo de 1991). "Circadian photoreception in the retinally degenerate mouse (rd/rd)". Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology 169 (1): 39–50. PMID 1941717. doi:10.1007/BF00198171.
- ↑ Provencio I, Rodriguez IR, Jiang G, Hayes WP, Moreira EF, Rollag MD (xaneiro de 2000). "A novel human opsin in the inner retina". The Journal of Neuroscience 20 (2): 600–5. PMC 6772411. PMID 10632589. doi:10.1523/jneurosci.20-02-00600.2000.
- ↑ Berson DM, Dunn FA, Takao M (febreiro de 2002). "Phototransduction by retinal ganglion cells that set the circadian clock". Science 295 (5557): 1070–3. Bibcode:2002Sci...295.1070B. PMID 11834835. doi:10.1126/science.1067262.
- ↑ Hattar S, Liao HW, Takao M, Berson DM, Yau KW (febreiro de 2002). "Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity". Science 295 (5557): 1065–70. Bibcode:2002Sci...295.1065H. PMC 2885915. PMID 11834834. doi:10.1126/science.1069609.
- ↑ Panda S, Nayak SK, Campo B, Walker JR, Hogenesch JB, Jegla T (xaneiro de 2005). "Illumination of the melanopsin signaling pathway". Science 307 (5709): 600–4. Bibcode:2005Sci...307..600P. PMID 15681390. doi:10.1126/science.1105121.
- ↑ Qiu X, Kumbalasiri T, Carlson SM, Wong KY, Krishna V, Provencio I, Berson DM (febreiro de 2005). "Induction of photosensitivity by heterologous expression of melanopsin". Nature 433 (7027): 745–9. Bibcode:2005Natur.433..745Q. PMID 15674243. doi:10.1038/nature03345.
- ↑ Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J, et al. (febreiro de 2005). "Melanopsin-expressing ganglion cells in primate retina signal colour and irradiance and project to the LGN". Nature 433 (7027): 749–54. Bibcode:2005Natur.433..749D. PMID 15716953. doi:10.1038/nature03387.
- ↑ 28,0 28,1 Coghlan, Andy (2007). "How blind people see sunrise and sunset". New Scientist 196 (2635–2636): 9. doi:10.1016/S0262-4079(07)63172-8.
- ↑ Matynia A. Blurring the boundaries of vision: novel functions of intrinsically photosensitive retinal ganglion cells. J Exp Neurosci. 2013 Sep 3;7:43-50. doi: 10.4137/JEN.S11267. PMID 25157207; PMCID: PMC4089729.
- ↑ Noseda, Rodrigo (2010). "A neural mechanism for exacerbation of headache by light". Nature Neuroscience 13 (2): 239–245. PMC 2818758. PMID 20062053. doi:10.1038/nn.2475.
