Fago lambda
| Enterobacteria phage λ | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Placas de lise do fago lambda nun cultivo da bacteria E. coli | |||||||||||
| Clasificación científica | |||||||||||
| |||||||||||
O fago λ (lambda) ou colifago λ (nome completo fago λ de enterobacterias ou Enterobacteria phage λ) é un virus que infecta a bacterias, é dicir, un virus bacteriófago ou fago, e infecta concretamente á especie bacteriana Escherichia coli. Descubriuno Esther Lederberg en 1950 cando traballaba con cultivos de mesturas de dúas cepas de E. coli, e decatouse de que cando unha delas era tratada con luz ultravioleta, no cultivo formábanse placas virais (áreas con bacterias mortas).[1][2] Este virus denomínase temperado, xa que no seu ciclo vital pode reproducirse normalmente dentro da bacteria e lisala (ciclo lítico) ou pode inserir o seu xenoma no xenoma da bacteria e non lisala (ciclo lisoxénico, temperación).
As partículas do fago constan dunha cabeza (ou cápside), unha cola, e fibras da cola (ver imaxe máis abaixo). A cabeza contén o ácido nucleico xenómico, que é ADN bicatenario linear. Durante a infección, a partícula do fago recoñece e únese ao seu hóspede, E. coli, o que fai que o ADN no interior da cabeza do fago sexa inxectado a través da cola ao interior do citoplasma da célula bacteriana. Xeralmente, prodúcese un ciclo lítico no que se forman novos fagos completos dentro da bacteria, o que vai seguido da lise da célula, liberando o contido celular e a proxenie de virións no seu contorno. Porén, baixo certas condicións, o ADN do fago pode integrarse no cromosoma da célula hóspede orixinando un ciclo lisoxénico. Neste estado integrado, o ADN de λ dise que é un profago e permanece como residente dentro do xenoma do seu hóspede sen aparentemente causarlle danos á bacteria. O hóspede que contén un profago denomínase lisóxeno. Cando a bacteria se reproduce e copia o seu ADN, tamén se copia o ADN do profago, polo que todo o clon bacteriano formado levará o profago. Este profago pode entrar no ciclo lítico cando se dan certas condicións de estrés.
Estrutura
[editar | editar a fonte]
A partícula do virus consta de cabeza, cola e fibras da cola. A partícula completa consta de 12 a 14 proteínas distintas e de máis de 1000 moléculas de proteínas en total, e unha molécula de ADN localizada na cabeza do fago. Porén, aínda non está claro se as proteínas L e M forman parte do virión.[3]

O xenoma contén 48.490 pares de bases de ADN liñal bicatenario, con segmentos de febra monocatenaria de 12 bases de lonxitude situados en cada extremo 5'.[4] Estes dous segmentos monocatenarios son os "extremos cohesivos" do chamado sitio cos. O sitio cos circularíza o ADN no citoplasma do hóspede. Nesta forma circular, o xenoma do fago, ten unha lonxitude de 48.502 pares de bases (12 menos que estendido porque se aparearon entre si os dous segmentos dos extremos).[4] O xenoma de lambda pode inserirse no cromosoma de E. coli e entón denomínase profago. Ver máis abaixo para máis detalles.
Ciclo de vida
[editar | editar a fonte]Infección
[editar | editar a fonte]
O fago lambda non é un fago de cola contráctil, o que significa que durante a infección non pode "forzar" o paso do seu ADN a través da membrana celular bacteriana. En vez diso, utiliza unha vía xa existente na célula para invadir a célula hóspede, xa que o extremo da súa cola evolucionou para interaccionar cun tipo de poro específico do hóspede para introducir por el o seu ADN no hóspede.
- O fago lambda únese a unha célula de E. coli por medio da súa proteína J situada no extremo da cola. A proteína J interacciona coa porina da membrana externa de maltosa (que é produto do xene lamB bacteriano) de E. coli,[5] que é unha porina, que é parte do operón da maltosa.
- O xenoma liñal do fago introdúcese a través da membrana externa.
- O ADN pasa a través do complexo da manosa permease da membrana interna bacteriana [6] (codificada polos xenes manXYZ bacterianos) e inmediatamente circularízase utilizando os seus sitios cos, que son "extremos cohesivos" de 12 bases de lonxitude ricos en G-C. Os extremos de ADN de cadea simple virais son ligados pola ADN ligase do hóspede.

- A ADN xirase do hóspede causa uns superenrolamentos negativos nos cromosomas circulares bacterianos, facendo que as rexións ricas en A-T se desenrolen e sexan transcritas.
- A transcrición do xenoma de lambda empeza a partir dos promotores constitutivos PL, PR e PR' de lambda producindo os transcritos chamados "temperáns inmediatos". Ao principio, estes expresan os xenes N e cro, producindo as proteínas N, Cro e unha proteína inactiva curta.[7]

- A proteína Cro únese a OR3, impedindo o acceso ao promotor PRM, imposibilitando a expresión do xene cI. A proteína N únese aos dous sitios Nut (= N utilisation), un situado no xene N do marco de lectura de PL, e o outro no xene cro no marco de lectura de PR.
- A proteína N é un antiterminador, e funciona estendendo os marcos de lectura aos que se une (os transcritos son máis longos). Cando unha ARN polimerase transcribe estas rexións, recruta as proteínas N e forma un complexo con varias proteínas Nus do hóspede. Este complexo salta a maioría das secuencias de terminación. Os transcritos estendidos, máis longos (os transcritos chamados "temperáns tardíos"), inclúen os dos xenes N e cro xunto cos de cII e cIII, e xis, int, O, P e Q que se discuten máis adiante.
- A proteína cIII actúa protexendo a proteína cII da proteólise feita por FtsH (unha protease de E. coli esencial unida a membrana) ao actuar como inhibidor competitivo. Esta inhibición pode inducir un estado bacteriostático, que favorece a lisoxenia. Ademais, cIII estabiliza directamente a proteína cII.[8]
Na infección inicial, a estabilidade de cII determina o ciclo vital do fago (lítico ou lisoxénico); unha cII estable leva ao ciclo lisoxénico, mentres que se cII é degradada o fago entra no ciclo lítico. As baixas temperaturas, a falta de nutrientes na célula e a alta multiplicidade de infección (MOI) son factores que favorecen a lisoxenia (como se discute despois).
Antiterminación N
[editar | editar a fonte]Isto ocorre sen que a a proteína N interaccione co ADN; en vez diso, a proteína únese a un ARNm acabado de transcribir. Os sitios Nut conteñen 3 "caixas" (secuencias de nucleótidos) conservadas, das cales só a BoxB é esencial.
- As secuencias de ARN de boxB están localizadas preto do extremo 5' dos transcritos pL e pR. Cando se transcriben, cada secuencia forma unha estrutura en bucle en forquita á que a proteína N pode unirse.
- A proteína N únese a boxB en cada transcrito, e contacta coa ARN polimerase (RNAP) en transcrición por medio do bucle no ARN. O complexo N-RNAP é estabilizado pola seguinte unión de varias proteínas Nus (N utilisation substance) do hóspede (que inclúen factores de terminación/antiterminación da transcrición e, sorprendentemente, unha subunidade ribosómica).
- O complexo completo (incluíndo o sitio Nut unido do ARNm) continúa a transcrición, e pode saltar secuencias de terminación.
Ciclo lítico
[editar | editar a fonte]Este é o ciclo que o fago segue na maioría das infeccións, no cal a proteína cII non chega a ter unha concentración suficiente debido á degradación, polo que non activa os seus promotores.
- Os transcritos "temperáns tardíos" continúan producíndose, incluíndo xis, int, Q e os xenes para a replicación do xenoma de lambda (OP). Cro domina o sitio represor (ver a sección "Represor"), reprimindo a síntese a partir do promotor PRM (o cal é un promotor do ciclo lisoxénico).
- As proteínas O e P inician a replicación do cromosoma do fago (ver "Replicación lítica").
- Q é outro antiterminador, que se une agora aos sitios Qut.
- A transcrición a partir do promotor PR' pode agora realizarse e producir ARNm para a lise e as proteínas da cabeza e cola.
- As proteínas estruturais e os xenomas do fago autoensámblanse formando novas partículas de fagos.
- Os produtos dos xenes de lise S,R, Rz e Rz1 causan a lise da célula. A proteína S é unha holina (de hole = burato en inglés), unha pequena proteína de membrana que, que nun momento que é determinado pola secuencia da proteína, empeza a facer buratos na membrana. A proteína R é unha endolisina, un encima que escapa da célula a través dos buratos S e cliva a parede celular bacteriana. Rz e Rz1 son proteínas de membrana que forman un complexo que destrúe a membrana externa, despois de que a endolisina degradase a parede celular. No fago lambda de tipo silvestre, a lise ocorre aproximadamente uns 50 minutos despois do comezo da infección e libera uns 100 virións.
Transcrición cara á dereita
[editar | editar a fonte]A transcrición cara á dereita expresa os xenes O, P e Q. O e P son responsables da iniciación da replicación, e Q é outro antiterminador que permite a expresión dos xenes da cabeza, cola e de lise a partir de PR’.
Replicación lítica
[editar | editar a fonte]- Nos primeiros (poucos) ciclos de replicación, o xenoma de lambda sofre unha replicación θ (de círculo a círculo).
- Isto iníciase no sitio ori situado no xene O. A proteína O únese ao sitio ori, e a proteína P únese á subunidade DnaB da maquinaria de replicación do hóspede e tamén se une a O. Isto fai que tome o control da ADN polimerase do hóspede.
- Axiña, o fago cambia a unha replicación por círculo rodante similar á do fago M13. Fáiselle unha amosega ao ADN e o extremo 3’ serve como cebador. Nótese que isto non libera copias sinxelas do xenoma do fago senón unha longa molécula con moitas copias do xenoma: un concatémero.
- Estes concatémeros son clivados nos seus sitios cos a medida que son empaquetados na cabeza do fago, formando extremos cohesivos[7]. O empaquetamento non ocorre, pois, a partir do ADN circular do fago, senón só a partir do ADN concatemérico.
Antiterminación Q
[editar | editar a fonte]Q ten uns efectos similares aos de N: Q únese á ARN polimerase nos sitios Qut e o complexo resultante pode ignorar terminadores, aínda que o mecanismo é moi diferente; a proteína Q asóciase primeiro cunha secuencia de ADN en vez de cunha secuencia de ARNm.[10]
- O sitio Qut está moi próximo ao promotor PR’, o suficientemente próximo como para que o factor σ no fora liberado do holoencima ARN polimerase. Parte do sitio Qut lembra a caixa de Pribnow -10, causando a detención do holoencima.
- A proteína Q únese despois e despraza parte do factor σ e reiníciase a transcrición.
- Transcríbense os xenes da cabeza e a cola e as proteínas correspondentes autoensámblanse.
Transcrición cara á esquerda
[editar | editar a fonte]Na transcrición cara á esquerda exprésanse os xenes gam, red, xis, e int. As proteínas gam e red están implicadas na recombinación. Gam é tamén importante porque inhibe a degradación pola nuclease do hóspede RecBCD dos extremos 3’ na replicación por círculo rodante. Int e xis son proteínas de integración e excisión vitais para a lisoxenia.
Regulación de xis e int da inserción e excisión
[editar | editar a fonte]
- xis e int atópanse no mesmo ARNm, polo que se producen concentracións aproximadamente iguais das proteínas xis e int. Isto ten como resultado (inicialmente) a excisión de calquera xenoma que fose inserido no xenoma do hóspede.
- O ARNm do promotor PL forma unha estrutura secundaria estable cun talo-bucle da sección sib do ARNm. Isto converte o extremo 3' (sib) do ARNm nunha diana para a degradación pola RNAaseIII, o que ten como resultado unha concentración efectiva máis baixa do ARNm de int que do de xis (xa que o cistrón de int está máis próximo que o de xis á secuencia sib), de modo que se observa unha maior concentración de xis que de int.
- As maiores concentracións de xis que de int teñen como resultado a non inserción ou excisión de xenomas de fagos, a acción favorecida evolutivamente, deixando inserido calquera xenoma de fago pre-inserido (reducindo así a competición) e impedindo a inserción do xenoma do fago no xenoma dun hóspede condenado á lise.
Ciclo lisoxénico
[editar | editar a fonte]- Artigo principal: Ciclo lisoxénico.
O ciclo lisoxénico empeza unha vez que a proteína cII alcanza unha concentración alta dabondo como para activar os seus promotores, despois dun pequeno número de infeccións.
- Os transcritos "temperáns tardíos" seguen producíndose, incluíndo xis, int, Q e os xenes para a replicación do xenoma de lambda.
- O cII estabilizado actúa promovendo a transcrición a partir dos promotores PRE, PI e Pantiq.
- O promotor Pantiq produce ARNm antisentido para a mensaxe do xene Q do transcrito do promotor PR, desactivando así a produción de Q. O promotor PRE produce ARNm antisentido para a sección cro do transcrito do promotor PR, rebaixa a produción de cro, e ten un transcrito do xene cI. Este exprésase, e activa a produción do represor de cI. O promotor PI expresa o xene int, o que ten como resultado que haxa grandes concentracións da proteína int. Esta proteína int integra o ADN do fago no cromosoma do hóspede (ver "Integración do profago").
- Ao non haber Q tampouco hai extensión do marco de lectura do promotor PR', polo que non se producen proteínas líticas nin estruturais. Os niveis elevados de int (moito maiores que os de xis) teñen como resultado a inserción do xenoma de lambda no xenoma do hóspede (ver diagrama). A produción de cI leva á unión de cI nos sitios OR1 e OR2 no promotor PR, "apagando" a expresión de cro e doutros xenes temperáns. cI tamén se une ao promotor PL, desactivando tamén a súa transcrición.
- A falta de cro deixa o sitio OR3 libre, polo que a transcrición a partir do promotor PRM pode ocorrer, mantendo os niveis de cI.
- A falta de transcrición a partir dos promotores PL e PR leva a que non haxa máis produción de cII e cIII.
- Como decrece a concentración de cII e cIII, a transcrición a partir de Pantiq, PRE e PI deixa de ser promovida, xa que xa non son necesarios.
- Soamente quedan activos os promotores PRM e PR', o primeiro producindo a proteína cI e o último un curto transcrito inactivo. O xenoma de lambda permanece inserido no xenoma do hóspede en estado dormente.
O profago duplícase con cada división celular do hóspede. Os xenes do fago expresados neste estado dormente codifican proteínas que reprimen a expresión doutros xenes de fagos (como os xenes estruturais e líticos) para impedir a entrada no ciclo lítico. Estas proteínas represivas son degradadas cando a célula hóspede está baixo estrés, o que orixina a expresión dos xenes do fago reprimidos. Este estrés pode ser a falta de nutrientes, velenos (como antibióticos), ou outros factores que poden danar ou destruír ao hóspede. En resposta ao estrés, o profago activado é excindido do ADN da célula hóspede por un dos produtos dos xenes agora expresados e entra na súa vía lítica.
Integración do profago
[editar | editar a fonte]A integración do fago λ ten lugar nun sitio de adhesión att especial situado nos xenomas da bacteria e do fago, chamado attλ.[7] A secuencia das partes bacterianas do sitio att denomínanse attB, que están situadas entre os operóns bacterianos gal e bio, e consta das partes B-O-B', mentres que a secuencia complementaria no xenoma circularizado do fago denomínase attP, e consta das partes P-O-P'. A propia integración é un intercambio secuencial (ver recombinación xenética) por medio da formación dunha unión de Holliday e require tanto a proteína Int do fago (unha integrase) coma a proteína bacteriana IHF (integration host factor, factor do hóspede de integración). Tanto Int coma IHF únense a attP e forman un intasoma, que é un complexo ADN-proteína deseñado para a recombinación específica de sitio dos ADNs do fago e do hóspede. A secuencia orixinal B-O-B' é cambiada pola integración a B-O-P'-ADN do fago-P-O-B'. Como resultado, o ADN do fago forma agora parte do xenoma do hóspede.[11]
Mantemento da lisoxenia
[editar | editar a fonte]
- A lisoxenia é mantida só por cI. cI reprime a transcrición a partir de PL e PR mentres que regula á alza e controla a súa propia expresión a partir de PRM. É, por tanto, a única proteína que expresa o fago lisoxénico.

- Isto está coordinado polos operadores PL e PR. Ambos os operadores teñen tres sitios de unión para cI: OL1, OL2, e OL3 para PL, e OR1, OR2 e OR3 para PR.
- cI únese máis favorablemente a OR1; ao unirse aquí inhibe a transcrición a partir de PR. Como cI se dimeriza facilmente, a unión de cI a OR1 incrementa moito a afinidade da unión de cI a OR2, e isto ocorre case inmediatamente despois da unión a OR1. Isto activa a transcrición na outra dirección desde PRM, xa que o dominio terminal de cI sobre OR2 fai máis forte a unión da ARN polimerase a PRM e así cI estimula a súa propia transcrición. Cando está presente a moita maior concentración, únese tamén a OR3, inhibindo a transcrición a partir de PRM, regulando así os seus propios niveis nun bucle de retroalimentación negativa.
- A unión de cI ao operador PL é moi similar, excepto en que non ten un efecto directo sobre a transcrición de cI. Porén, como unha represión adicional da súa propia expresión, os dímeros de cI unidos a OR3 e OL3 provocan o dobramento do ADN que está entre eles para tetramerizarse.
- A presenza de cI causa inmunidade a superinfeccións por outros fagos lambda, xa que inhibe os promotores PL e PR dos outros fagos.
Indución
[editar | editar a fonte]
A indución clásica do lisóxeno implicado (a bacteria) facíase irradiando as células infectadas con luz ultravioleta (UV).[7] En calquera situación na que o lisóxeno sofre danos no ADN ou na que a resposta SOS do hóspede se estimula dalgún outro xeito, prodúcese a indución.
- A célula hóspede, que contén o xenoma do fago dormente, experimenta danos no ADN debido a un contorno moi estresante, e empeza a sufrir a resposta SOS.
- A proteína celular RecA detecta os danos no ADN e queda activada. Convértese en RecA*, unha coprotease altamente específica.
- Normalmente RecA* únese a LexA (un represor da transcrición), activando a actividade de autoprotease da LexA, a cal destrúe o represor LexA, permitindo a produción de proteínas para a reparación do ADN. En células lisoxénicas, esta resposta é desviada, e RecA* estimula a autoclivaxe de cI. Isto débese a que cI imita a estrutura de LexA no sitio de autoclivaxe.
- O cI clivado xa non pode dimerizarse, e perde a súa afinidade de unión ao ADN.
- Os promotores PR e PL xa non están reprimidos e pasan a un estado de encendido, e a célula volve aos eventos de expresión da secuencia lítica (nótese que cII non é estable nas células que realizan a resposta SOS). Por tanto, hai unha notable diferenza.

Control da excisión do xenoma do fago na indución
[editar | editar a fonte]- O xenoma do fago está aínda inserido no xenoma do hóspede e necesita excindirse para que ocorra a replicación do ADN. Porén, a sección sib situada alén do transcrito do promotor PL normal xa non está incluída neste marco de lectura (ver diagrama).
- Ao non haber ningún dominio sib no ARNm do promotor PL ten como resultado que non hai bucle en forquita no extremo 3', e o transcrito xa non está marcado para a sufrir unha degradación pola RNAaseIII.
- Este novo transcrito intacto ten unha copia tanto de xis coma de int, polo que se orixinan concentracións aproximadamente iguais das proteínas xis e int.
- Conxentracións iguais de xis e int causan a excisión do xenoma do fago inserido no xenoma do hóspede para a replicación e posterior produción de fagos.
Reactivación de multiplicidade e reactivación do profago
[editar | editar a fonte]A reactivación de multiplicidade (MR) é o proceso polo cal múltiples xenomas virais, todos os cales conteñen danos no seu xenoma inactivantes, interaccionan cunha célula infectada para formar un xenoma viral viable. A reactivación de multiplicidade foi descuberta orixinalmente no fago T4, pero despois atopouse no fago λ (e en numerosos virus de bacterias e mamíferos[12]). A reactivación de multiplicidade do fago λ inactivado por luz UV depende da función de recombinación do hóspede ou do fago infectante.[13] A ausencia de ambos os sistemas de recombinación leva á perda da reactivación de multiplicidade.
A supervivencia do fago λ irradiado con luz UV increméntase cando o hóspede E. coli é lisoxénico para un profago homólogo, un fenómeno denominado reactivación de profago.[14] A reactivación de profago no fago λ parece ocorrer por un proceso de reparación recombinacional similar ao da reparación de multiplicidade.
Represor
[editar | editar a fonte]
O represor que se encontra no fago lambda é un exemplo notable do nivel de control posible sobre a expresión xénica por un sistema moi simple. Forma un "interruptor binario" con dous xenes que están baixo expresión mutuamente excluínte, como descubriu Barbara J. Meyer.[15]
O sistema xénico do represor de lambda consta dos seguintes elementos (de esquerda a dereita no cromosoma):
- Xene cI
- OR3
- OR2
- OR1
- Xene cro
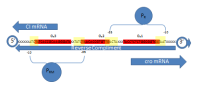
O represor de lambda é un dímero que se autoensambla tamén chamado proteína cI.[16] Únese ao ADN no motivo de unión hélice-xiro-hélice. Regula a transcrición da proteína cI e a proteína Cro.
O ciclo vital dos fagos lambda é controlado polas proteínas cI e Cro. O fago lambda permanecerá no estado lisoxénico se as proteínas cI predominan, pero pasará ao ciclo lítico se as que predominan son as proteínas Cro.
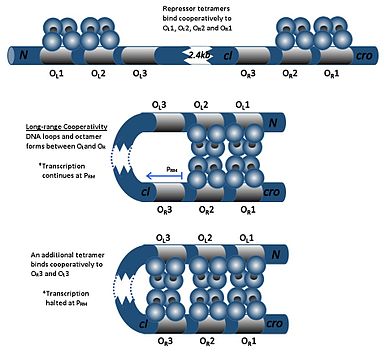
O dímero cI pode unirse a calquera dos tres operadores, OR1, OR2, e OR3, na seguinte orde: OR1 = OR2 > OR3. A unión dun dímero de cI a OR1 potencia a unión dun segundo dímero cI a OR2, un efecto chamado cooperatividade. Así, OR1 e OR2 están case sempre simultanemente ocupados por cI. Porén, isto non incrementa a afinidade entre cI e OR3, o cal estará ocupado só cando a concentración de cI é alta.
A altas concentracións de cI, os dímeros tamén se unirán aos operadores OL1 e OL2 (os cales están a uns 2 kb augas abaixo dos operadores R). Cando os dímeros cI están unidos a OL1, OL2, OR1, e OR2 indúcese a formación dun bucle no ADN, o que permite que estes dímeros se unan para formar un octámero. Este é un fenómeno chamado cooperatividade de longo rango. Despois da formación do octámero, os dímeros de cI poden unirse cooperativamente a OL3 e OR3, reprimindo a transcrición de cI. Esta regulación autonegativa asegura unha concentración mínima estable da molécula represora e, en caso de orixinárense sinais SOS, permite unha indución máis eficiente do profago.[17]
- En ausencia de proteínas cI, o xene cro pode transcribirse.
- En presenza de proteínas cI, só o xene cI pode transcribirse.
- A altas concentracións de cI, as transcricións de ambos os xenes están reprimidas.
Resumo das funcións das proteínas do fago lambda
[editar | editar a fonte]| Proteína | Función no ciclo vital | Rexión promotora | Descrición |
|---|---|---|---|
| cIII (Clear 3) |
Proteína reguladora CIII. Lisoxenia, estabilidade de cII | PL (promotor esquerdo, left) |
Proteína de unión HflB (FtsH), protexe a cII da degradación por proteases. |
| cII (Clear 2) |
Lisoxenia, activador da transcrición | PR (promotor dereito, right) |
Activa a transcrición dos promotores PAQ, PRE e PI, transcribindo cI e int. Baixa estabilidade debido á susceptibilidade ás proteases celulares HflB (FtsH) (especialmente en células sas e en células que están experimentando unha resposta SOS). Os altos niveis de cII levan ao fago cara á integración e á lisoxenia, mentres que os niveis baixos de cII orixinan a lise. |
| cI (Clear 1) |
Represor, mantemento da lisoxenia | PRM, PRE | Inhibidor da transcrición, únese a OR1, OR2 e OR3 (orde de afinidade: OR1 > OR2 = OR3, é dicir, únese preferencialmente a OR1). A baixas concentracións bloquea o promotor PR (impedindo a produción de cro). A altas concentracións regula á baixa a súa propia produción ao unirse a OR3. O represor tamén inhibe a transcrición a partir do promotor PL. Susceptible á clivaxe por RecA* en células que están realizando a resposta SOS. |
| Cro | Lise, control do operador do represor | PR | Inhibidor da transcrición, únese a OR3, OR2 e OR1 (orde de afinidade OR3 > OR2 = OR1, é dicir, únese preferencialmente a OR3). A baixas concentracións bloquea o promotor pRM (impedindo a produción de cI). A altas concentracións regula á baixa a súa propia produción ao unirse a OR2 e OR1. Sen unión cooperativa (c.f. máis abaixo para a unión de cI) |
| O | Lise, replicación do ADN | PR | Proteína de replicación O. Inicia a replicación do ADN do fago lambda ao unirse ao sitio ori. |
| P | Lise, replicación do ADN | PR | Inicia a replicación do ADN do fago lambda ao unirse a O e á subunidade DnaB. Estas unións proporcionan un control sobre a ADN polimerase do hóspede. |
| Gam | Lise, replicación do ADN | PL | Inhibe a nuclease do hóspede RecBCD para que non degrade os extremos 3', e permite que se produza a replicación por círculo rodante. |
| S | Lise | PR' | Holina, unha proteína de membrana que perfora a membrana da célula durante a lise. |
| R | Lise | PR' | Endolisina, lisozima, un encima que sae da célula a través dos buratos producidos pola holina e cliva a parede celular da bacteria. |
| Rz and Rz1 | Lise | PR' | Forma un complexo proteico de membrana que destrúe a membrana celular externa despois da degradación da parede celular pola endolisina. Spanina, Rz1 (subunidade da membrana externa) e Rz (subunidade da membrana interna). |
| F | Lise | PR' | Proteínas da cabeza (cápside) do fago. |
| D | Lise | PR' | Proteínas de "decoración" da cabeza. |
| E | Lise | PR' | Proteína principal da cabeza. |
| C | Lise | PR' | Proteínas menores da cápside. |
| B | Lise | PR' | Proteína portal B. |
| A | Lise | PR' | Proteína terminase grande. |
| J | Lise | PR' | Proteína de especificidade de hóspede J. |
| M V U G L T Z | Lise | PR' | Proteína da cola menor M. |
| K | Lise | PR' | Probable endopeptidase. |
| H | Lise | PR' | Proteína de medida da fita da cola H. |
| I | Lysis | PR' | Proteína de ensamblaxe da cola I. |
| FI | Lysis | PR' | Proteína de empaquetamento do ADN FI. |
| FII | Lise | PR' | Proteína de adhesión da cola. |
| tfa | Lise | PR' | Proteína de ensamblaxe das fibras da cola. |
| int | Integración no xenoma, excisión | PI, PL | Integrase, encárgase da inserción do xenoma do fago no xenoma do hóspede. En condicións de concentracións baixas de int non hai efecto. Se xis está en baixa concentración e int en alta, está promovida a inserción do xenoma do fago. Se xis e int teñen concentracións altas (e aproximadamente iguais) isto leva á excisión do xenoma do fago do xenoma do hóspede. |
| xis | Excisión do xenoma | PI, PL | O encima excisionase e a proteína reguladora int, realizan a excisión e inserción do xenoma do fago no xenoma do hóspede. |
| N | Antiterminación para a transcrición dos xenes temperáns tardíos | PL | Antiterminador, proteína que se une ao ARN e cofactor da ARN polimerase, únese ao ARN (nos sitios Nut) e transfírese á nacente ARN polimerase que transcribiu o sitio nut. Esta modificación da ARN polimerase impide que recoñeza os sitios de terminación, polo que os sinais de terminación da ARN polimerase normais son ignorados e a síntese de ARN continúa nos xenes do fago distais (cII, cIII, xis, int, O, P, Q) |
| Q | Antiterminación para a transcrición dos xenes líticos tardíos | PR | Antiterminador, proteína de unión ao ADN e cofactor da ARN polimerase, únese ao ADN (nos sitios Qut) e transfírese á ARN polimerase iniciante. Esta modificación da ARN polimerase altera o seu recoñecemento das secuencias de terminación, polo que as secuencias normais son ignoradas; pero son efectivas secuencias de terminación Q especiais situadas a uns 20.000 pares de bases. Os transcritos estendidos a Q inclúen proteínas estruturais do fago (A-F, Z-J) e xenes de lise (S, R, Rz e Rz1). Regulada á baixa polo ARNm anitisentido de Pantiq durante a lisoxenia. |
| RecA | Resposta SOS | Proteína do hóspede | Proteína de reparación do ADN, funciona como coprotease durante a resposta SOS, auto-clivando LexA e cI e facilitando a lise. |
Lise ou lisoxenia?
[editar | editar a fonte]
Unha importante distinción que debemos establecer é entre as dúas decisións que o fago debe tomar no seu ciclo vital: por un lado lisoxenia ou lise durante a infección, e por outro continuar en estado lisoxénico ou pasar ao ciclo lítico durante a fase de profago. Isto último está determinado soamente pola activación de RecA na respoosta SOS da célula, como se dixo no capítulo sobre indución. A primeira das decisións está tamén afectada por esta; unha célula que está realizando a resposta SOS sempre será lisada, xa que non se poderá acumular a proteína cI. Porén, a decisión inicial lítica/lisoxénica na infección tamén depende da proteínas cII e cIII.
En células que dispoñen de suficientes nutrientes, a actividade da protease é alta, co cal se degrada cII.[18] Isto leva a un ciclo lítico. Nas células con limitación de nutrientes, a actividade da protease é baixa, facendo que cII sexa estable. Isto leva a un ciclo lisoxénico. cIII parece estabilizar cII, tanto directamente coma ao actuar como inhibidor competitivo de proteases relevantes. Isto significa que unha célula que está nunha situación difícil, por exemplo por falta de nutrientes e nun estado máis dormente, é máis probablemente lisoxenizada. Isto sería seleccionado porque o fago pode agora permanecer dormente na bacteria ata que cheguen mellores tempos, e o fago pode crear así máis copias do seu xenoma cos recursos adicionais dispoñibles e coa probable proximidade de máis células infectables.
Un modelo biofísico completo da decisión de lambda de lise ou lisoxenia aínda ten que ser desenvolvido. Os modelos e simulacións por computadora suxiren que os procesos aleatorios durante a infección dirixen a selección entre lise ou lisoxenia en cada célula individual.[19] Porén, experimentos recentes suxiren que as diferenzas físicas entre células, que existen xa antes da infección, predeterminan se unha célula se lisará ou se converterá nun lisóxeno.[20]
Ferramenta xenética
[editar | editar a fonte]O fago lambda foi moi utilizado como organismo modelo, e foi unha rica fonte de útiles ferramentas en xenética microbiana, e posteriormente en xenética molecular. Entre os seus usos están a súa aplicación como vector para a clonación de ADN recombinante; o uso da súa recombinase específica de sitio (int) para a mestura de ADNs clonados polo método gateway; e a aplicación do seu operón Red, incluíndo as proteínas Red alfa (tamén chamada 'exo'), beta e gamma no método de enxeñaría do ADN chamado recombinería. O fago lambda tamén foi de grande importancia no estudo da transdución especializada.
Notas
[editar | editar a fonte]- ↑ Esther M. Zimmer Lederberg: Published Works
- ↑ Esther Lederberg, "Lysogenicity in Eescherichia coli strain K-12, Microbial Genetics Bulletin, v.1, pp. 5–8 (January 1950); followed by Lederberg, EM; Lederberg, J (1953). "Genetic Studies of Lysogenicity in Escherichia Coli". Genetics 38 (1): 51–64. PMC 1209586. PMID 17247421.
- ↑ 3,0 3,1 3,2 Rajagopala, S. V.; Casjens, S.; Uetz, P. (2011). "The protein interaction map of bacteriophage lambda". BMC Microbiology 11: 213. doi:10.1186/1471-2180-11-213. PMC 3224144. PMID 21943085.
- ↑ 4,0 4,1 Campbell, A.M. Bacteriophages. In: Neidhardt, FC et al. (1996) Escherichia coli and Salmonella typhimurium: Cellular and Molecular Biology (ASM Press, Washington, DC)
- ↑ Werts, C; Michel, V; Hofnung, M; Charbit, A (February 1994). "Adsorption of bacteriophage lambda on the LamB protein of Escherichia coli K-12: point mutations in gene J of lambda responsible for extended host range.". Journal of bacteriology 176 (4): 941–7. PMC 205142. PMID 8106335.
- ↑ "The mannose permease of Escherichia coli consists of three different proteins. Amino acid sequence and function in sugar transport, sugar phosphorylation, and penetration of phage lambda DNA.". J Biol Chem 262 (11): 5238–47. Apr 1987. PMID 2951378.
- ↑ 7,0 7,1 7,2 7,3 M. T. Madigan, J. M. Martinko, J. Parker. Brock. Biología de los microorganismos. 10ª edición. Pearson-Educación. Madrid, 2004. Páxinas 251-254. ISBN 84-205-3679-2
- ↑ Kobiler, O. (2007). "Phage Lambda CIII: A Protease Inhibitor Regulating the Lysis-Lysogeny Decision". PLoS ONE 2 (4): e363. doi:10.1371/journal.pone.0000363.
- ↑ 9,0 9,1 Santangelo, T. J.; Artsimovitch, I. (2011). "Termination and antitermination: RNA polymerase runs a stop sign". Nature Reviews Microbiology 9 (5): 319–329. doi:10.1038/nrmicro2560. PMC 3125153. PMID 21478900.
- ↑ Padraig Deighan, Ann Hochschild (2007). "The bacteriophage λQ anti-terminator protein regulates late gene expression as a stable component of the transcription elongation complex". Molecular Microbiology. 63 Suppl 3 (3): 911–20. PMID 17302807. doi:10.1111/j.1365-2958.2006.05563.x.
- ↑ Groth AC, Calos MP (2004). "Phage integrases: biology and applications". Journal of Molecular Biology 355 (3): 667–678. PMID 14687564.
- ↑ Michod, RE; Bernstein, H; Nedelcu, AM (2008). "Adaptive value of sex in microbial pathogens". Infect Genet Evol 8 (3): 267–285. PMID 18295550. doi:10.1016/j.meegid.2008.01.002.
- ↑ Huskey RJ (April 1969). "Multiplicity reactivation as a test for recombination function". Science 164 (3877): 319–20. Bibcode:1969Sci...164..319H. PMID 4887562. doi:10.1126/science.164.3877.319.
- ↑ Blanco M, Devoret R (March 1973). "Repair mechanisms involved in prophage reactivation and UV reactivation of UV-irradiated phage lambda". Mutat. Res. 17 (3): 293–305. PMID 4688367. doi:10.1016/0027-5107(73)90001-8.
- ↑ "Barbara J. Meyer", HHMI Interactive.
- ↑ Burz, D. S.; Beckett, D.; Benson, N.; Ackers, G. K. (1994). "Self-assembly of bacteriophage lambda cI repressor: Effects of single-site mutations on the monomer-dimer equilibrium". Biochemistry 33 (28): 8399–8405. doi:10.1021/bi00194a003. PMID 8031775.
- ↑ Ptashne, Mark (2004). A Genetic Switch, p. 112. Cold Spring Harbor Laboratory Press, New York. ISBN 978-0-87969-716-7.
- ↑ Ptashne M (1986). "A Genetic Switch. Gene Control and Phage lambda". Cell Press ISBN 0-86542-315-6
- ↑ Arkin A, Ross J, McAdams HH (1998). "Stochastic kinetic analysis of developmental pathway bifurcation in phage lambda-infected Escherichia coli cells". Genetics 149 (4): 1633–48. PMC 1460268. PMID 9691025.
- ↑ St-Pierre F, Endy D (2008). "Determination of cell fate selection during phage lambda infection". Proc. Natl. Acad. Sci. U.S.A. 105 (52): 20705–20710. Bibcode:2008PNAS..10520705S. PMC 2605630. PMID 19098103. doi:10.1073/pnas.0808831105.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- James Watson, Tania Baker, Stephen Bell, Alexander Gann, Michael Levine, Richard Losick " Molecular Biology of the Gene (International Edition)" - 6th Edition
- Mark Ptashne and Nancy Hopkins, "The Operators Controlled by the Lambda Phage Repressor", PNAS, v.60, n.4, pp. 1282–1287 (1968).
- Barbara J. Meyer, Dennis G. Kleid, and Mark Ptashne, "Lambda Repressor Turns Off Transcription of Its Own Gene", PNAS, v.72, n.12, pp. 4785–4789 (Decembro 1975).
- Brussow, H.; Hendrix, R.W. (2002). "Small is beautiful". Cell 108 (1): 13–6. PMID 11792317. doi:10.1016/S0092-8674(01)00637-7.
- Dodd, J.B. Shearwin; Egan, J.B.; Egan, JB (2005). "Revisited gene regulation in phage lambda". Current Opinion in Genetics & Development 15 (2): 145–152. PMID 15797197. doi:10.1016/j.gde.2005.02.001.
- Friedman, D.I.; Court, D.L. (2001). "Bacteriophage lambda; alive and well and still doing its thing". Current Opinion in Microbiology 4 (2): 201–207. PMID 11282477. doi:10.1016/S1369-5274(00)00189-2.
- Gottesman, M. and Weisberg, R.A. 2004 "Little lambda - who made thee?", Micro and Mol Biol Revs, 68, 796-813 (dispoñible on line en Microbiology and Molecular Biology Reviews, American Society for Microbiology)
- Hendrix, R.W. (1999). "All the world's a phage". Proc. Natl. Acad. Sci. U.S.A. 96: 2192–2197. doi:10.1073/pnas.96.5.2192.
- Kitano, R. (2002). "Systems biology: a brief overview". Science 295 (5560): 1662–1664. Bibcode:2002Sci...295.1662K. PMID 11872829. doi:10.1126/science.1069492.
- Ptashne, M. "A Genetic Switch: Phage Lambda Revisited", 3rd edition 2003
- Ptashne, M. (2005). "Regulation of transcription: from lambda to eukaryotes". Trends in Biochem Sci 30 (6): 275–279. doi:10.1016/j.tibs.2005.04.003.
- Snyder, L. and Champness, W. "Molecular Genetics of Bacteria", 3rd edition 2007 (Contén un resumo informativo e ben ilustrado do bacteriófago lambda)
- Splasho, Resumo en liña do funcionamento de lambda (ilustra os xenes activos en todos os estados do ciclo de lambda)
Ligazóns externas
[editar | editar a fonte]- Vídeo de microscopía con imaxes aceleradas do MIT que mostra os ciclos líticos e lisoxénico do fago lambda.
- Basic Animation of Lambda Lifecyecle (ilustra a infección e as vías lítica e lisoxénica con detalles das proteínas e da transcrición)
- Lambda Phage Life cycle (demostración visual básica do ciclo de vida do bacteriófago lambda)
- Xenoma do fago lambda en GenBank
- Proteoma de Referencia do fago lambda en UniProt
- Estruturas das proteínas do fago lambda no NCBI (imaxes en 3D das estruturas proteícas do bacteriófago lambda)