Aromatización
A aromatización é unha reacción química na cal se forma un sistema aromático a partir dun só precursor non aromático. Normalmente a aromatización conséguese pola deshidroxenación de compostos cíclicos existentes, como ocorre na conversión do ciclohexano en benceno. A aromatización inclúe a formación de sistemas heterocíclicos.[1] Nos seres vivos é importante a aromatización de esteroides realizada por encimas aromatases.

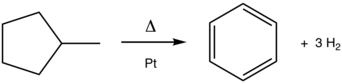
A conversión do metilciclohexano a tolueno é unha reacción de aromatización clásica. Este proceso catalizado polo platino (Pt) practícase a escala na produción de gasolina a partir do petróleo.
Práctica industrial
[editar | editar a fonte]Aínda que non se realiza usando ese nome, a aromatización é unha pedra angular no refinado de petróleo. Unha das principais reaccións reformantes é a deshidroxenación de naftenos en compostos aromáticos. O proceso, que é catalizado por platino, exemplifícase coa conversión de metilciclohexano (un nafteno) en tolueno (un aromático).[2] A deshidrociclación converte as parafinas (hidrocarburos acíclicos) en aromáticos.[3] Un proceso de aromatización relacionado é a deshidroisomerización do metilciclopentano a benceno:
Procesos bioquímicos
[editar | editar a fonte]As aromatases son encimas que aromatizan aneis de compostos esteroides. As conversións específicas son testosterona a estradiol e androstenediona a estrona.[4] Cada unha destas aromatizacións implica a oxidación do grupo metilo do C-19 para permitir a eliminación de ácido fórmico concomitante coa aromatización. Tales conversións son relevantes para a tumoroxénese do estróxeno no desenvolvemento dos cancros de mama e de ovario en mulleres posmenopáusicas e homes con xinecomastia.[5] Os inhibidores da aromatase, como o exemestano (que forma un enlace permanente e desactivante co encima aromatase)[6] e o anastrozol e o letrozol (que compiten polo encima),[7] son máis efectivos que os medicamentos antiestróxenos como o tamoxifeno, probablemente porque impiden a formación de estradiol.[5]
Vías de aromatización
[editar | editar a fonte]Deshidroxenación oxidativa
[editar | editar a fonte]Para o ciclohexano, ciclohexeno e ciclohexadieno, a deshidroxenación é a vía conceptalmente máis simple para a aromatización. A barreira de activación diminúe co grao de insaturación. Así, os ciclohexadienos teñen unha tendencia especial á aromatización. Formalmente, a deshidroxenación é un proceso redox. A aromatización deshidroxenativa é o inverso da hidroxenación de arenos. Deste xeito, os catlizadores da hidroxenación son efectivos para a reacción inversa. As deshidroxenacións de ciclohexanos e materias primas relacionadas catalizadas por platino son as aplicacións a maior escala desta reacción (ver arriba).[1]
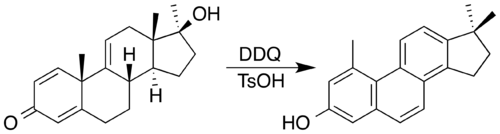
A 2,3-dicloro-5,6-diciano-1,4-benzoquinona (DDQ) adoita ser o reactivo elixido. Utilizáronse a DDQ e un catalizador ácido para sintetizar un esteroide con núcleo de fenantreno por oxidación acompañada por unha migración de metilo dobre.[8] No proceso, a propia DDQ é reducida a un produto de hidroquinona aromática.
O xofre e o selenio utilízanse tradicionalmente na aromatización, sendo o grupo saínte o sulfuro de hidróxeno.[9]
Os complexos metálicos de transición soluble poden inducir a aromatización oxidativa concomitante coa complexación. O α-felandreno (2-metil-5-iso-propil-1,3-ciclohexadieno) é oxidado a p-iso-propiltolueno coa redución de tricloruro de rutenio.[10]
A deshidroxenación oxidativa da dihidropiridina resulta en aromatización, dando piridina.[11]
Deshidratación
[editar | editar a fonte]
Os aneis non aromáticos poden ser aromatizados de moitos xeitos. A deshidratación permite a reacción de Semmler-Wolff da oxima 2-ciclohexenona a anilina en condicións ácidas.[12]
Tautomerización
[editar | editar a fonte]
A isomerización das ciclohexadienonas dá lugar ao tautómero aromático fenol.[13][14] A isomerización de 1,4-naftalenediol a 200 °C produce unha mestura 2:1 coa súa forma ceto, a 1,4-dioxotetralina.[15]
Subtración de hidruro e protón
[editar | editar a fonte]Clasicamente, as reaccións de aromatización implican o cambio da proporción C:H dun substrato. Cando se aplica ao ciclopentadieno, a retirada dun protón rende a base conxugada aromática anión ciclopentadienil, illable como ciclopentadienuro de sodio:[16]
- 2 Na + 2 C5H6 → 2 NaC5H5 + H2
A aromatización pode supoñer a retirada dun hidruro. O tropilio, C
7H+
7 orixínase pola reacción de aromatización do cicloheptatrieno con aceptores hidruro.
- C
7H
8 + Br
2 → C
7H+
7 + Br−
+ HBr

A partir de precursores acíclicos
[editar | editar a fonte]A aromatización de precursores acíclicos é menos frecuente en síntese orgánica, aínda que é un compoñente significativo da produción de BTX en refinerías.
Entre os precursores acíclicos, os alquinos teñen unha tendencia relativa á aromatización, xa que son parcialmente deshidroxenados. A ciclación de Bergman converte unha enediyna nun intermediario deshidrobenceno dirradical, que subtrae un hidróxeno para aromatizar.[17] O residuo de enediyna pode ser incluído nun anel existente, permitindo o acceso dun sistema bicíclico baixo condicións suaves como consecuencia da tensión de anel no reactivo. A ciclodeca-3-en-1,5-diyna reacciona co 1,3-ciclohexadieno para producir benceno e tetralina a 37 °C, sendo a reacción moi favorable debido á formación de dous novos aneis aromáticos:
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6ª ed.). Nova York: Wiley-Interscience. ISBN 978-0-471-72091-1.
- ↑ Gary, J.H.; Handwerk, G.E. (1984). Petroleum Refining Technology and Economics (2nd ed.). Marcel Dekker, Inc. ISBN 0-8247-7150-8.
- ↑ Ono, Y. (1992). "Transformation of Lower Alkanes into Aromatic Hydrocarbons over ZSM-5 Zeolites.". Catal. Rev. - Sci. Eng. 34 (3): 179–226. doi:10.1080/01614949208020306.
- ↑ Lephart, E. D. (1996). "A Review of Brain Aromatase Cytochrome P450". Brain Res. Rev. 22 (1): 1–26. PMID 8871783. doi:10.1016/0165-0173(96)00002-1.
- ↑ 5,0 5,1 Avendaño, C.; Menéndez, J. C. (2008). "Aromatase Inhibitors". Medicinal Chemistry of Anticancer Drugs. Elsevier. pp. 65–73. ISBN 9780080559629. doi:10.1016/B978-0-444-52824-7.00003-2.
- ↑ Jasek, W., ed. (2007). Austria-Codex (en German) (62ª ed.). Vienna: Österreichischer Apothekerverlag. pp. 656–660. ISBN 9783852001814.
- ↑ Dinnendahl, V.; Fricke, U., eds. (2007). Arzneistoff-Profile (en alemán) 4 (21ª ed.). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 9783774198463.
- ↑ Brown, W.; Turner, A. B. (1971). "Applications of High-Potential Quinones. Part VII. The Synthesis of Steroidal Phenanthrenes by Double Methyl Migration". Journal of the Chemical Society C: Organic 14: 2566–2572. PMID 5167256. doi:10.1039/J39710002566.
- ↑ Bergmann, F.; Szmuszkowicz, J.; Fawaz, G. (1947). "The Condensation of 1,1-Diarylethylenes with Maleic Anhydride". Journal of the American Chemical Society 69 (7): 1773–1777. PMID 20251415. doi:10.1021/ja01199a055.
- ↑ Bennett, M. A.; Huang, T. N.; Matheson, T. W.; Smith, A. K. (1982). (η6-Hexamethylbenzene)ruthenium Complexes. Inorganic Syntheses 21. pp. 74–78. ISBN 9780470132524. doi:10.1002/9780470132524.ch16.
- ↑ Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. (2005). "Pyridine and Pyridine Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a22_399.
- ↑ Horning, E. C.; Stromberg, V. L.; Lloyd, H. A. (1952). "Beckmann Rearrangements. An Investigation of Special Cases". Journal of the American Chemical Society 74 (20): 5153–5155. doi:10.1021/ja01140a048.
- ↑ Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. (2001). Organic Chemistry (1ª ed.). Oxford University Press. p. 531. ISBN 9780198503460.
- ↑ Capponi, M.; Gut, I. G.; Hellrung, B.; Persy, G.; Wirz, J. (1999). "Ketonization Equilibria of Phenol in Aqueous Solution". Canadian Journal of Chemistry 77 (5–6): 605–613. doi:10.1139/cjc-77-5-6-605.
- ↑ Kündig, E. P.; Garcia, A. E.; Lomberget, T.; Bernardinelli, G. (2005). "Rediscovery, Isolation, and Asymmetric Reduction of 1,2,3,4-Tetrahydronaphthalene-1,4-dione and Studies of its [Cr(CO)3] Complex". Angewandte Chemie International Edition 45 (1): 98–101. PMID 16304647. doi:10.1002/anie.200502588.
- ↑ Cotton, F. A.; Wilkinson, G. (1999). Advanced Inorganic Chemistry (6ª ed.). John Wiley and Sons. ISBN 9780471199571.
- ↑ Mohamed, R. K.; Peterson, P. W.; Alabugin, I. V. (2013). "Concerted Reactions that Produce Diradicals and Zwitterions: Electronic, Steric, Conformational and Kinetic Control of Cycloaromatization Processes". Chemical Reviews 113 (9): 7089–7129. PMID 23600723. doi:10.1021/cr4000682.