K-caseína
| CSN3 | |||
|---|---|---|---|
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Identificadores externos | |||
| Locus | Cr. 4 q13.3 | ||
| Padrón de expresión de ARNm | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
A κ-caseína ou caseína kappa, é unha proteína do leite dos mamíferos que intervén en varios procesos fisiolóxicos importantes. A quimosina (atopada no callo do abomaso das vacas) corta a κ-caseína nun péptido insoluble (para kappa-caseína) e un glicomacropéptido (GMP) hidrosoluble. O GMP é responsable dun aumento de eficacia da dixestión, a prevención da hipersensibilidade do neonato para inxerir proteínas, e a inhibición de patóxenos gástricos.[1] O xene humano para a κ-caseína é o CSN3 do cromosoma 4.[2][3][4]
Estrutura[editar | editar a fonte]
As caseínas son unha familia de fosfoproteínas (αS1, αS2, β, κ) que supoñen case o 80 % das proteínas lácteas bovinas[5] e que forman agregados solubles coñecidos como "micelas de caseína" na cal as moléculas de κ-caseína estabilizan a estrutura. Hai varios modelos que describen a conformación espacial da caseína nas micelas.[6] Un deles propón que o núcleo micelar está formado por varias submicelas e a periferia consta de microvilosidades de κ-caseína[7][8] Outro modelo suxire que o núcleo está formado por fibrilas de caseína entrelazadas.[9] Finalmente, o modelo máis recente[10] propón que ten que haber unha ligazón dobre entre as caseínas para que poida ter lugar a xelificación. Os tres modelos consideran que as micelas son partículas coloidais formadas por agregados de caseína envoltos en moléculas de κ-caseína solubles. As proteases que callan o leite actúan sobre a porción soluble, a κ-caseína, orixinando así un estado micelar inestable que causa a formación do callo.[11]
Callado do leite[editar | editar a fonte]
A quimosina (EC 3.4.23.4) é unha protease aspártica que hidroliza especificamente o enlace peptídico en Phe105-Met106 da κ-caseína e é considerada a protease máis eficiente para a industria do queixo.[12] Porén, hai proteases que callan o leite capaces de cortar outros enlaces peptídicos na cadea da κ-caseína, como a endothiapepsina producida por Endothia parasitica.[13] Hai tamén varias proteases que callan o leite que, sendo capaces de cortar o enlace Phe105-Met106 na molécula de κ-caseína, tamén cortan outros enlaces peptídicos noutras caseínas, como as producidas por Cynara cardunculus[8][14][15] ou mesmo a quimosina bovina.[16] Isto permite a fabricación de diferentes queixos cunha variedade de propiedades reolóxicas e organolépticas.
O proceso de callado ou coagulación do leite consta de tres grandes fases:[17]
- Degradación encimática da κ-caseína.
- Floculación micelar.
- Formación do xel.
Cada paso segue un diferente padrón cinético, e o paso limitante no callado do leite é a velocidade de degradación da κ-caseína. O padrón cinético do segundo paso do proceso de callado do leite está influído pola natureza cooperativa da floculación micelar,[17][15] mentres que as propiedades reolóxicas do xel formado dependen do tipo de acción ds proteases, o tipo de leite, e os padróns a proteólise da caseína.[15] O proceso global esta influído por varios factores, como o pH ou a temperatura.[14][11]
O xeito convencional de cuantificar un determinado encima que calla o leite[18] emprega o leite como substrato e determina o tempo que pasa antes da aparición de callos no leite. Porén, o callado do leite ten lugar sen a participación de encimas debido a variacións en factores fisicoquímicos, como un pH baixo ou altas temperaturas.[8][5][11] Consecuentemente, isto pode levar á confusión e a resultados irreproducibles, especialmente cando os encimas teñen unha baixa actividade. Ao mesmo tempo, o método clásico non é o suficientemente específico en canto ao comezo preciso da xelificación do leite, de maneira que a determinación das unidades encimáticas implicadas faise difícil e pouco clara. Ademais, aínda que se informou que a hidrólise da κ-caseína segue a cinética típica de Michaelis-Menten,[17] é difícil de determinar co ensaio clásico de callado do leite.
Para superar isto, propuxéronse varios métodos alternativos, como a determinación do diámetro de halo en leite xelificada en ágar,[18] medidas colorimétricas,[19] ou determinación da velocidade de degradación da caseína etiquetada previamente cun trazador radioactivo[20] ou un composto fluorocromo.[21] Todos estes métodos usan a caseína como substrato para cuantificar as actividades proteolíticas ou de callado do leite.
Interaccións do xene CSN3[editar | editar a fonte]
O xene CSN3 presenta interaccións con EIF3S6.[22]
Ensaio de FTC-Κ-caseína[editar | editar a fonte]
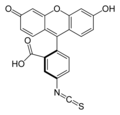
A κ-caseína etiquetada co fluorocromo isotiocianato de fluoresceína (FITC) rende o derivado fluoresceína tiocarbamoíl (FTC). Este substrato utilízase para determinar a actividade de callado do leite das proteases.[23]
O método da FTC-κ-caseína permite facer determinacións precisas e exactas da degradación κ-caseinolítica, o primeiro paso no proceso de calldo do leite. Este método é o resultado dunha modificación do descrito por S.S. Twining (1984). A principal modificación foi substituír o substrato previamente usado (caseína) pola κ-caseína etiquetada co fluorocromo isotiocianato de fluoresceína (FITC) para render o derivado fluoresceína tiocarbamoíl (FTC). Esta variación permite a cuantificación das moléculas de κ-caseína degradadas de maneira máis específica, detectando só aqueles encimas capaces de degradar tales moléculas. Porén, o método descrito por Twining (1984), foi deseñado para detectar a actividade proteolítica dunha variedade considerablemente maior de encimas. A FTC-κ-caseína permite a detección de diferentes tipos de proteases a niveis nos que o callado é aínda aparente, demostrando a súa maior sensibilidade sobre os procedementos de ensaios usados actualmente. Polo tanto, o método pode atopar aplicacións como indicador durante a purificación ou caracterización de novos encimas que callan o leite.
Notas[editar | editar a fonte]
- ↑ "Kappa casein (IPR000117)". InterPro.
- ↑ Edlund A, Johansson T, Leidvik B, Hansson L (novembro de 1996). "Structure of the human kappa-casein gene". Gene 174 (1): 65–9. PMID 8863730. doi:10.1016/0378-1119(96)00351-4.
- ↑ Fujiwara Y, Miwa M, Nogami M, Okumura K, Nobori T, Suzuki T, Ueda M (marzo de 1997). "Genomic organization and chromosomal localization of the human casein gene family". Hum Genet 99 (3): 368–73. PMID 9050925. doi:10.1007/s004390050374.
- ↑ "Entrez Gene: CSN3 casein kappa".
- ↑ 5,0 5,1 Lucey, J.A.; Johnson, M.E.; Horne, D.S. (2003). "Invited Review: Perspectives on the Basis of the Rheology and Texture Properties of Cheese". Journal of Dairy Science 86 (9): 2725–43. PMID 14507008. doi:10.3168/jds.S0022-0302(03)73869-7.
- ↑ Dalgleish, D.G. (1998). "Casein Micelles as Colloids: Surface Structures and Stabilities". Journal of Dairy Science 81 (11): 3013–8. doi:10.3168/jds.S0022-0302(98)75865-5.
- ↑ *Walstra, Pieter (1979). "The voluminosity of bovine casein micelles and some of its implications". Journal of Dairy Research 46 (2): 317–23. PMID 469060. doi:10.1017/S0022029900017234.
- ↑ 8,0 8,1 8,2 Lucey, J.A. (2002). "Formation and Physical Properties of Milk Protein Gels". Journal of Dairy Science 85 (2): 281–94. PMID 11913691. doi:10.3168/jds.S0022-0302(02)74078-2.
- ↑ Holt, C. (1992). "Structure and Stability of Bovine Casein Micelles". En Anfinsen, C.B.; Richards, Frederic M.; Edsall, John T.; et al. Advances in Protein Chemistry Volume 43. Advances in Protein Chemistry 43. pp. 63–151. ISBN 978-0-12-034243-3. PMID 1442324. doi:10.1016/S0065-3233(08)60554-9.
- ↑ Horne, David S. (1998). "Casein Interactions: Casting Light on the Black Boxes, the Structure in Dairy Products". International Dairy Journal 8 (3): 171–7. doi:10.1016/S0958-6946(98)00040-5.
- ↑ 11,0 11,1 11,2 Vasbinder, A.J.; Rollema, H.S.; Bot, A.; de Kruif, C.G. (2003). "Gelation Mechanism of Milk as Influenced by Temperature and pH; Studied by the Use of Transglutaminase Cross-Linked Casein Micelles". Journal of Dairy Science 86 (5): 1556–63. PMID 12778566. doi:10.3168/jds.S0022-0302(03)73741-2.
- ↑ Rao, Mala B.; Tanksale, Aparna M.; Ghatge, Mohini S.; Deshpande, Vasanti V. (1998). "Molecular and Biotechnological Aspects of Microbial Proteases". Microbiology and Molecular Biology Reviews 62 (3): 597–635. PMC 98927. PMID 9729602. doi:10.1128/MMBR.62.3.597-635.1998.
- ↑ Drøhse, Helle B.; Foltmann, Bent (1989). "Specificity of milk-clotting enzymes towards bovine κ-casein". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology 995 (3): 221–4. PMID 2495817. doi:10.1016/0167-4838(89)90039-3.
- ↑ 14,0 14,1 Esteves, C.L.C.; Lucey, J.A.; Wang, T.; Pires, E.M.V. (2003). "Effect of pH on the Gelation Properties of Skim Milk Gels Made from Plant Coagulants and Chymosin". Journal of Dairy Science 86 (8): 2558–67. PMID 12939079. doi:10.3168/jds.S0022-0302(03)73850-8. hdl:10316/3878.
- ↑ 15,0 15,1 15,2 Silva, S.V.; Malcata, F.X. (2005). "Partial Identification of Water-Soluble Peptides Released at Early Stages of Proteolysis in Sterilized Ovine Cheese-Like Systems: Influence of Type of Coagulant and Starter". Journal of Dairy Science 88 (6): 1947–54. PMID 15905424. doi:10.3168/jds.S0022-0302(05)72870-8. hdl:10400.14/6738.
- ↑ Kobayashi, Hideyuki (2004). "Polyporopepsin". En Barrett, Alan J.; Woessner, J. Fred; Rawlings, Neil D. Handbook of Proteolytic Enzymes. pp. 111–5. ISBN 978-0-12-079611-3. doi:10.1016/B978-0-12-079611-3.50035-5.
- ↑ 17,0 17,1 17,2 Carlson, Alfred; Hill, Charles G.; Olson, Norman F. (1987). "Kinetics of milk coagulation: II. Kinetics of the secondary phase: Micelle flocculation". Biotechnology and Bioengineering 29 (5): 582,589, 590–600. PMID 18576490. doi:10.1002/bit.260290508.
- ↑ 18,0 18,1 Poza, M.; Sieiro, C.; Carreira, L.; Barros-Velázquez, J.; Villa, T. G. (2003). "Production and characterization of the milk-clotting protease of Myxococcus xanthus strain 422". Journal of Industrial Microbiology and Biotechnology 30 (12): 691–8. PMID 14634834. doi:10.1007/s10295-003-0100-y.
- ↑ Hull, M.E. (1947). "Studies on Milk Proteins. II. Colorimetric Determination of the Partial Hydrolysis of the Proteins in Milk". Journal of Dairy Science 30 (11): 881–4. doi:10.3168/jds.S0022-0302(47)92412-0.
- ↑ Christen, G.L. (1987). "A Rapid Method for Measuring Protease Activity in Milk Using Radiolabeled Casein". Journal of Dairy Science 70 (9): 1807–14. PMID 3117854. doi:10.3168/jds.S0022-0302(87)80218-7.
- ↑ Twining, Sally S. (1984). "Fluorescein isothiocyanate-labeled casein assay for proteolytic enzymes". Analytical Biochemistry 143 (1): 30–4. PMID 6442109. doi:10.1016/0003-2697(84)90553-0.
- ↑ Hoareau Alves, Karine; Bochard Valérie; Réty Stéphane; Jalinot Pierre (Sep 2002). "Association of the mammalian proto-oncoprotein Int-6 with the three protein complexes eIF3, COP9 signalosome and 26S proteasome". FEBS Lett. (Netherlands) 527 (1–3): 15–21. ISSN 0014-5793. PMID 12220626. doi:10.1016/S0014-5793(02)03147-2.
- ↑ Ageitos, J.M.; Vallejo, J.A.; Poza, M.; Villa, T.G. (2006). "Fluorescein Thiocarbamoyl-Kappa-Casein Assay for the Specific Testing of Milk-Clotting Proteases". Journal of Dairy Science 89 (10): 3770–7. PMID 16960051. doi:10.3168/jds.S0022-0302(06)72418-3.
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Bergström S, Hansson L, Hernell O, et al. (1993). "Cloning and sequencing of human kappa-casein cDNA.". DNA Seq. 3 (4): 245–6. PMID 1296818. doi:10.3109/10425179209034024.
- Brignon G, Chtourou A, Ribadeau-Dumas B (1985). "Preparation and amino acid sequence of human kappa-casein.". FEBS Lett. 188 (1): 48–54. PMID 4018271. doi:10.1016/0014-5793(85)80872-3.
- Fiat AM, Jollès J, Aubert JP, et al. (1981). "Localisation and importance of the sugar part of human casein.". Eur. J. Biochem. 111 (2): 333–9. PMID 7460900. doi:10.1111/j.1432-1033.1980.tb04946.x.
- Plowman JE, Creamer LK, Liddell MJ, Cross JJ (1999). "Structural features of a peptide corresponding to human kappa-casein residues 84-101 by 1H-nuclear magnetic resonance spectroscopy.". J. Dairy Res. 66 (1): 53–63. PMID 10191473. doi:10.1017/S0022029998003318.
- Harrington JJ, Sherf B, Rundlett S, et al. (2001). "Creation of genome-wide protein expression libraries using random activation of gene expression.". Nat. Biotechnol. 19 (5): 440–5. PMID 11329013. doi:10.1038/88107.
- Benítez MJ, Cochet C, Jiménez JS (2002). "A surface plasmon resonance study of the interactions between the component subunits of protein kinase CK2 and two protein substrates, casein and calmodulin.". Mol. Cell. Biochem. 227 (1–2): 31–6. PMID 11827172. doi:10.1023/A:1013140220121.
- Sood SM, Slatter CW (2003). "Suspension of the calcium-sensitive human beta-caseins by human kappa-casein.". J. Dairy Sci. 85 (6): 1353–6. PMID 12146463. doi:10.3168/jds.S0022-0302(02)74200-8.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2003). "Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences.". Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899–903. Bibcode:2002PNAS...9916899M. PMC 139241. PMID 12477932. doi:10.1073/pnas.242603899.
- Gerhard DS, Wagner L, Feingold EA, et al. (2004). "The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).". Genome Res. 14 (10B): 2121–7. PMC 528928. PMID 15489334. doi:10.1101/gr.2596504.
- Kim YJ, Park S, Oh YK, et al. (2005). "Purification and characterization of human caseinomacropeptide produced by a recombinant Saccharomyces cerevisiae.". Protein Expr. Purif. 41 (2): 441–6. PMID 15866733. doi:10.1016/j.pep.2005.02.021.
- Rual JF, Venkatesan K, Hao T, et al. (2005). "Towards a proteome-scale map of the human protein-protein interaction network.". Nature 437 (7062): 1173–8. Bibcode:2005Natur.437.1173R. PMID 16189514. doi:10.1038/nature04209.
