Quiralidade (química)


En química, a quiralidade é unha propiedade xeométrica pola cal unha molécula ou ión, denominado quiral, non se pode superpoñer á súa imaxe especular por unha combinación de rotacións e translacións.[1][2][3][4] Este termo deriva do grego antigo χείρ (keir), que significa 'man'; que é o exemplo canónico dun obxecto con esta propiedade.
Unha molécula ou ión quiral existe en forma de dous estereoisómeros que son imaxes especulares un do outro e que se denominan enantiómeros, os cales se distinguen como "dextroxiro" ou "levoxiro" polas súas configuracións absolutas ou outros criterios. Os dous enantiómeros teñen practicamente as mesmas propiedades químicas, excepto cando reaccionan con outros compostos quirais. Tamén teñen as mesmas propiedades físicas, excepto que as súas actividades ópticas son opostas. Unha mestura homoxénea dos dous enantiómeros en partes iguais dise que é racémica e xeralmente difire química e fisicamente dos enantiómeros puros.
Á parte de tipos especiais de quiralidade (ver Centros estereoxenicos), a maioría das moléculas ou ións quirais debe ter polo menos un centro quiral. Cando ese centro quiral coincide cun átomo, a substancia dise que ten quiralidade puntual. En compostos orgánicos quirais un estereocentro é xeralmente un carbono asimétrico. Múltiples estereocentros poden dar lugar a estereoisómeros adicionais. Por outra parte, unha molécula cun número impar de estereocentros pode ter un ou máis estereoisómeros que non son quirais.
A quiralidade é un concepto importante en estereoquímica e bioquímica. A maioría das substancias relevantes en bioloxía son quirais, como os carbohidratos (azucres simples, amidón e celulosa), os aminoácidos que son as unidades que forman as proteínas e os ácidos nucleicos. Nos organismos vivos, atópase normalmente só un dos dous enantiómeros ou un composto quiral. Por esa razón, os organismos que consomen un composto quiral xeralmente poden metabolizar só un dos seus enantiómeros. Pola mesma razón, os dous enantiómeros dun fármaco quiral teñen potencias farmacolóxicas ou efectos moi diferentes.
Definición
[editar | editar a fonte]A quiralidade está baseada na simetría molecular. Concretamente, un composto quiral pode non conter nigún eixe de rotación impropio (Sn), que inclúe planos de simetría e centros de inversión. As moléculas quirais son sempre disimétricas (carecen de Sn) pero non sempre asimétricos (carecen de todos os elementos de simetría agás a identidade trivial). As moléculas asimétricas son sempre quirais.[5]
| Eixe rotacional (Cn) |
Elementos rotacionais impropios (Sn) | ||
|---|---|---|---|
| Quiral ningún Sn |
Aquiral plano especular S1 = σ |
Aquiral centro de inversión S2 = i | |
| C1 |  |
 |

|
| C2 |  |
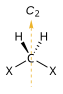 |

|
Centros estereoxénicos
[editar | editar a fonte]- Artigo principal: Centro estereoxénico.
Moitas moléculas quirais teñen quiralidade puntual, concretamente un só centro estereoxénico que coincide cun átomo. Ese centro estereoxénico xeralmente ten catro enlaces ou máis con grupos diferentes e pode ser un carbono (como en moitas moléculas biolóxicas), silicio, ou un metal (como en moitos compostos de coordinación). Porén, un centro estereoxénico pode ser tamén un átomo trivalente cuxos enlaces non están no mesmo plano, como o fósforo en fosfinas P-quirais (PRR′R″) e xofre en sulfóxidos S-quirais (OSRR′).
A quiralidade pode tamén orixinarse por diferenzas isotópicas entre átomos, como no bencil alcohol deuterado PhCHDOH; que é quiral e opticamente activo ([α]D = 0,715°), mesmo se o composto non deuterado PhCH2OH non o é.[6]
Se dous enantiómeros se interconverten doadamente, os enantiómeros puros poden ser practicamente imposibles de separar, e só se observa a mestura racémica. Este é o caso, por exemplo, da maioría das aminas con tres substituíntes diferentes (NRR′R″), debido á barreira de enerxía baixa para a inversión do nitróxeno.

- Outros tipos
Aínda que a presenza dun centro estereoxénico describe a gran maioría das moléculas quirais, existen moitas variacións e excepcións. Por exemplo non é necesario que unha substancia quiral teña un centro estereoxénico. Exemplos son o 1-bromo-3-cloro-5-fluoroadamantano, o metiletilfeniltetraedrano, certos calixarenos e fulerenos, que teñen unha quiralidade inherente. As especies con simetría C2 1,1′-bi-2-naftol (BINOL), e 1,3-dicloroaleno teñen quiralidade axial. O (E)-cicloocteno e moitos ferrocenos teñen unha quiralidade planar.
Cando a rotación dun enantiómero é demasiado baixa para a súa medición práctica, a especie dise que presenta criptoquiralidade.
Manifestacións da quiralidade
[editar | editar a fonte]Os isómeros quirais mostran frecuentemente diferentes propiedades, como por exemplo:
- Sabor: o edulcorante artificial aspartamo ten dous enantiómeros. O L-aspartamo ten sabor doce, mentres que o D-aspartamo é insaboro.[7]
- Olor: A R-(–)-carvona ole como a hortelá (Mentha spicata), mentres que a S-(+)-carvona cheira como a carvea (Carum carvi).[8]
- Efectividade como fármaco: o fármaco antidepresivo Citalopram véndese como mestura racémica. Porén, só o enantiómero (S)-(+) é responsable dos efectos beneficiosos do fármaco.[9][10]
- Seguridade como fármaco: A D‑penicilamina utilízase na terapia de quelación e para o tratamento da artrite reumatoide, mentres que a L‑penicilamina é tóxica, xa que inhibe a acción da piridoxina, unha vitamina do grupo B esencial.[11]
En bioquímica
[editar | editar a fonte]Moitas moléculas bioloxicamente activas son quirais, incluíndo os aminoácidos naturais (unidades formadoras das proteínas) e os azucres.
A orixe desta homoquiralidade en bioloxía foi moi discutida.[12] A maioría dos científicos cren que a vida na Terra "escolleu" o tipo de quiralidade por puro azar, e que de existiren formas de vida noutro lugar do universo, a súa química podería teoricamente ter a quiralidade oposta. Porén, algúns suxeriron que os primeiros aminoácidos puideron formarse no po de cometas. Nese caso, a radiación polarizada circularmente (que constitúe ata o 17% da radiación estelar) puido causar a destrución selectiva dunha das quiralidades dos aminoácidos, o que levou a un nesgo na selección que finalmente tivo como resultado que toda a vida da Terra fose homoquiral.[13][14]
Os encimas, que son quirais, a miúdo distinguen entre os dous enantiómeros dun substrato quiral. Podemos imaxinar un encima como unha molécula que é como unha luva que ten unha cavidade para que se una alí un substrato. Se esta luva é dextroxira, entón un dos enantiómeros axustarase ben na cavidade e poderá unirse, mentres que o outro enantiómero axustarase mal e é improbable que se una.
As formas L dos aminoácidos tenden a ser insaboras, mentres que as D adoitan ser doces.[12] As follas da planta hortelá (Mentha spicata) conteñen o enantiómero L do composto carvona ou R-(−)-carvona e as sementes da carvea (Carum carvi) conteñen os enantiómeros D ou S-(+)-carvona.[15] As dúas cheiran de maneira diferente á maioría da xente porque os nosos receptores olfactivos son quirais.
A quiralidade tamén é importante no estudo de fases ordenadas; por exemplo, a adición dunha pequena cantidade dunha molécula opticamente activa a unha fase nemática (unha fase que as moléculas se ordenan lonxitudinalmente) transforma esa fase nunha fase nemática quiral (ou fase colestérica). A quiralidade no contexto de ditas fases en fluídos poliméricos foi tamén estudada.[16]
En química inorgánica
[editar | editar a fonte]
A quiralidade é unha propiedade simétrica, non unha propiedade propia dunha parte da táboa periódica. Así, moitos materiais inorgánicos, moléculas e ións son quirais. O cuarzo é un exemplo do reino mineral. Este tipo de materiais non céntricos son interesantes para aplicacións en óptica non linear.
Nas área da química de coordinación e química organometálica, a quirlidade está omnipresente e é de grande importancia práctica. Un famoso exemplo é o complexo tris(bipiridina)rutenio(II), no cal os tres ligandos bipiridina adoptan unha disposición quiral como unha hélice propulsora.[17] Os dous enantiómeros de complexos como o [Ru(2,2′-bipiridina)3]2+ poden designarse como Λ (lambda maiúsculo, o equivalente en grego do "L") para os xiros á sinistra da hélice descritos polos ligndos, e Δ (delta maiúscula, o "D" grego) para os xiros á destra (representado). Compárese tamén coa terminoloxía dextro- e levo-).
Os ligandos quirais confiren quiralidade a un complexo metálico, como se ilustra cos complexos metal-aminoácido. Se o metal mostra propiedades catalíticas, a súa combinación cun ligando quiral é a base da catálise asimétrica.[18]
Métodos e prácticas
[editar | editar a fonte]O termo actividade óptica deriva da interacción de materiais quirais con luz polarizada. Nunha solución, a forma (−), ou levorrotatoria, dun isómero óptico rota o plano dun raio de luz polarizada linearmente en contra do sentido das agullas do reloxo. A forma (+) ou dextrorrotatoria, dun isómero óptico rótao no sentido contrario. A rotación da luz mídese usando un polarímetro e exprésase como rotación óptica.
Nomenclatura miscelánea
[editar | editar a fonte]- Unha substancia non racémica quiral denomínase escalémica. Os materias escalémicos poden ser enantiopuros ou enantioenriquecidos.[19]
- Unha substancia quiral é enantiopura cando está presente só un dos dous posibles enantiómeros polo que todas as moléculas da mostra teñen o mesmo sentido de quiralidade. O uso do termo homoquiral como sinónimo non se aconsella en absoluto.[20]
- Unha substancia quiral é enantioenriquecida ou heteroquiral cando a súa proporción enantiomérica é maior de 50:50 pero menor de 100:0.[21]
- O exceso enantiomérico ou e.e. é a diferenza entre a cantidade dun enatiómero presente comparada coa do outro. Por exemplo, unha mostra cun 40% de e.e. de R contén un 70% de R e un 30% de S (70% − 30% = 40%).[22]
Historia
[editar | editar a fonte]O primeiro que observou a rotación do plano da luz polarizada por substancias quirais foi Jean-Baptiste Biot en 1815,[23] e adquiriu considerable importancia na industria do azucre, química analítica e farmacéutica. Louis Pasteur deduciu en 1848 que este fenómeno tiña unha base molecular.[24][25] O termo quiralidade foi acuñado por Lord Kelvin en 1894.[26] Os diferentes enantiómeros ou diasteroisómeros dun composto foron chamados formalmente isómeros ópticos debido ás súas diferentes propiedades ópticas.[27] Durante bastante tempo pensouse que a quiralidade estaba asociada coa química orgánica, pero isto é un erro que foi desbotado coa resolución dun composto puramente inorgánico como o hexol, feito por Alfred Werner.
Notas
[editar | editar a fonte]- ↑ Organic Chemistry (4th Edition) Paula Y. Bruice. Pearson Educational Books. ISBN 9780131407480
- ↑ Organic Chemistry (3rd Edition) Marye Anne Fox, James K. Whitesell Jones & Bartlett Publishers (2004) ISBN 0763721972
- ↑ "Chirality". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ "Superposability". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ Cotton, F. A., "Chemical Applications of Group Theory," John Wiley & Sons: New York, 1990.
- ↑ ^Streitwieser, A., Jr.; Wolfe, J. R., Jr.; Schaeffer, W. D. (1959). "Stereochemistry of the Primary Carbon. X. Stereochemical Configurations of Some Optically Active Deuterium Compounds". Tetrahedron 6 (4): 338–344. doi:10.1016/0040-4020(59)80014-4.
- ↑ Gal, Joseph (2012). "The Discovery of Stereoselectivity at Biological Receptors: Arnaldo Piutti and the Taste of the Asparagine Enantiomers-History and Analysis on the 125th Anniversary". Chirality 24 (12): 959–976. PMID 23034823. doi:10.1002/chir.22071.
- ↑ Theodore J. Leitereg; Dante G. Guadagni; Jean Harris; Thomas R. Mon; Roy Teranishi (1971). "Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones". J. Agric. Food Chem. 19 (4): 785–787. doi:10.1021/jf60176a035.
- ↑ Lepola U, Wade A, Andersen HF (May 2004). "Do equivalent doses of escitalopram and citalopram have similar efficacy? A pooled analysis of two positive placebo-controlled studies in major depressive disorder". Int Clin Psychopharmacol 19 (3): 149–55. PMID 15107657. doi:10.1097/00004850-200405000-00005.
- ↑ Hyttel, J.; Bøgesø, K. P.; Perregaard, J.; Sánchez, C. (1992). "The pharmacological effect of citalopram resides in the (S)-(+)-enantiomer". Journal of Neural Transmission 88 (2): 157–160. PMID 1632943. doi:10.1007/BF01244820.
- ↑ JAFFE, IA; ALTMAN, K; MERRYMAN, P (Oct 1964). "The Antipyridoxine Effect of Penicillamine in Man.". The Journal of Clinical Investigation 43 (10): 1869–73. PMC 289631. PMID 14236210. doi:10.1172/JCI105060.
- ↑ 12,0 12,1 Meierhenrich, Uwe J. (2008). Amino acids and the Asymmetry of Life. Berlin, GER: Springer. ISBN 978-3540768852.
- ↑ McKee, Maggie (2005-08-24). "Space radiation may select amino acids for life". New Scientist. Consultado o 2016-02-05.
- ↑ Meierhenrich Uwe J., Nahon Laurent, Alcaraz Christian, Hendrik Bredehöft Jan, Hoffmann Søren V., Barbier Bernard, Brack André (2005). "Asymmetric Vacuum UV photolysis of the Amino Acid Leucine in the Solid State". Angew. Chem. Int. Ed. 44 (35): 5630–5634. PMID 16035020. doi:10.1002/anie.200501311.
- ↑ Theodore J. Leitereg; Dante G. Guadagni; Jean Harris; Thomas R. Mon; Roy Teranishi (1971). "Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones". J. Agric. Food Chem. 19 (4): 785–787. doi:10.1021/jf60176a035.
- ↑ Srinivasarao, M. (1999). "Chirality and Polymers". Current Opinion in Colloid & Interface Science 4 (5): 369–376. doi:10.1016/S1359-0294(99)00024-2.
- ↑ von Zelewsky, A. (1995). Stereochemistry of Coordination Compounds. Chichester: John Wiley.. ISBN 047195599X.
- ↑ Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. ISBN 189138953X
- ↑ Eliel, E.L. (1997). "Infelicitous Stereochemical Nomenclatures". Chirality 9 (56): 428–430. doi:10.1002/(sici)1520-636x(1997)9:5/6<428::aid-chir5>3.3.co;2-e. Arquivado dende o orixinal o 03 de marzo de 2016. Consultado o 5 February 2016.
- ↑ "asymmetric synthesis". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ "enantiomerically enriched (enantioenriched)". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ "enantiomer excess (enantiomeric excess)". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ Lakhtakia, A. (ed.) (1990). Selected Papers on Natural Optical Activity (SPIE Milestone Volume 15). SPIE.
- ↑ Pasteur, L. (1848). "Researches on the molecular asymmetry of natural organic products, English translation of French original, published by Alembic Club Reprints (Vol. 14, pp. 1–46) in 1905, facsimile reproduction by SPIE in a 1990 book".
- ↑ Eliel, Ernest Ludwig; Wilen, Samuel H.; Mander, Lewis N. (1994). "Chirality in Molecules Devoid of Chiral Centers (Chapter 14)". Stereochemistry of Organic Compounds (1st ed.). New York, NY, USA: Wiley & Sons. ISBN 978-0471016700. Consultado o 2 February 2016.
- ↑ Bentley, Ronald (1995). "From Optical Activity in Quartz to Chiral Drugs: Molecular Handedness in Biology and Medicine.". Perspect. Biol. Med. 38 (2): 188–229. PMID 7899056. doi:10.1353/pbm.1995.0069.
- ↑ "Optical isomers". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2012). Organic Chemistry (2nd ed.). Oxford, UK: Oxford University Press. pp. 319f, 432, 604np, 653, 746int, 803ketals, 839, 846f. ISBN 978-0199270293. Consultado o 2 February 2016.
- Eliel, Ernest Ludwig; Wilen, Samuel H.; Mander, Lewis N. (1994). "Chirality in Molecules Devoid of Chiral Centers (Chapter 14)". Stereochemistry of Organic Compounds. Chirality 9 (1st ed.) (New York, NY, USA: Wiley & Sons). pp. 428–430. ISBN 978-0471016700. doi:10.1002/(SICI)1520-636X(1997)9:5/6<428::AID-CHIR5>3.0.CO;2-1. Consultado o 2 February 2016.
- Eliel, E.L. (1997). "Infelicitous Stereochemical Nomenclatures". Chirality 9 (5–6): 428–430. doi:10.1002/(SICI)1520-636X(1997)9:5/6<428::AID-CHIR5>3.0.CO;2-1. Arquivado dende o orixinal o 03 de marzo de 2016. Consultado o 5 February 2016.
- Gal, Joseph (2013). "Molecular Chirality: Language, History, and Significance". Differentiation of Enantiomers I. Chirality. Topics in Current Chemistry 340. pp. 1–20. ISBN 978-3-319-03238-2. PMID 23666078. doi:10.1007/128_2013_435.
Ligazóns externas
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Quiralidade |
- 21st International Symposium on Chirality
- Estereoisomería - Isomería óptica
- Symposium highlights-Session 5: New technologies for small molecule synthesis
- Nomenclatura da IUPAC para as configuracións de aminoácidos.
- Explicación da nomenclatura R/S da Universidade do estado de Michigan
- Chirality & Odour Perception en leffingwell.com
- Chirality & Bioactivity I.: Pharmacology
- Quiralidade e busca de vida extraterrestre
- The Handedness of the Universe de Roger A Hegstrom e Dilip K Kondepudi
