Zwitterión
Un zwitterión,[1] do alemán Zwitter ([ˈtsvɪtɐ]), 'hermafrodita', é unha molécula que contén un número igual de grupos funcionais cargados positivamente que cargados negativamente.[2] Os zwitterións tamén se chaman sales internos. Nos aminoácidos, por exemplo, en solución establécese un equilibrio químico entre a molécula "parental" e o zwitterión.
As betaínas son zwitterións que non poden isomerizarse a unha forma totalmente neutra, como cando unha carga positiva está localizada sobre un grupo amonio cuaternario. De xeito similar, unha molécula que conteña un grupo fosfonio e un grupo carboxilato non se pode isomerizar.
Aminoácidos
[editar | editar a fonte]
No caso dos aminoácidos e equilibrio establécese en dúas etapas. Nunha etapa transfírese un protón desde o grupo carboxilo a unha molécula de auga.
Noutra etapa transfíree un protón desde o ión hidronio ao grupo amino
En conxunto, a reacción é unha reacción de isomerización
A razón das concentacións das dúas especies en solucion é independente do pH, xa que é igual ao valor da constante de equilibrio para a reacción de isomerización.
[X] significa a concentrción da especie química X no equilibrio. Asúmese xeralmente que K>1, é dicir, que o zwitterión é o isómero de aminoácido predominante en solución acuosa. Suxeriuse que, baseándose nunha análise teórica, o zwitterión está estabilizado en solución acuosa por enlaces de hidróxeno con moléculas de auga do solvente.[3] As análises de datos de difracción de neutróns para a glicina mostraron que está en forma zwitteriónica en estado sólido e confrmaron a presenza de enlaces de hidróxeno.[4] Utilizáronse cálculos teóricos para mostrar que os zwitterións poden tamén estar presentes na fase de gas nalgúns casos diferentes da simple transferencia de ácido carboxílico a amino.[5]
Os valores de pKa para a desprotonación dos aminoácidos comúns están no rango de 2,15 ± 0,2. Isto é tamén consistente co predominio do isómero zwitterión en solucións acuosas. Como comparación, o ácido carboxílico ácido propiónico, RCO2H (R=CH3CH2), ten un valor de pK de 4,88.
Outros compostos
[editar | editar a fonte]-
Isómeros do ácido sulfámico, co zwitterión (dereita)
-
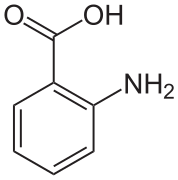
Ácido antranílico
-
Estrutura do H4EDTA
O ácido sulfámico cristaliza en forma de zwitterión.[6]
En cristais de ácido antranílico hai dúas moléculas na cela unidade. Unha molécula é a forma zwitteriónica, a outra non.[7]
No estado sólido, o H4EDTA é un zwitterión con dous protóns que foron transferidos desde grupos ácido carboxílico a átomos de nitróxeno.[8]
Estudos teóricos
[editar | editar a fonte]
Aínda que o equilibrio en solución entre un composto e o seu isómero zwitterión non se pode estudar experimentalmente, poden obterse algunhas conclusións dos resultados dos cálculos teóricos. Un bo exemplo proporciónao o fosfato de piridoxal, unha forma de vitamina B6. Prediciuse un equilibrio tautomérico para a obtención deste composto en solución acuosa, favorecendo o zwitterión, no cal se transfire un protón do grupo -OH fenólico ao átomo de nitróxeno.[9]
Betaínas e compostos similares
[editar | editar a fonte]O composto trimetilglicina, que foi illado da remolacha azucreira (Beta vulgaris), foi denominado "betaína". Posteriormente, descubríronse outros compostos que conteñen o mesmo motivo estrutural, un átomo de nitróxeno cuaternario cun grupo carboxilato unido a el por medio dun elo de -CH2-. Actualmente, todos os compostos cuxa estrutura inclúe este motivo denomínanse betaínas. As betínas non se isomerizan porque os grupos químicos unidos ao átomo de nitróxeno non son lábiles. Estes compostos poden clasificarse como zwitterións permanentes, xa que non ocorre a isomerización a unha molécula sen cargas eléctricas, ou é moi lenta.[10]
Outros exemplos de zwitterións permanentes son as fosfatidilcolinas e a psilocibina, que tamén conteñen un átomo de nitróxeno cuaternario, pero cun grupo foasfato cargado negativamente en lugar dun grupo carboxilato e surfactantes pulmonares como a dipalmitoilfosfatidilcolina.
-
Trimetilglicina (nome trivial betaína)
-
Exemplo dunha fosfatidilcolina
-
Lauramidopropil betaína, o principal compoñente da cocamidopropil betaína
Notas
[editar | editar a fonte]- ↑ BUSCatermos zwitterión
- ↑ Skoog, Douglas, A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2004). Fundamentals of Analytical Chemistry (8th ed.). Thomson/Brooks/Cole. pp. 231,385, 419,460. ISBN 0-03-035523-0. 9th edition (20113), pp 415-416, ISBN 9781285607191
- ↑ Jensen, Jan H.; Gordon, Mark S. (1995). "On the Number of Water Molecules Necessary To Stabilize the Glycine Zwitterion". J. Am. Chem. Soc. 117 (31): 8159–8170. doi:10.1021/ja00136a013.
- ↑ Jönsson, P.-G.; Kvick, Å. (1972). "Precision neutron diffraction structure determination of protein and nucleic acid components. III. The crystal and molecular structure of the amino acid α-glycine" (PDF). Acta Crystallographica Section B 28 (6): 1827–1833. doi:10.1107/S0567740872005096. Arquivado dende o orixinal (PDF) o 14 de marzo de 2020. Consultado o 15 de maio de 2020.
- ↑ Price, William D.; Jockusch, Rebecca A.; Williams, Evan R. (1997). "Is Arginine a Zwitterion in the Gas Phase?". Journal of the American Chemical Society 119 (49): 11988–11989. PMC 1364450. PMID 16479267. doi:10.1021/ja9711627.
- ↑ R. L. Sass (April 1960). "A neutron diffraction study on the crystal structure of sulfamic acid". Acta Crystallogr. 13 (4): 320–324. doi:10.1107/S0365110X60000789.
- ↑ Brown, C.J; Ehrenberg, M. (1985). "Anthranilic acid, C7H7NO2, by neutron diffraction". Acta Cryst. C41: 441–443. doi:10.1107/S0108270185004206.
- ↑ Cotrait, Par Michel (1972). "La structure cristalline de l'acide éthylènediamine tétraacétique, EDTA". Acta Crystallographica Section B 28: 781–785. doi:10.1107/S056774087200319X.
- ↑ Kiruba, G. S. M.; Ming, Wah Wong (2003). "Tautomeric Equilibria of Pyridoxal-5‘-phosphate and 3-Hydroxypyridine Derivatives: A Theoretical Study of Solvation Effects". J. Org. Chem. 68 (7): 2874–2881. doi:10.1021/jo0266792.
- ↑ Nelson, D. L.; Cox, M. M. Lehninger, Principles of Biochemistry 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6




![{\displaystyle K={\frac {[H_{3}N^{+}(R)CO_{2}^{-}]}{[H_{2}N(R)CO_{2}H]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/018c5122fee4f8c30ac282f8d86927e47099cf90)