Lipase pancreática

A lipase pancreática, tamén chamada triacilglicerol lipase pancreática, é un encima segregado polo páncreas, que actúa no intestino delgado, e é a principal lipase que hidroliza os lípidos da dieta durante a dixestión no aparato dixestivo humano. Converte os triglicéridos (triacilglicerois) que se encontran nas graxas e aceites da dieta en monoglicéridos (monoacilglicerois) e ácidos graxos libres, ao cortar dous dos enlaces éster entre o glicerol e os ácidos graxos (deixando intacto o enlace co ácido graxo central). O encima pertence á familia das triglicérido lipases.
- Triacilglicerol + 2 H2O 2-monoacilglicerois + 2 anións de ácidos graxos
Os sales biliares segregados polo fígado e almacenados na vesícula biliar son liberados no duodeno, onde rodean e enulsionan as grandes pingas de graxa en pequenas pinguiñas, o que incrementa a súa área superficial global, o cal facilita que a lipase acceda e procese máis eficazmente as moléculas de graxa (triglicerois). A lipase pancreática produce dous ácidos graxos libres e unha molécula de 2-monoacilglicerol, que despois baixan polo intestino delgado e absorbidos.
A diferenza doutros encimas pancreáticos, que están inactivos no páncreas e son activados por clivaxe proteolítica cando chegan ao duodeno (por exemplo o tripsinóxeno), a lipase pancreática é segregada na súa forma madura, aínda que só realiza unha catálise eficiente se está presente no duodeno o encima colipase. A colipase pancreática únese ao dominio C-terminal non catalítico da lipase, o que a estabiliza na súa conformación activa e aumenta a hidrofobicidade do sitio activo. Á súa vez a colipase debe ser activada pola tripsina.
Nos humanos a lipase pancreática está codificada no xene PNLIP do cromosoma 10.[2][3]
Importancia para o diagnóstico
[editar | editar a fonte]A lipase pancreática segrégase ao duodeno. Normalmente a súa concentración no soro sanguíneo é moi baixa, pero cando hai un trastorno extremo da función pancreática, como na pancreatite ou no adenocarcinoma pancreático, o páncreas pode comezar a autolisarse e a liberar ao soro encimas pancreáticos como a lipase, polo que o seu nivel no soro aumenta. Medindo as concentracións de lipase pancreática no soro, pode diagnosticarse a pancreatite aguda.[4]
Familia da lipase pancreática (triglicérido lipases)
[editar | editar a fonte]| Lipase pancreática | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
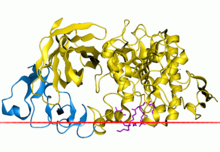 Complexo da lipase pancreática humana coa colipase | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Lipase | ||||||||||
| Pfam | PF00151 | ||||||||||
| InterPro | IPR013818 | ||||||||||
| PROSITE | PDOC00110 | ||||||||||
| SCOPe | 1lpa / SUPFAM | ||||||||||
| OPM protein | 1lpa | ||||||||||
| |||||||||||
A familia das triglicérido lipases (número EC 3.1.1.3) está formada polos encimas lipolíticos que hidrolizan os enlaces éster dos triglicéridos, á que pertence a lipase pancreática.[5] É unha familia amplamente distribuída en animais, plantas e procariotas.
Existen polo menos tres isoencimas específicos de tecidos nos vertebrados superiores, o pancreático, o hepático e o gástrico/lingual. Estas lipases están estreitamente relacionadas unhas con outras e coa lipoproteína lipase (EC 3.1.1.34), a cal hidroliza os triglicéridos nos quilomicrons e lipoproteínas de moi baixa densidade (VLDL).[6]
A rexión máis conservada en todas estas proteínas está centrada arredor dun residuo de serina,[7] que participa, xunto cun residuo de histidina e outro de ácido aspártico, nun sistema de relevo de carga. Esta rexión está tamén presente nas lipases de procariotas e na lecitín-colesterol aciltransferase (EC 2.3.1.43) (LCAT),[8] que catliza a transferencia de ácidos graxos entre a fosfatidilcolina e o colesterol.
Proteínas humanas que conteñen este dominio
[editar | editar a fonte]LIPC; LIPG; LIPH; LIPI; LPL; PLA1A; PNLIP; PNLIPRP1; PNLIPRP2; PNLIPRP3;
Notas
[editar | editar a fonte]- ↑ PDB 1LPB ; Egloff MP, Marguet F, Buono G, Verger R, Cambillau C, van Tilbeurgh H (March 1995). "The 2.46 Å resolution structure of the pancreatic lipase-colipase complex inhibited by a C11 alkyl phosphonate". Biochemistry 34 (9): 2751–62. doi:10.1021/bi00009a003. PMID 7893686.
- ↑ Davis RC, Diep A, Hunziker W, Klisak I, Mohandas T, Schotz MC, Sparkes RS, Lusis AJ (1991). "Assignment of human pancreatic lipase gene (PNLIP) to chromosome 10q24-q26". Genomics 11 (4): 1164–6. PMID 1783385. doi:10.1016/0888-7543(91)90048-J.
- ↑ "Entrez Gene: pancreatic lipase".
- ↑ Koop H (1984). "Serum levels of pancreatic enzymes and their clinical significance". Clin Gastroenterol 13 (3): 739–61. PMID 6207965.
- ↑ Chapus C, Rovery M, Sarda L, Verger R (1988). "Minireview on pancreatic lipase and colipase". Biochimie 70 (9): 1223–1234. PMID 3147715. doi:10.1016/0300-9084(88)90188-5.
- ↑ Persson B, Bengtsson-Olivecrona G, Enerback S, Olivecrona T, Jornvall H (1989). "Structural features of lipoprotein lipase. Lipase family relationships, binding interactions, non-equivalence of lipase cofactors, vitellogenin similarities and functional subdivision of lipoprotein lipase". Eur. J. Biochem. 179 (1): 39–45. PMID 2917565. doi:10.1111/j.1432-1033.1989.tb14518.x.
- ↑ Blow D (1990). "Enzymology. More of the catalytic triad". Nature 343 (6260): 694–695. PMID 2304545. doi:10.1038/343694a0.
- ↑ McLean J, Fielding C, Drayna D, Dieplinger H, Baer B, Kohr W, Henzel W, Lawn R (1986). "Cloning and expression of human lecithin-cholesterol acyltransferase cDNA". Proc. Natl. Acad. Sci. U.S.A. 83 (8): 2335–2339. PMC 323291. PMID 3458198. doi:10.1073/pnas.83.8.2335.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Roussel A, Yang Y, Ferrato F, Verger R, Cambillau C, Lowe M (1998). "Structure and activity of rat pancreatic lipase-related protein 2". J. Biol. Chem. 273 (48): 32121–8. PMID 9822688.
- Crandall WV, Lowe ME (2001). "Colipase residues Glu64 and Arg65 are essential for normal lipase-mediated fat digestion in the presence of bile salt micelles.". J. Biol. Chem. 276 (16): 12505–12. PMID 11278590. doi:10.1074/jbc.M009986200.
- Freie AB, Ferrato F, Carrière F, Lowe ME (2006). "Val-407 and Ile-408 in the beta5'-loop of pancreatic lipase mediate lipase-colipase interactions in the presence of bile salt micelles.". J. Biol. Chem. 281 (12): 7793–800. PMID 16431912. doi:10.1074/jbc.M512984200.
- Hegele RA, Ramdath DD, Ban MR; et al. (2001). "Polymorphisms in PNLIP, encoding pancreatic lipase, and associations with metabolic traits.". J. Hum. Genet. 46 (6): 320–4. PMID 11393534. doi:10.1007/s100380170066.
- Chahinian H, Sias B, Carrière F (2000). "The C-terminal domain of pancreatic lipase: functional and structural analogies with c2 domains.". Curr. Protein Pept. Sci. 1 (1): 91–103. PMID 12369922.
- Ranaldi S, Belle V, Woudstra M; et al. (2009). "Lid opening and unfolding in human pancreatic lipase at low pH revealed by site-directed spin labeling EPR and FTIR spectroscopy.". Biochemistry 48 (3): 630–8. PMID 19113953. doi:10.1021/bi801250s.
- Grupe A, Li Y, Rowland C; et al. (2006). "A scan of chromosome 10 identifies a novel locus showing strong association with late-onset Alzheimer disease.". Am. J. Hum. Genet. 78 (1): 78–88. PMC 1380225. PMID 16385451. doi:10.1086/498851.
- Thomas A, Allouche M, Basyn F; et al. (2005). "Role of the lid hydrophobicity pattern in pancreatic lipase activity.". J. Biol. Chem. 280 (48): 40074–83. PMID 16179352. doi:10.1074/jbc.M502123200.
- van Tilbeurgh H, Egloff MP, Martinez C; et al. (1993). "Interfacial activation of the lipase-procolipase complex by mixed micelles revealed by X-ray crystallography.". Nature 362 (6423): 814–20. PMID 8479519. doi:10.1038/362814a0.
- Lessinger JM, Arzoglou P, Ramos P; et al. (2003). "Preparation and characterization of reference materials for human pancreatic lipase: BCR 693 (from human pancreatic juice) and BCR 694 (recombinant).". Clin. Chem. Lab. Med. 41 (2): 169–76. PMID 12667003. doi:10.1515/CCLM.2003.028.
- Colin DY, Deprez-Beauclair P, Allouche M; et al. (2008). "Exploring the active site cavity of human pancreatic lipase.". Biochem. Biophys. Res. Commun. 370 (3): 394–8. PMID 18353248. doi:10.1016/j.bbrc.2008.03.043.
- Ramos P, Coste T, Piémont E; et al. (2003). "Time-resolved fluorescence allows selective monitoring of Trp30 environmental changes in the seven-Trp-containing human pancreatic lipase.". Biochemistry 42 (43): 12488–96. PMID 14580194. doi:10.1021/bi034900e.
- Yang Y, Lowe ME (1998). "Human pancreatic triglyceride lipase expressed in yeast cells: purification and characterization.". Protein Expr. Purif. 13 (1): 36–40. PMID 9631512. doi:10.1006/prep.1998.0874.
- Sims HF, Jennens ML, Lowe ME (1993). "The human pancreatic lipase-encoding gene: structure and conservation of an Alu sequence in the lipase gene family.". Gene 131 (2): 281–5. PMID 8406023. doi:10.1016/0378-1119(93)90307-O.
- Grandval P, De Caro A, De Caro J; et al. (2004). "Critical evaluation of a specific ELISA and two enzymatic assays of pancreatic lipases in human sera.". Pancreatology 4 (6): 495–503; discussion 503–4. PMID 15316225. doi:10.1159/000080246.
- Belle V, Fournel A, Woudstra M; et al. (2007). "Probing the opening of the pancreatic lipase lid using site-directed spin labeling and EPR spectroscopy.". Biochemistry 46 (8): 2205–14. PMID 17269661. doi:10.1021/bi0616089.
- Gerhard DS, Wagner L, Feingold EA; et al. (2004). "The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).". Genome Res. 14 (10B): 2121–7. PMC 528928. PMID 15489334. doi:10.1101/gr.2596504.
- Lowe ME (1997). "Structure and function of pancreatic lipase and colipase.". Annu. Rev. Nutr. 17: 141–58. PMID 9240923. doi:10.1146/annurev.nutr.17.1.141.
- Strausberg RL, Feingold EA, Grouse LH; et al. (2002). "Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences.". Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899–903. PMC 139241. PMID 12477932. doi:10.1073/pnas.242603899.
- Bourbon-Freie A, Dub RE, Xiao X, Lowe ME (2009). "Trp-107 and trp-253 account for the increased steady state fluorescence that accompanies the conformational change in human pancreatic triglyceride lipase induced by tetrahydrolipstatin and bile salt.". J. Biol. Chem. 284 (21): 14157–64. PMID 19346257. doi:10.1074/jbc.M901154200.
- Ranaldi S, Belle V, Woudstra M; et al. (2010). "Amplitude of pancreatic lipase lid opening in solution and identification of spin label conformational subensembles by combining continuous wave and pulsed EPR spectroscopy and molecular dynamics.". Biochemistry 49 (10): 2140–9. PMID 20136147. doi:10.1021/bi901918f.
Este artigo contén textos de InterPro IPR013818 en dominio público.

