Laminina

As lamininas son proteínas da matriz extracelular de elevado peso molecular (~400kDa). Son un compoñente importante e bioloxicamente activo da lámina basal (unha das capas da membrana basal), unha rede proteica na que se fixan moitas células e órganos. As lamininas inflúen na diferenciación celular, migración, e adhesión de células, e no seu fenotipo e supervivencia.[1]
As lamininas son proteínas triméricas que conteñen cadeas α, β e γ (unha de cada), as cales poden atoparse en forma de cinco, catro e tres variantes xenéticas, respectivamente. As moléculas de lamininas denomínanse de acordo coa súa composición en cadeas. Así, a laminina-511 contén as cadeas α5, β1, e γ1.[2] Identificáronse outras catorce combinacións de cadeas in vivo. As proteínas triméricas crúzanse formando unha estrutura reticulada que pode unirse a outras moléculas da membrana plasmática ou da matriz extracelular.[3] Os tres brazos máis curtos teñen grande facilidade para unirse a outras moléculas de laminina, o cal lles permite formar láminas. O brazo longo da proteína pode unirse ás células, axudando a ancorar as células dos tecidos organizados á membrana.
A familia das glicoproteínas lamininas constitúe unha parte integral do armazón estrutural de case todos os tecidos do organismo. Son segregadas e incorporadas ás matrices extracelulares asociadas coas células. A laminina é vital para o mantemento e supervivencia dos tecidos. As lamininas defectuosas poden causar que os músculos se formen incorrectamente, orixinando distrofia muscular, enfermidades cutáneas mortais (epidermólise ampolosa xuncional) e defectos na filtración renal (síndrome nefrótica). [4]
As lamininas da matriz extracelular non deben confundirse coas proteínas laminas da lámina nuclear, de nome parecido.
Tipos
[editar | editar a fonte]Identificáronse quince trímeros de lamininas. As lamininas son combinacións de diferentes cadeas alfa-, beta-, e gamma.[5]
- As cinco formas de cadea alfa son: LAMA1, LAMA2, LAMA3, LAMA4, LAMA5
- As cadeas beta son: LAMB1, LAMB2, LAMB3, LAMB4
- As cadeas gamma poden ser: LAMC1, LAMC2, LAMC3
As lamininas anteriormente numerábanse da forma: laminina-1, laminina-2, laminina-3..., pero a nomenclatura cambiou recentemente e agora descríbense con tres números as variantes das cadeas que están presentes en cada isoforma. Por exemplo, a laminin-511 contén unha cadea α5, unha cadea β1 e unha cadea γ1.[2]
Funcións
[editar | editar a fonte]As lamininas forman redes independentes e están asociadas coas redes de coláxeno e tipo IV por medio da entactina,[6] fibronectina,[7] e perlecán. Tamén se unen ás membranas plasmáticas por medio de receptores da integrina e outras moléculas da membrana plasmática, como o complexo glicoproteico distroglicano e a glicoproteína do grupo sanguíneo Lutheran.[3] Por medio destas interaccións, as lamininas contribúen de forma fundamental á adhesión das células e á diferenciación, forma e movemento celulares, mantemento do fenotipo dos tecidos, e favorecen a supervivencia dos tecidos.[3][5] Algunhas destas funcións biolóxicas das lamininas foron asociadas con secuencias de aminoácidos específicas ou fragmentos de laminina.[3] Por exemplo, a secuencia peptídica [GTFALRGDNGDNGQ] (ver simboloxía de aminoácidos), que está localizada na cadea alfa das lamininas, promove a adhesión de células endoteliais.[8]
A laminina alfa4 está distribuída en diversos tecidos, como os nervios periféricos, ganglios espiñais, músculo esquelético e capilares; na unión neuromuscular, é necesaria para a especialización sináptica.[9] Predíxose que a estrutura do dominio laminina-G lembra ao da pentraxina.[10]
Patoloxía
[editar | editar a fonte]A estrutura disfuncional que presenta a laminina-211 é a causa dunha forma de distrofia muscular conxénita.[11] A laminina-211 está composta por unha cadea α2, unha cadea β1 e unha cadea γ1. A distribución desta laminina inclúe o cerebro e as fibras musculares. No músculo únese ao alfa-distroglicano e á integrina alfa7—beta1 por medio do dominio G, e polo outro extremo únese á matriz extracelular. A laminina-332 anormal, que é esencial para a adhesión das células epiteliais á membrana basal, orixina a epidermólise ampolosa xuncional, caracterizada pola formación xeneralizada de ampolas na pel, exuberante granulación en pel e mucosa, e dentes picados. A laminina-521 non funcional dos filtros renais causa a perda de proteínas na urina e a síndrome nefrótica.[4]
Lamininas en cultivos celulares
[editar | editar a fonte]Recentemente as lamininas foron utilizadas para cultivos celulares, como os de células nai pluripotentes, que son difíciles de cultivar noutros substratos. Utilizáronse principalmente dous tipos de lamininas. A laminina-111 extraída de sarcoma de rato é unha das máis usadas, e tamén unha mestura das lamininas-511 e 521 de placenta humana.[12] Varias isoformas de lamininas son practicamente imposibles de illar dos tecidos en forma pura debido á gran cantidade de enlaces cruzados con outras e á necesidade utilizar unhas condicións de extracción duras, como o uso de encimas proteolíticos ou pHs baixos, que causan degradación. Con todo, o grupo do profesor Tryggvason no Instituto Karolinska de Suecia conseguiu producir lamininas recombinantes usando células HEK293 en 2000. Kortesmaa et al. 2000. Isto fixo posible comprobar se as lamininas podían ter un papel significativo in vitro igual que o teñen no corpo humano. En 2008, dous grupos independentemente mostraron que as células nai embrionarias de rato poden crecer durante meses sobre a laminina-511 recombinante.[13][14] Posteriormente, Rodin et al. mostraron que a laminina-511 recombinante pode utilizarse para crear un ambiente de cultivo celular definido e totalmente libre de organismos alleos para cultivar células nai humanas embrionarias (hES) pluripotentes e células nai humanas pluripotentes inducidas (iPS).[15]
Papel no desenvolvemento neural
[editar | editar a fonte]A laminina-111 é o principal substrato sobre o que poden crecer os axóns dos nervios, tanto in vivo coma in vitro. Por exemplo, a laminina estende un camiño que seguen as células ganglionares da retina en desenvolvemento para chegaren da retina ao tectum. Tamén se usa a miúdo como substrato en experimentos de cultivo celular. É interesante sinalar que a presenza de laminina-1 pode influír no modo en que o cono de crecemento da neurona responde a outros sinais. Por exemplo, os conos de crecemento son repelidos pola netrina cando crecen sobre laminina-111, pero son atraídos pola netrina cando crece sobre fibronectina. Este efecto da laminina-111 probablemente ten lugar por medio dunha diminución do AMP cíclico intracelular.
Papel no cancro
[editar | editar a fonte]A maioría dos transcritos que presentan un sitio de entrada ao ribosoma interno (IRES) están implicados no desenvolvemento do cancro por medio das correspondentes proteínas. Un evento crucial na progresión dos tumores denominado transición epitelial-mesenquimal (EMT) permite que as células de carcinoma adquiran propiedades invasivas. Informouse recentemente da activación traducional do compoñente da matriz extracelular laminina B1 (LamB1) durante a transición epitelial-mesenquimal, o que suxire un mecanismo mediado polo IRES.[16]
Dominios de laminina
[editar | editar a fonte]| Laminina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Laminin_I | ||||||||
| Pfam | PF06008 | ||||||||
| InterPro | IPR009254 | ||||||||
| |||||||||
| Laminina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Laminin_II | ||||||||
| Pfam | PF06009 | ||||||||
| InterPro | IPR010307 | ||||||||
| |||||||||
| Laminina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Laminin_B | ||||||||
| Pfam | PF00052 | ||||||||
| InterPro | IPR000034 | ||||||||
| |||||||||
| Laminina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura cristalina de tres módulos de tipo factor de crecemento epidérmico (le) de tipo laminina consecutivos da cadea gamma1 de laminina que alberga o sitio de unión ao nidóxeno | |||||||||
| Identificadores | |||||||||
| Símbolo | Laminin_EGF | ||||||||
| Pfam | PF00053 | ||||||||
| Pfam clan | CL0001 | ||||||||
| InterPro | IPR002049 | ||||||||
| PROSITE | PDOC00021 | ||||||||
| SCOPe | 1tle / SUPFAM | ||||||||
| |||||||||
| Laminina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
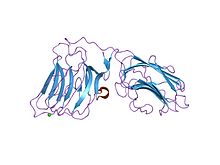 par de dominios lg4-5 da cadea alfa 2 de laminina, sitio mutante ca1 | |||||||||
| Identificadores | |||||||||
| Símbolo | ? | ||||||||
| Pfam | PF00054 | ||||||||
| Pfam clan | CL0004 | ||||||||
| InterPro | IPR012679 | ||||||||
| SCOPe | 1qu0 / SUPFAM | ||||||||
| |||||||||
| Laminina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 a estrutura do dominio de unión ao ligando da neurexina 1beta: a regulación do dominio lns funciona por splicing alternativo | |||||||||
| Identificadores | |||||||||
| Símbolo | Laminin_G_2 | ||||||||
| Pfam | PF02210 | ||||||||
| Pfam clan | CL0004 | ||||||||
| InterPro | IPR012680 | ||||||||
| SMART | TSPN | ||||||||
| |||||||||
| Laminina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Laminin_N | ||||||||
| Pfam | PF00055 | ||||||||
| Pfam clan | CL0202 | ||||||||
| InterPro | IPR008211 | ||||||||
| SMART | LamNT | ||||||||
| SCOPe | 1klo / SUPFAM | ||||||||
| |||||||||
As lamininas conteñen varios dominios proteicos conservados.
Lamininas I e II
[editar | editar a fonte]As lamininas son moléculas triméricas; a laminina-1 é un trímero alfa1 beta1 gamma1. Propúxose que os dominios I e II das lamininas A, B1 e B2 poden unirse para formar unha estrutura secundaria de tripla hélice superenrolada.[17]
Laminina B
[editar | editar a fonte]O dominio B de laminina (tamén chamado dominio IV) é un módulo extracelular de función descoñecida. Encóntrase en varias proteínas diferentes entre as que están a parte proteica do proteoglicano de heparán sulfato da membrana basal, unha proteína de tipo laminina de Caenorhabditis elegans e a laminina. O dominio IV de laminina non se encontra nas cadeas de laminina curtas (alfa4 ou beta3).
Laminina de tipo EGF
[editar | editar a fonte]Ademais de distintos tipos de dominios globulares todas as subunidades de laminina conteñen, na súa primeira metade, repeticións en tándem de aproximadamente 60 aminoácidos de lonxitude, que inclúen oito cisteínas conservadas.[18] A estrutura terciaria deste dominio é remotamente similar no seu extremo N-terminal á do módulo de tipo EGF.[19][20] Tamén se coñece como "LE" ou dominio "de tipo EGF de tipo laminina". O número de copias do dominio de tipo EGF de laminina nas diferentes formas de laminina é moi variable; atopáronse de 3 a 22 copias. Na cadea gamma-1 de laminina do rato, o sétimo dominio LE é o único que se une con alta afinidade ao nidóxeno.[21] Os sitios de unión están localizados na superficie nos bucles C1-C3 e C5-C6.[19][20] Nas lamininas, longas formacións consecutivas de dominios de tipo EGF forman elementos de tipo bastonciño de flexibilidade limitada, que determinan o espazado na formación das redes de laminina da membrana basal.[22][23]
Laminina G
[editar | editar a fonte]O dominio da laminina globular (G) pode encontrarse nunha ou varias copias en varios membros da familia das lamininas, entre os que están un gran número de proteínas extracelulares. A parte C-terminal da cadea de laminina alfa contén unha repetición en tándem de cinco dominios de laminina G, que son esenciais para a unión de heparina e a adhesión celular.[24] A laminina alfa4 está distribuída en varios tecidos como os nervios periféricos, raíces dos ganglios dorsais, músculo esquelético e capilares; na unión neuromuscular cómpre esta laminina para a especialización sináptica.[9] Prediciuse que a estrutura secundaria do dominio G de laminina lembra á da pentraxina.[10]
Os dominios G de laminina poden variar na súa función, e adscribíronse diversas funcións de unión a diferentes módulos LamG. Por exemplo, as cadeas de laminina alfa1 e alfa2 teñen cada unha cinco dominios G de laminina C-terminais, dos que só os dominios LG4 e LG5 conteñen sitios de unión para a heparina, sulfátidos e o receptor da superficie celular distroglicano.[24] As proteínas que conteñen dominios G de laminina parecen ter unha ampla variedade de funcións na adhesión celular, sinalización celular, migración celular, ensamblaxe e diferenciación celular.
N-terminal de laminina
[editar | editar a fonte]A ensamblaxe da membrana basal é un proceso cooperativo no cal as lamininas se polimerizan polos seus dominios N-terminais (LN ou dominio VI) e ancóranse á superficie celular a través dos seus doominios G. As netrinas poden tamén asociarse con esta rede por medio de interaccións do dominio LN heterotípicas.[23] Isto orixina unha sinalización celular a través de integrinas e o distroglicano (e posiblemente outros receptores) recrutados na laminina adherente. Esta autoensamblaxe dependente do dominio LN considérase esencial para a integridade das membranas basais, como se ve nas formas hereditarias de distrofia muscular que conteñen a deleción do módulo LN da cadea alfa 2 de laminina.[25] O dominio N-terminal de laminina encóntrase en todas as subunidades de lamininas e da netrina agás nas cadeas de laminina alfa 3A, alfa 4 e gamma 2.
Proteínas humanas que conteñen dominios de laminina
[editar | editar a fonte]Dominio de laminina I
[editar | editar a fonte]LAMA1; LAMA2; LAMA3; LAMA4; LAMA5;
Dominio de laminina II
[editar | editar a fonte]LAMA1; LAMA2; LAMA3; LAMA4; LAMA5;
Laminina B (Dominio IV)
[editar | editar a fonte]HSPG2; LAMA1; LAMA2; LAMA3; LAMA5; LAMC1; LAMC2; LAMC3;
Laminina de tipo EGF (Dominios III e V)
[editar | editar a fonte]AGRIN; ATRN; ATRNL1; CELSR1; CELSR2; CELSR3; CRELD1; HSPG2; LAMA1; LAMA2; LAMA3; LAMA4; LAMA5; LAMB1; LAMB2; LAMB3; LAMB4; LAMC1; LAMC2; LAMC3; MEGF10; MEGF12; MEGF6; MEGF8; MEGF9; NSR1; NTN1; NTN2L; NTN4; NTNG1; NTNG2; RESDA1; SCARF1; SCARF2; SREC; STAB1; USH2A;
Dominio G de laminina
[editar | editar a fonte]AGRIN; CASPR4; CELSR1; CELSR2; CELSR3; CNTNAP1; CNTNAP2; CNTNAP3; CNTNAP4; CNTNAP5; COL11A1; COL11A2; COL24A1; COL5A1; COL5A3; CRB1; CRB2; CSPG4; EGFLAM; FAT; FAT2; FAT4; GAS6; HSPG2; LAMA1; LAMA2; LAMA3; LAMA4; LAMA5; NELL2; NRXN1; NRXN2; NRXN3; PROS1; RESDA1; SLIT1; SLIT2; SLIT3; USH2A;
N-terminal de laminina (Dominio VI)
[editar | editar a fonte]LAMA1; LAMA2; LAMA3; LAMA5; LAMB1; LAMB2; LAMB3; LAMB4; LAMC1; LAMC3; NTN1; NTN2L; NTN4; NTNG1; NTNG2; USH2A;
Notas
[editar | editar a fonte]- ↑ Timpl R; et al. (1979). "Laminin – a glycoprotein from basement membranes". J Biol Chem 254 (19): 9933–7. PMID 114518.
- ↑ 2,0 2,1 Aumailley M; et al. (2005). "A simplified laminin nomenclature". Matrix Biol. 24 (5): 326–32. PMID 15979864. doi:10.1016/j.matbio.2005.05.006.
- ↑ 3,0 3,1 3,2 3,3 M. A. Haralson and John R. Hassell (1995). Extracellular matrix: a practical approach. Ithaca, N.Y: IRL Press. ISBN 0-19-963220-0.
- ↑ 4,0 4,1 Yurchenko P and Batton BL (2009). "Developmental and Pathogenic Mechanisms of Basement Membrane Assembly". Curr Pharm Des. 15 (12): 1277–94. PMC 2978668. PMID 19355968. doi:10.2174/138161209787846766.
- ↑ 5,0 5,1 Colognato H, Yurchenco P (2000). "Form and function: the laminin family of heterotrimers". Dev. Dyn. 218 (2): 213–34. PMID 10842354. doi:10.1002/(SICI)1097-0177(200006)218:2<213::AID-DVDY1>3.0.CO;2-R.
- ↑ Smith J, Ockleford CD (1994). "Laser scanning confocal examination and comparison of nidogen (entactin) with laminin in term human amniochorion". Placenta 15 (1): 95–106. PMID 8208674. doi:10.1016/S0143-4004(05)80240-1.
- ↑ Ockleford CD, Bright N, Hubbard A, D'Lacey C , Smith J, Gardiner L, Sheikh T, Albentosa, M, Turtle K (1993). "Micro-Trabeculae, Macro-Plaques or Mini-Basement Membranes in Human Term Fetal Membranes?". Phil. Trans. R. Soc. Lond. B 342 (1300): 121–136. doi:10.1098/rstb.1993.0142.
- ↑ Beck et al., 1999.
- ↑ 9,0 9,1 Ichikawa N, Kasai S, Suzuki N, Nishi N, Oishi S, Fujii N, Kadoya Y, Hatori K, Mizuno Y, Nomizu M, Arikawa-Hirasawa E (April 2005). "Identification of neurite outgrowth active sites on the laminin alpha4 chain G domain". Biochemistry 44 (15): 5755–62. PMID 15823034. doi:10.1021/bi0476228.
- ↑ 10,0 10,1 Beckmann G, Hanke J, Bork P, Reich JG (February 1998). "Merging extracellular domains: fold prediction for laminin G-like and amino-terminal thrombospondin-like modules based on homology to pentraxins". J. Mol. Biol. 275 (5): 725–30. PMID 9480764. doi:10.1006/jmbi.1997.1510.
- ↑ Hall, T. E.; Bryson-Richardson, RJ; et al. (2007). "The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy". PNAS 104 (17): 7092–7097. PMC 1855385. PMID 17438294. doi:10.1073/pnas.0700942104.
- ↑ Wewer; et al. (1983). "Human laminin isolated in a nearly intact, biologically active form from placenta by limited proteolysis". J Biol Chem. 258 (20): 12654–60. PMID 6415055.
- ↑ Domogatskaya; et al. (2008). "Laminin-511 but not -332, -111, or -411 enables mouse embryonic stem cell self-renewal in vitro". Stem Cells 26 (11): 2800–9. PMID 18757303. doi:10.1634/stemcells.2007-0389.
- ↑ Miyakzaki; et al. (2008). "Recombinant human laminin isoforms can support the undifferentiated growth of human embryonic stem cells". Biochem. Biophys. Res. Commun. 375 (1): 27–32. PMID 18675790. doi:10.1016/j.bbrc.2008.07.111.
- ↑ http://www.nature.com/nbt/journal/v28/n6/full/nbt.1620.html
- ↑ Petz M, Them N, Huber H, Beug H, Mikulits W. (2011). "La enhances IRES-mediated translation of laminin B1 during malignant epithelial to mesenchymal transition.". Nucleic Acids Rsearch 39 (18): 01–13. PMC 3245933. PMID 21896617. doi:10.1093/nar/gkr717.
- ↑ Sasaki M, Kleinman HK, Huber H, Deutzmann R, Yamada Y (1988). "Laminin, a multidomain protein. The A chain has a unique globular domain and homology with the basement membrane proteoglycan and the laminin B chains". J. Biol. Chem. 263 (32): 16536–44. PMID 3182802.
- ↑ Engel J (1989). "EGF-like domains in extracellular matrix proteins: localized signals for growth and differentiation?". FEBS Lett. 251 (1-2): 1–7. PMID 2666164. doi:10.1016/0014-5793(89)81417-6.
- ↑ 19,0 19,1 Stetefeld J, Mayer U, Timpl R, Huber R (1996). "Crystal structure of three consecutive laminin-type epidermal growth factor-like (LE) modules of laminin gamma1 chain harboring the nidogen binding site". J. Mol. Biol. 257 (3): 644–57. PMID 8648630. doi:10.1006/jmbi.1996.0191.
- ↑ 20,0 20,1 Baumgartner R, Czisch M, Mayer U, Poschl E, Huber R, Timpl R, Holak TA (1996). "Structure of the nidogen binding LE module of the laminin gamma1 chain in solution". J. Mol. Biol. 257 (3): 658–68. PMID 8648631. doi:10.1006/jmbi.1996.0192.
- ↑ Mayer U, Poschl E, Gerecke DR, Wagman DW, Burgeson RE, Timpl R (1995). "Low nidogen affinity of laminin-5 can be attributed to two serine residues in EGF-like motif gamma 2III4". FEBS Lett. 365 (2-3): 129–32. PMID 7781764. doi:10.1016/0014-5793(95)00438-F.
- ↑ Beck K, Hunter I, Engel J (1990). "Structure and function of laminin: anatomy of a multidomain glycoprotein". FASEB J. 4 (2): 148–60. PMID 2404817.
- ↑ 23,0 23,1 Yurchenco PD, Cheng YS (1993). "Self-assembly and calcium-binding sites in laminin. A three-arm interaction model". J. Biol. Chem. 268 (23): 17286–99. PMID 8349613.
- ↑ 24,0 24,1 Tisi D, Talts JF, Timpl R, Hohenester E (2000). "Structure of the C-terminal laminin G-like domain pair of the laminin alpha2 chain harbouring binding sites for alpha-dystroglycan and heparin". EMBO J. 19 (7): 1432–40. PMC 310212. PMID 10747011. doi:10.1093/emboj/19.7.1432.
- ↑ Xu H, Wu XR, Wewer UM, Engvall E (1994). "Murine muscular dystrophy caused by a mutation in the laminin alpha 2 (Lama2) gene". Nat. Genet. 8 (3): 297–302. PMID 7874173. doi:10.1038/ng1194-297.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- A proteína laminina
- Precursores das lamininas como suplementos nutricionais[Ligazón morta]
- BioLamina - Expertos en lamininas
- Laminin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
