Ácido aminolevulínico sintase
| 5-aminolevulinato sintase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
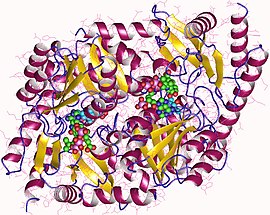
| Dímero de ácido aminolevulínico sintase de Rhodobacter capsulatus | |||||||||
| Identificadores | |||||||||
| Número EC | 2.3.1.37 | ||||||||
| Número CAS | 9037-14-3 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| |||||||||
A ácido minolevulínico sintase (ALA sintase, ALAS, ácido delta-aminolevulínico sintase ou 5-aminolevulinato sintase) é un encima (EC 2.3.1.37) que cataliza a síntese do ácido δ-aminolevulínico (ALA), o primeiro precursor común na biosíntese de todos os tetrapirrois, como os hemos, cobalaminas e clorofilas.[1] A reacción que cataliza é a seguinte:
Este encima exprésase en todos os eucariotas (excepto en plantas) e nas alfaproteobacterias e a reacción que cataliza denomínase ás veces vía de Shemin para a formación do ALA.[2] Outros organismos producen ALA por medio dunha vía de tres encimas coñecida como a vía C5. O ALA sintetízase pola condensación da glicina e o succinil-CoA. En humanos, a produción de ALA sintase está estreitamente controlada pola presenza de elementos de resposta ao Fe2+, para impedir a acumulación de intermediarios da porfirina en ausencia de ferro. Hai dúas formas de ALA sintase no corpo. Unha forma exprésase nas células precursoras dos glóbulos vermellos e denomínase ALAS2, mentres que outra, chamada ALAS1, exprésase ubicuamente por todo o corpo. A forma do glóbulo vermello está codificada por un xene no cromosoma X, mentres que a outra está codificada no cromosoma 3.
A enfermidade anemia sideroblástica ligada ao X está causada por mutacións no xene da ALA sintase no cromosoma X, mentres que non se coñecen enfermidades causadas por mutacións no outro xene. Tamén se atoparon recentemente mutacións de ganancia de función no xene da ALA sintase específica do tecido eritroide que causan unha forma antes descoñecida de porfiria chamada protoporfiria dominante ligada ao X.
Estrutura do encima e propiedades[editar | editar a fonte]
Os encimas dependentes do cofactor PLP son comúns porque son necesarios para transformar aminoácidos noutras moléculas.[1] ALAS é un homodímero con subunidades de similar tamaño e os sitios activos constan de cadeas laterais de aminoácidos como a arxinina, treonina e lisina que se encontran na interface da subunidade.[1] A proteína que se extrae da bacteria Rhodobacter sphaeroides pesa uns 80.000 daltons.[3] A actividade encimática varía segundo as diferentes fontes do encima.[3]
Mecanismo de reacción[editar | editar a fonte]
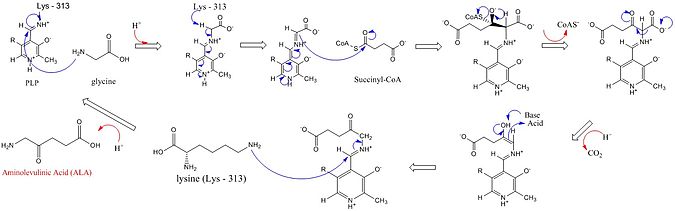
Os sitios activos da ALAS utilizan tres cadeas laterais de aminoácidos clave: Arg-85, Thr-430 e Lys-313. Aínda que estes tres aminoácidos foron identificados como os que permiten que avance esta reacción, estarían inactivos sen a adición do cofactor piridoxal 5’-fosfato (PLP), cuxo papel nesta síntese detállase na imaxe de abaixo. Antes de que poida empezar a reacción, o cofactor PLP únese á cadea lateral da lisina para formar unha base de Schiff que promove o ataque do substrato glicina.[4][5][6][7] A lisina actúa como unha base xeral durante este mecanismo.[1][8] No mecanismo de reacción detllado, os átomos de hidronio que son engadidos proceden dunha variedade de residuos que ofrecen enlaces de hidróxeno para facilitar a síntese de ácido aminolevulínico.[1] A ALA sintase quita o grupo carboxilo da glicina e o CoA do succinil-CoA por medio do seu grupo prostético piridoxal fosfato (PLP, un derivado da vitamina B6), formando ácido δ-aminolevulínico, así chamado porque o grupo amino está no cuarto carbono (delta) da molécula. Este mecanismo de reacción é especialmente único en relación con outros encimas que usan o cofactor PLP porque a glicina é inicialmente desprotonada por unha lisina do sitio activo altamente conservado, que causa a condensación co succinil-CoA e a perda de CoA. A protonación do grupo carbonilo do intermediario por unha histidina do sitio activo orixina a perda do grupo carboxilo. O último intermediario é finalmente reprotonado para producir ácido aminolevulínico. A disociación do ácido aminolevulínico do encima é o paso limitante da reacción encimática e depende dun cambio conformacional lento do encima. A función do fosfato de piridoxal é facilitar a eliminación do hidróxeno utilizando o anel piridinio electrofílico como un sumidoiro de electróns.
A localización deste encima en sistemas biolóxicos é indicativa da retroalimentación que pode recibir. A ALA sintase atopouse en bacterias, lévedos e fígado, glóbulos vermellos e medula ósea de mamíferos. A localización deste encima en células animais é a mitocondria.[3] Como o encima parece localizarse preto da súa fonte de succinil-CoA e o final da vía do hemo, isto indica que o puntos de inicio e final da biosíntese do hemo serven como retroalimentación para a ALA sintase.[3] A ALA sintase é tamén inhibida pola hemina e a glicosa.[9]

Función biolóxica[editar | editar a fonte]
ALAS1 e ALAS2 catalizan o primeiro paso do proceso de síntese do hemo. É o primeiro paso irreversible e é tamén un paso limitante. Isto significa que o principio da formación dos hemos é moi intencional e está suxeito a diversas áreas de retroalimentación. Por exemplo, os dous substratos, oxaloacetato e glicina, son producidos en altas cantidades e utilizados noutros procesos biolóxicos esenciais, comoa glicólise e o ciclo do ácido tricarboxílico. A imaxe de abaixo ilustra a vía de síntese do hemo e o papel que xoga o ALAS.

Importancia da enfermidade[editar | editar a fonte]
A deficiencia de ácido aminolevulínico sintase ten como resultado a incapacidade de crear grupos hemo, xa que o seu papel é catalizar o primeiro paso deste proceso. Estas deficiencias adoitan ser o resultado dunha mutación xenética que pode causar diversas doenzas. Unha desas doenzas é a anemia sideroblástica ligada ao X que orixina a aparición de glóbulos vermellos na medula ósea.[10] Esta doenza está ligada especificamente con mutacións nos xenes que codifican a ALAS2.[10]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 1,3 1,4 Hunter, Gregory A.; Ferreira, Gloria C. (November 2011). "Molecular enzymology of 5-Aminolevulinate synthase, the gatekeeper of heme biosynthesis". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1814 (11): 1467–1473. PMC 3090494. PMID 21215825. doi:10.1016/j.bbapap.2010.12.015.
- ↑ Shemin, David; Rittenberg, D (18 de xuño de 1945). "The utilization of glycine for the synthesis of a porphyrin". Journal of Biological Chemistry 159: 567–568.
- ↑ 3,0 3,1 3,2 3,3 Beale, S I (June 1978). "δ-Aminolevulinic Acid in Plants: Its Biosynthesis, Regulation, and Role in Plastid Development". Annual Review of Plant Physiology 29 (1): 95–120. doi:10.1146/annurev.pp.29.060178.000523.
- ↑ "ALA synthase". flipper e nuvola. Turin University. Consultado o 10 de marzo de 2016.
- ↑ Shoolingin-Jordan, Peter M.; Al-Daihan, Sooad; Alexeev, Dmitriy; Baxter, Robert L.; Bottomley, Sylvia S.; Kahari, I.Donald; Roy, Ipsita; Sarwar, Muhammad; Sawyer, Lindsay; Wang, Shu-Fen (Apr 2003). "5-Aminolevulinic acid synthase: mechanism, mutations and medicine.". Biochim Biophys Acta 1647 (1–2): 361–6. PMID 12686158. doi:10.1016/s1570-9639(03)00095-5.
- ↑ CHOI, H (July 2004). "Cloning, expression, and characterization of 5-aminolevulinic acid synthase from Rhodopseudomonas palustris KUGB306". FEMS Microbiology Letters 236 (2): 175–181. PMID 15251194. doi:10.1016/j.femsle.2004.05.048.
- ↑ Ferreira, Gloria C.; Neame, Peter J.; Dailey, Harry A. (November 1993). "Heme biosynthesis in mammalian systems: Evidence of a schiff base linkage between the pyridoxal 5′-phosphate cofactor and a lysine residue in 5-aminolevulinate synthase". Protein Science 2 (11): 1959–1965. PMC 2142290. PMID 8268805. doi:10.1002/pro.5560021117.
- ↑ Hunter, Gregory A.; Ferreira, Gloria C. (marzo de 1999). "Lysine-313 of 5-Aminolevulinate Synthase Acts as a General Base during Formation of the Quinonoid Reaction Intermediates". Biochemistry 38 (12): 3711–3718. PMID 10090759. doi:10.1021/bi982390w.
- ↑ Doss M, Sixel-Dietrich F, Verspohl F (1985). ""Glucose effect" and rate limiting function of uroporphyrinogen synthase on porphyrin metabolism in hepatocyte culture: relationship with human acute hepatic porphyrias." (PDF). J Clin Chem Clin Biochem 23 (9): 505–13. PMID 4067519. doi:10.1515/cclm.1985.23.9.505.
- ↑ 10,0 10,1 Ajioka, Richard S.; Phillips, John D.; Kushner, James P. (xullo de 2006). "Biosynthesis of heme in mammals". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research 1763 (7): 723–736. PMID 16839620. doi:10.1016/j.bbamcr.2006.05.005.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- NIH
- Abu-Farha M, Niles J, Willmore W (2005). "Erythroid-specific 5-aminolevulinate synthase protein is stabilized by low oxygen and proteasomal inhibition". Biochem Cell Biol 83 (5): 620–30. PMID 16234850. doi:10.1139/o05-045.
- Shemin, D; Rittenberg, D (1945). "The Utilization of Glycine for the Synthesis of a Porphyrin". J. Biol. Chem. 159: 567–8.
- Anemia sideroblástica, enfermidade do defecto no ALAS2