Punto triplo
En física, o punto triplo é a temperatura e presión na que coexisten en equilibrio termodinámico o estado sólido, gasoso e líquido nunha substancia. Defínese cunha temperatura e unha presión de vapor.
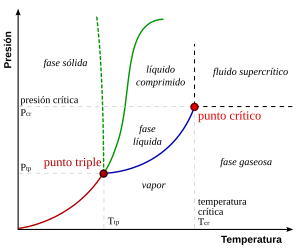
O punto triplo da auga, por exemplo, está a 273,16 K (0,01 °C) e a unha presión de 611,73 Pa ITS90. Esta temperatura, debido a que é un valor constante, serve para calibrar as escalas Kelvin e Celsius dos termómetros de gran precisión.
Punto triplo da auga[editar | editar a fonte]
A única combinación de presión e temperatura á que a auga en estado líquido, sólido e gasoso poden coexistir nun equilibrio estable prodúcese exactamente a unha temperatura de 273,1598 K (0,0098 °C) e a unha presión parcial de vapor de auga de 611,73 pascais (6,1173 milibares; 0,0060373057 atm). Nesas condicións, é posible cambiar o estado de toda a masa de auga a xeo, auga líquida ou vapor arbitrariamente facendo pequenos cambios na presión e na temperatura. Débese ter en conta que incluso se a presión total dun sistema está moi por riba de 611,73 pascais (é dicir, un sistema cunha presión atmosférica normal), se a presión parcial do vapor de auga é de 611,73 pascais, entón o sistema pode encontrarse aínda no punto triplo da auga . Estritamente falando, as superficies que separan as distintas fases tamén debe ser perfectamente planas, para evitar os efectos das tensións de superficie.
A auga ten un infrecuente e complexo diagrama de fase (aínda que isto non afecta as consideracións xerais expostas sobre o punto triplo). A altas temperaturas, incrementando a presión, primeiro obtense auga líquida e, a continuación, auga sólida. Por encima de 109 Pa aproximadamente obtense unha forma cristalina de xeo que é máis denso que a auga líquida. A temperaturas máis baixas en virtude da compresión, o estado líquido deixa de aparecer e a auga pasa directamente de sólido a gas.
A presións constantes por arriba do punto triplo, quentar xeo fai que se pase de sólido a líquido e deste a gas (ou vapor). A presións por abaixo do punto triplo, como as que se encontran no espazo exterior, onde a presión é próxima a cero, a auga líquida non pode existir e, ao quecer, o xeo convértese directamente en vapor de auga sen pasar polo estado líquido, proceso coñecido como sublimación.
A presión do punto triplo da auga foi utilizada durante a misión Mariner 9 a Marte como un punto de referencia para definir "o nivel do mar". Misións máis recentes fan uso de altimetría láser e gravimetría en lugar da presión atmosférica para medir a elevación en Marte.
Táboa de puntos triplos[editar | editar a fonte]
Nesta táboa inclúense os puntos triplos dalgunhas substancias comúns. Estes datos están baseados nos proporcionados pola National Bureau of Standards (agora NIST) dos Estados Unidos de América.[1]
| Substancia | T (K) | P (kPa) |
|---|---|---|
| Acetileno | 192,4 | 120 |
| Amoníaco | 195,40 | 6,076 |
| Argon | 83,81 | 68,9 |
| Grafito | 3900 | 10100 |
| Dióxido de carbono | 216,55 | 517 |
| Monóxido de carbono | 68,10 | 15,37 |
| Deuterio | 18,63 | 17,1 |
| Etano | 89,89 | 8 × 10−4 |
| Etileno | 104,0 | 0,12 |
| Helio-4 | 2,19 | 5,1 |
| Hidróxeno | 13,84 | 7,04 |
| Cloruro de hidróxeno | 158,96 | 13,9 |
| Mercurio | 234,2 | 1,65 × 10−7 |
| Metano | 90,68 | 11,7 |
| Neon | 24,57 | 43,2 |
| Óxido nítrico | 109,50 | 21,92 |
| Nitróxeno | 63,18 | 12,6 |
| Óxido nitroso | 182,34 | 87,85 |
| osíxeno | 54,36 | 0,152 |
| Paladio | 1825 | 3,5 × 10−3 |
| Platino | 2045 | 2,0 × 10−4 |
| Dióxido de xofre | 197,69 | 1,67 |
| Titanio | 1941 | 5,3 × 10−3 |
| Hexafluoruro de uranio | 337,17 | 151,7 |
| Auga | 273,16 | 0,61 |
| Xenon | 161,3 | 81,5 |
| Zinc | 692,65 | 0,065 |
Notas[editar | editar a fonte]
- ↑ Yunus A. Cengel, Robert H. Turner. Fundamentals of thermal-fluid sciences. McGraw-Hill, 2004, p. 78. ISBN 0-07-297675-6
