Fitoquelatina
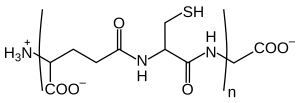
As fitoquelatinas son oligómeros do glutatión, producidos polo encima fitoquelatina sintase. Encóntranse en plantas, fungos, vermes nematodos e todos os grupos de algas incluíndo as procariotas cianobacterias. As fitoquelatinas actúan como queladores, e son importantes para a detoxificación de metais pesados.[1][2][3] Abrévianse como PC seguido dun número, desde PC2 a PC11.
Un mutante da planta Arabidopsis thaliana que careza de fitoquelatina sintase é moi sensible ao cadmio, pero crece como unha planta de tipo silvestre a concentracións normais de cinc e cobre, dous ións metálicos esenciais, o que indica que a fitoquelatina só está implicada na resistencia ao envelenamento por metais.[4]
Como a fitoquelatina sintase usa o glutatión cun grupo tiol bloqueado durante a síntese de fitoquelatina, a presenza de ións de metais pesados que se unen ao glutatión causa que o encima funcione máis rápido. Por tanto, a cantidade de fitoquelatina increméntase cando a célula necesita máis fitoquelatina para sobrevivir nun ambiente con altas concentracións de ións metálicos.[5]
A fitoquelatina únese a ións de chumbo (Pb), o que secuestra os ións Pb en plantas e así serve como un importante compoñente dos mecanismos de detoxificación en plantas.[6] A fitoquelatina parece que se transporta a un vacúolo da planta para que os ións metálicos que leva se almacenen con seguridade lonxe das proteínas do citosol.[4]
Péptidos relacionados[editar | editar a fonte]
Hai outros grupos de péptidos con estrutura similar á das fitoquelatinas, pero nos que o último aminoácido non é glicina:[4][7]
| Tipo | Estrutura | Atopado en | Precursor |
|---|---|---|---|
| Fitoquelatina | (γGlu-Cys)n-Gly | moitos organismos | Glutatión |
| Homofitoquelatina | (γGlu-Cys)n-Ala | legumes | Homoglutatión |
| Desglicina fitoquelatina | (γGlu-Cys)n | millo, lévedos | |
| Hidroximetil-fitoquelatina | (γGlu-Cys)n-Ser | gramíneas | Hidroximetilglutatión |
| iso-Fitoquelatina (Glu) | (γGlu-Cys)n-Glu | millo | Glutamilcisteinilglutamato |
| iso-Fitoquelatina (Gln) | (γGlu-Cys)n-Gln | ravo picante |
Historia[editar | editar a fonte]
A fitoquelatina foi descuberta en 1981 en lévedos de fisión,[8][9] e recibiu o nome de cadistina.[10] Despois atopouse en plantas superiores en 1985 e denominouse fitoquelatina. En 1989 descubriuse o encima biosintético fitoquelatina sintase.[7]
Notas[editar | editar a fonte]
- ↑ Suk-Bong Ha; Aaron P. Smith; Ross Howden; Wendy M. Dietrich; Sarah Bugg; Matthew J. O'Connell; Peter B. Goldsbrough; Christopher S. Cobbett (1999). "Phytochelatin Synthase Genes from Arabidopsis and the Yeast Schizosaccharomyces pombe". Plant Cell 11 (6): 1153–1164. PMC 144235. PMID 10368185. doi:10.1105/tpc.11.6.1153. Consultado o 2014-01-13.
- ↑ Olena K. Vatamaniuk; Elizabeth A. Bucher; James T. Ward; Philip A. Rea (2001). "A new pathway for heavy metal detoxification in animals: phytochelatin synthase is required for cadmium tolerance in Caenorhabditis elegans". J. Biol. Chem. 276 (24): 20817–20. PMID 11313333. doi:10.1074/jbc.C100152200.
- ↑ InterPro database page on phytochelatin synthase[Ligazón morta]
- ↑ 4,0 4,1 4,2 Buchanan; Gruissem; Jones (2000). Biochemistry & molecular biology of plants (1st ed.). American Society of Plant Physiology.
- ↑ O. K. Vatamaniuk; S. Mari; Y. Lu; P. A. Rea (2000). "Mechanism of Heavy Metal Ion Activation of Phytochelatin (PC) Synthase". J. Biol. Chem. 275 (40): 31451–31459. PMID 10807919. doi:10.1074/jbc.M002997200.
- ↑ Dharmendra K. Gupta; Huanggang Huang; Francisco J Corpas (2013). "Lead tolerance in plants: Strategies for Phytoremediation". Environmental Science and Pollution Research International 20: 1–2. PMID 23338995. doi:10.1007/s11356-013-1485-4.
- ↑ 7,0 7,1 Masahiro Inouhe (2005). "Phytochelatins". Brazilian Journal of Plant Physiology 17: 65–78. doi:10.1590/S1677-04202005000100006.
- ↑ Murasugi, Akira; Wada, Chiaki; Hayashi, Yukimasa (1981). "Cadmium-Binding Peptide Induced in Fission Yeast, Schizosaccharomyces pombe". J. Biochem. 90 (5): 1561–1564. PMID 7338524. doi:10.1093/oxfordjournals.jbchem.a133627.
- ↑ Murasugi, Akira; Wada, Chiaki; Hayashi, Yukimasa (1981). "Purification and Unique Properties in UV and CD Spectra of Cd-Binding Peptide 1 from Schizosaccharomyces pombe".". Biochem. Biophys. Res. Commun. 103 (3): 1021–1028. PMID 7332570. doi:10.1016/0006-291X(81)90911-6.
- ↑ Kondo, Naoto; Imai, Kunio; Isobe, Minoru; Goto, Toshio; Murasugi, Akira; Wada-Nakagawa, Chiaki; Hayashi, Yukimasa (1984). "Cadystin A and B, Major Unit Peptides Comprising Cadmium Binding Peptides Induced in a Fission Yeast----Separation, Revision of Structures and Synthesis". Tetrahedron Lett. 25 (35): 3869–3872. doi:10.1016/S0040-4039(01)91190-6.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Farkas, Etelka; Buglyó, Péter (2017). "Chapter 8. Lead(II) Complexes of Amino Acids, Peptides, and Other Related Ligands of Biological Interest". En Astrid, S.; Helmut, S.; Sigel, R. K. O. Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences 17. de Gruyter. pp. 201–240. PMID 28731301. doi:10.1515/9783110434330-008. pp. 228–230
