Dímero

Un dímero é unha entidade química que consta de dúas moléculas (unidades monómeras) estruturalmente similares unidas entre si por enlaces fortes ou febles, covalentes ou intermoleculares. Ás veces as dúas moléculas son idénticas (homodímero) e outras son distintas (heterodímero). A unión das dúas moléculas para formar o dímero denomínase dimerización[1], e o inverso da dimerización xeralmente se chama disociación. Analogamente, fálase de heterodimerización e homodimerización.
En bioquímica
[editar | editar a fonte]
En bioquímica, un dímero é un complexo macromolecular formado por dúas moléculas, xeralmente proteínas ou ácidos nucleicos, normalmente unidos de forma non covalente. As clorofilas do centro de reacción dos fotosistemas forman tamén un dímero.
Proteínas dímeras
[editar | editar a fonte]Nas proteínas os dímeros son un tipo de estrutura cuaternaria. Os homodímeros están formados por dúas moléculas idénticas; un exemplo é a ciclooxixenase (COX). Os heterodímeros están formados por dúas moléculas diferentes; un exemplo é a tubulina, formada por monómeros de alfa e beta tubulina.
A maioría dos dímeros en bioquímica non están conectados por enlaces covalentes. Un exemplo de heterodímero unido de forma non covalente é o encima transcriptase inversa, que está composto por dúas cadeas polipeptídicas diferentes.[2] Os dímeros unidos covalentemente (por pontes disulfuro) son máis raros; un exemplo é a proteína homodímera NEMO.[3]
Algunhas proteínas conteñen dominios especializados que facilitan a dimerización, chamados dominios de dimerización. Un estudo atopou que as interfaces polas que se unen os homodímeros e heterodímeros son algo diferentes. Nos homodímeros hai en total máis residuos de aminoácidos e pontes de hidróxeno, aínda que a densidade de pontes de hidróxeno por residuo é maior nos heterodímeros. Nas interfaces de heterodímeros hai máis residuos cargados e hidrofílicos e nos homodímeros predominan os hidrofóbicos.[4]
A dimerización ou a disociación poden facer cambiar o estado funcional da proteína de activo a inactivo ou viceversa. Por exemplo a glicóxeno fosforilase existe como monómero inactivo e só se activa cando se dimeriza.[5]
Dímeros de pirimidinas
[editar | editar a fonte]Os dímeros de pirimidinas fórmanse por reacción fotoquímica a partir de bases nitroxenadas pirimidínicas do ADN. Esta reacción causa mutacións no ADN, que poden ser carcinóxenas e orixinar cancro de pel.
En química
[editar | editar a fonte]Dímeros non covalentes
[editar | editar a fonte]Os ácidos carboxílicos forman dímeros por formación de pontes de hidróxeno entre o hidróxeno ácido e o oxíxeno carbonílico en condicións anhidro. Por exemplo, o ácido acético forma un dímero en fase de gas, no que as unidades monómeras se unen por pontes de hidróxeno. En condicións especiais, a maioría das moléculas que conteñen grupos OH forman dímeros (por exemplo o dímero de auga).
O borano ("BH3") aparece como o dímero diborano (B2H6), debido á alta acidez de Lewis do centro de boro.
Os excímeros e exciplexos son estruturas excitadas de curta duración. Por exemplo, os gases nobres non forman dímeros estables, pero forman os excímeros Ar2*, Kr2* e Xe2* en condicións de altas presións e estimulación eléctrica.
Dímeros covalentes
[editar | editar a fonte]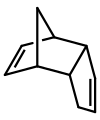
Os dímeros moleculares fórmanse a miúdo pola reacción de dous compostos idénticos, como por exemplo: 2A → A-A. Neste exemplo, o monómero "A" dise que se dimeriza para dar o dímero "A-A". Un exemplo real son os diaminocarbenos, que se dimerizan dando un tetraaminoetileno:
- 2 C(NR2)2 → (R2N)2C=C(NR2)2
Os carbenos son moi reactivos e forman enlaces doadamente.
O diciclopentadieno é un dímero asimétrico de dúas moléculas de ciclopentadieno que reaccionaron pola reacción de Diels-Alder para dar o produto. Sometido a calor sofre a reacción inversa (retro-Diels-Alder) para dar os dous monómeros iguais:
- C10H12 → 2 C5H6
Moitos elementos non metálicos aparecen como moléculas diatómicas e ás veces fálase delas denominándoas dímeros: hidróxeno, nitróxeno, oxíxeno, os halóxenos (flúor, cloro, bromo e iodo). O mercurio parece como mercurio(I) catión (Hg2+), formalmente un heterodímero.
Química de polímeros
[editar | editar a fonte]No contexto da química de polímeros, "dímero" tamén se refire ao grao de polimerización 2, en relación coa estequiometría das reaccións de condensación. Un exemplo serían os disacáridos, formados por dous monosacáridos. Por exemplo, a celobiosa é un dímero de glicosa, aínda que na reacción se produce auga:
- 2C6H12O6 → C12H22O11 + H2O
Aquí, o dímero ten unha estequiometría diferente á do par de monómeros.
Notas
[editar | editar a fonte]- ↑ "IUPAC "Gold Book" definition". Consultado o 2009-04-30.
- ↑ Sluis-Cremer N, Hamamouch N, San Félix A, Velazquez S, Balzarini J, Camarasa MJ (2006). "Structure-activity relationships of [2',5'-bis-O-(tert-butyldimethylsilyl)-beta-D-ribofuranosyl]- 3'-spiro-5' '-(4' '-amino-1' ',2' '-oxathiole-2' ',2' '-dioxide)thymine derivatives as inhibitors of HIV-1 reverse transcriptase dimerization". J. Med. Chem. 49 (16): 4834–41. PMID 16884295. doi:10.1021/jm0604575.
- ↑ Herscovitch M, Comb W, Ennis T, Coleman K, Yong S, Armstead B, Kalaitzidis D, Chandani S, Gilmore TD (2008). "Intermolecular disulfide bond formation in the NEMO dimer requires Cys54 and Cys347". Biochem. Biophys. Res. Commun. 367 (1): 103–8. PMC 2277332. PMID 18164680. doi:10.1016/j.bbrc.2007.12.123.
- ↑ Cui Zhanhua, Jacob Gah-Kok Gan, Li lei, Meena Kishore Sakharkar, and Pandjassarame Kangueane. Protein subunit interfaces: heterodimers versus homodimers Bioinformation. 2005; 1(2): 28–39. Published online 2005 August 11. PMCID: PMC1891636 [1]
- ↑ Browner MF, Fletterick RJ (1992). "Phosphorylase: a biological transducer". Trends in Biochemical Science 17 (2): 66–71. PMID 1566331. doi:10.1016/0968-0004(92)90504-3.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Dímero |
