Potenciación dependente de anticorpo
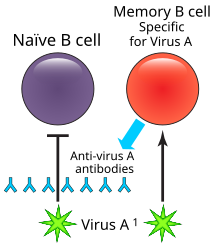
A potenciación dependente de anticorpo (ou ADE, do inglés Antibody-Dependent Enhancement) é unha unha potenciación ou aumento dunha infección vírica cando proteínas antivirais non neutralizantes acaban paradoxalmente facilitando a entrada do virus na célula hóspede, o que ten como resultado un aumento da infectividade do virus nas células. Algunhas células non teñen os receptores habituais na súa superficie que os virus aproveitan para usalos para conseguir entrar nelas. As proteínas antivirais (é dicir, os anticorpos) únense ao receptor de Fc (ao que se une a rexión Fc dos anticorpos) que algunhas destas células teñen na súa membrana plasmática. Os virus únense ao sitio de unión do antíxeno (rexión Fab) situado no outro extremo do anticorpo. A ADE é algo común en células cultivadas no laboratorio, pero ocorre raramente in vivo excepto nalgúns casos como na infección polo DENV, virus causante do dengue. Este virus pode utilizar este mecanismo para infectar os macrófagos humanos, causando que unha infección viral que normalmente sería leve se converta en potencialmente mortal.[1]
Na infección polo virus do dengue
[editar | editar a fonte]- Artigos principais: Dengue (enfermidade) e Virus do dengue.
O exemplo máis coñecido de ADE ocorre durante a infección polo virus do dengue (DENV). O DENV é un virus de ARN monocatenario de polaridade positiva da familia Flaviviridae. Causa unha enfermidade de variada gravidade en humanos chamada dengue, que xeralmente é autolimitada, pero pode dar lugar tamén á febre hemorráxica do dengue e á síndrome de choque do dengue, que poden ser ambas mortais.[2] Estímase que se infectan polo DENV uns 390 millóns de individuos cada ano.[3]
O fenómeno da ADE pode observarse cando unha persoa que foi anteriormente infectada por un serotipo de DENV volve a ser infectado meses ou anos despois por outro serotipo diferente. En tales casos, a evolución clínica da enfermidade é máis grave, e os pacientes teñen unha viremia máis alta comparados con outros nos que non ocorreu a ADE. Isto explica a observación de que mentres que as infeccións primarias (as primeiras) causan maiormente unha enfermidade de importancia menor en nenos, as infeccións secundarias (reinfeccións nun momento posterior) están máis probablemente asociadas con casos de enfermidade graves (dengue hemorráxico ou síndrome de choque) tanto en nenos coma en adultos.[4]
Hai catro serotipos antixenicamente diferentes do DENV (de DENV-1 a DENV-4).[5] A infección polo DENV induce a produción de inmunoglobulinas G (IgG) homotípicas neutralizantes, que proporcionan unha inmunidade durante toda a vida contra o serotipo que causou a infección. A infección polo DENV tamén produce certo grao de inmunidade cruzada protectora contra os outros serotipos.[6] Os anticorpos IgG heterotípicos (con reacción cruzada) neutralizantes responsables desta inmunidade cruzada protectora, normalmente persisten durante un período de varios meses ou uns poucos anos. As titulacións destes anticorpos heterotípicos diminúen ao longo de períodos de tempo grandes (de 4 a 20 anos).[7] Aínda que as titulacións de anticorpos IgG heterotípicos diminúen, as titulacións de anticorpos IgG homotípicos increméntase durante longos períodos de tempo. Isto podería deberse á supervivencia preferente das células B de memoria de vida longa que producen anticorpos homotípicos.[7]
Ademais de inducir a produción de anticorpos heterotípicos neutralizantes, a infección polo DENV pode tamén inducir anticorpos heterotípicos que só neutralizan o virus parcialmente ou nada en absoluto.[8] A produción de tales reaccións cruzadas pero non anticorpos neutralizantes podería ser a razón pola cal as infeccións secundarias son máis graves. Pénsase que ao unírense ao virus pero non neutralizalo, estes anticorpos causan que este se comporte como un "cabalo de Troia",[9][10][11] que é enviado a un compartimento equivocado das células dendríticas, que inxeriran os virus para destruílos.[12][13] Unha vez dentro dun glóbulo branco, o virus replícase sen ser detectado, xerando finalmente titulacións de virus moi altas, que causan unha grave enfermidade.[14]
Un estudo dirixido por Modhiran et al.[15] intentou explicar como os anticorpos non neutralizantes regulan á baixa a resposta inmunitaria na célula hóspede por medio da vía de sinalización TLR. Os TLR recoñecen partículas virais extra e intaracelulares e son unha das principais bases para a produción de citocinas. Os experimentos in vitro mostraron que as citocinas inflamatorias e a produción de IFN de tipo I eran reducidas cando o complexo ADE-DENV se unía ao receptor de Fc das células THP-1. Isto pode explicarse tanto por un descenso da produción de TLR coma por unha modificación da súa vía de sinalización. Por unha parte, unha proteína descoñecida inducida polo receptor de Fc estimulado reduce a transcrición e tradución de TLR, o que reduce a capacidade da célula de detectar as proteínas virais. Por outra parte, moitas proteínas (TRIF, TRAF6, TRAM, TIRAP, IKKα, TAB1, TAB2, complexo NF-κB) implicadas na vía de sinalización TLR están regulados á baixa, o cal orixina un decrecemento da produción de citocinas. Dous delas, a TRIF e a TRAF6, son respectivamente reguladas á baixa por dúas proteínas chamadas SARM e TANK, reguladas á alza polos receptores de Fc estimulados.
Para ilustrar o fenómeno da ADE, consideraremos o seguinte exemplo: unha epidemia de dengue ocorrida en Cuba, durou desde 1977 a 1979. O serotipo infectante fora o DENV-1. Esta epidemia foi seguida doutros dous gromos de dengue, un en 1981 e outro en 1997; o DENV-2 era o serotipo infectante nestas dúas últimas epidemias. Producíronse 205 casos de dengue hemorráxico/choque do dengue durante o gromo de 1997, todos en persoas de máis de 15 anos. En todos os casos menos tres demostrouse que eran persoas que foran infectadas previamente polo serotipo DENV-1 durante a epidemia de 1977–1979.[16] Ademais, as persoas que foran infectadas con DENV-1 durante a epidemia de 1977-79 e infectadas secundariamente con DENV-2 en 1997 tiñan de 3 a 4 veces máis probabilidade de desenvolver unha enfermidade grave que as que foran infectadas secundariamente polo DENV-2 en 1981.[7] Este escenario pode ser explicado pola presenza de anticorpos Ig heterotípicos neutralizantes en títulos suficientes en 1981, cuxas titulacións diminuíran en 1997 ata o punto no que xa non proporcionaban unha inmunidade de reacción cruzada protectora significativa.
Na infección polo VIH-1
[editar | editar a fonte]A ADE de infección tamén se observou no virus da inmunodeficiencia humana (VIH). Igual que o DENV, un nivel de anticorpos non neutralizantes potencia a infección viral por medio de interaccións co sistema do complemento e receptores.[17] Informouse que a infección se multiplicba por 350, o que é comparable á ADE noutros virus como o DENV.[17] A ADE no VIH pode ser mediada polo complemento ou polo receptor de Fc. O complemento en presenza de soros positivos para o VIH-1 potencia a infección da liña celular de células T MT-2. A potenciación mediada polo receptor de Fc observouse cando a infección polo VIH potenciada polos soros de coellos de Indias HIV-1 positivos aumentaba a infección de células mononucleares sanguíneas en sangue periférico sen a presenza de complemento.[18] Os receptores dos compoñentes do complemento CR2, CR3 e CR4 median esta potenciación da infección mediada polo complemento.[17][19] A infección polo VIH-1 leva á activación dos fragmentos do sistema de complemento e poden axudar os virus a infectar ao facilitar as interaccións virais con células hóspedes que expresan receptores do complemento.[20] A deposición do complemento sobre o virus pon a proteína gp120 moi preto das moléculas CD4 da superficie das células, o que facilita a entrada do virus na célula.[20] Os virus preexpostos a compoñentes do sistema do complemento non neutralizante tamén potencian as súas infeccións nas células dendríticas interdixitantes (iDC). Os virus Opsonizados non só mostran unha potenciación da súa entrada na célula, senón tamén fervenzas de sinalización favorables para a replicación do VIH nese tipo de células dendríticas.[21]
O VIH-1 tamén potencia a súa infección en células HT-29 cando os virus son preopsonizados coas moléculas do complemento C3 e C9 en fluído seminal. Este aumento da taxa de infección era case dúas veces maior que a infección das células HT-29 só co virus.[22] Subramanian et al., informaron que case o 72% das mostras de soro de 39 individuos positivos para o VIH conteñen compoñentes do complemento que potencian a infección. Tamén suxeriron a presenza no soro de anticorpos neutralizantes ou anticorpos que median na citotoxicidade celular dependente de anticorpos (ADCC) e tamén de anticorpos que potencian a infección (IEA, do inglés infection enhancing antibodies).[23] O balance entre os anticorpos neutralizantes e os anticorpos que potencian a infección cambia a medida que progresa a enfermidade. Durante os estadios avanzados da enfermidade a proporción de anticorpos potenciadores da infección é xeralmente maior que o de anticorpos neutralizantes.[24] Informouse que o incremento na síntese de proteínas virais e a produción de ARN ocorren durante a potenciación da infección mediada polo complemento. As células que recibían niveis non neutralizantes de moléculas do complemento presentaban unha aceleración da liberación da reversotranscriptase e da proxenie viral.[25] A interacción de anticorpos anti-VIH con virus expostos ao complemento non neutralizante tamén axuda na unión dos virus e os eritrocitos, o que pode orixinar unha entrega máis eficiente do virus nos órganos inmunocomprometidos.[19]
A ADE no VIH suscitou cuestións sobre o risco de infeccións de voluntarios que tomaran niveis subneutralizantes de vacinas igual que noutros virus que presentan ADE. Gilbert et al., en 2005 informou que non había ADE de infección cando se usaba a vacina rgp120 nos ensaios en fase 1 e 2.[26] Salientouse que se necesita moita máis investigación no campo da resposta inmunitaria ao VIH-1, e a información destes estudos podería utilizarse para producir unha vacina máis efectiva.
Mecanismo
[editar | editar a fonte]Hai varias posibilidades para explicar este fenómeno. As principais son:
- Unha proteína da superficie viral enlazada a anticorpos contra un virus dun serotipo únese un virus similar de diferente serotipo. A unión suponse que neutraliza a proteína da superficie do virus, que xa non se poderá unir á célula, pero o anticorpo unido ao virus únese tamén ao receptor da célula, o receptor FcγR da rexión Fc do anticorpo. Isto pon o virus en estreita proximidade ao receptor específico que o virus utiliza para entrar na célula, e a céula internaliza o virus pola ruta normal de infección.[27]
- Unha proteína da superficie do virus pode estar unida a anticorpos dun serotipo diferente, activando a vía clásica do sistema do complemento, no que intervén o compoñente C1q. Ao final o virus queda unido a un receptor do complemento que se encontra nas células, o que facilita a súa entrada na célula. Este mecanismo non se atopou especificamente na infección polo DENV, pero suponse que ocorre na infección polo Ebolavirus in vitro.[27][28]
Notas
[editar | editar a fonte]- ↑ Dimmock, N. J.; Easton, A. J. (Andrew J.); Leppard, Keith (2007). Introduction to modern virology. Malden, MA: Blackwell Pub. p. 65. ISBN 978-1-4051-3645-7.
- ↑ Boonnak, K; Slike, BM; Burgess, TH; Mason, RM; Wu, SJ; Sun, P; Porter, K; Rudiman, IF; et al. (2008). "Role of Dendritic Cells in Antibody-Dependent Enhancement of Dengue Virus Infection". Journal of Virology 82 (8): 3939–51. PMC 2292981. PMID 18272578. doi:10.1128/JVI.02484-07.
- ↑ Stinchcomb, Dan; Ambuel, Yuping; Young, Ginger; Brewoo, Joeseph; Paykal, Joanna; Weisgrau, Kim; Rakasz, Eva; Haller, Aurelia; Royals, Michael; Capuano, Saverio; Partidos, Charalambos; Osorio, Jorge (15 Sep 2014). "A Rapid Immunization Strategy with a Live-Attenuated Tetravalent Dengue Vaccine Elicits Protective Neutralizing Antibody Responses in Non-Human Primates". Frontiers in Immunology 5 (2014): 436. PMC 4046319. PMID 24926294. doi:10.3389/fimmu.2014.00263.
- ↑ Guzman MG, Vazquez S (December 2010). "The complexity of antibody-dependent enhancement of dengue virus infection". Viruses 2 (12): 2649–62. PMC 3185591. PMID 21994635. doi:10.3390/v2122649.
- ↑ King, CA; Anderson, R; Marshall, JS (2002). "Dengue Virus Selectively Induces Human Mast Cell Chemokine Production". Journal of Virology 76 (16): 8408–19. PMC 155122. PMID 12134044. doi:10.1128/JVI.76.16.8408-8419.2002.
- ↑ Alvarez, G; Piñeros, JG; Tobón, A; Ríos, A; Maestre, A; Blair, S; Carmona-Fonseca, J (2006). "Efficacy of three chloroquine-primaquine regimens for treatment of Plasmodium vivax malaria in Colombia". The American Journal of Tropical Medicine and Hygiene 75 (4): 605–9. PMID 17038680.
- ↑ 7,0 7,1 7,2 Guzman, MG; Alvarez, M; Rodriguez-Roche, R; Bernardo, L; Montes, T; Vazquez, S; Morier, L; Alvarez, A; et al. (2007). "Neutralizing Antibodies after Infection with Dengue 1 Virus". Emerging Infectious Diseases 13 (2): 282–6. PMC 2725871. PMID 17479892. doi:10.3201/eid1302.060539.
- ↑ Goncalvez, AP; Engle, RE; St. Claire, M; Purcell, RH; Lai, CJ (2007). "Monoclonal antibody-mediated enhancement of dengue virus infection in vitro and in vivo and strategies for prevention". Proceedings of the National Academy of Sciences 104 (22): 9422–7. Bibcode:2007PNAS..104.9422G. PMC 1868655. PMID 17517625. doi:10.1073/pnas.0703498104.
- ↑ Peluso R, Haase A, Stowring L, Edward M, Ventura P (1985). "A Trojan mechanism for the spread of visna virus in monocytes". Virology 147 (1): 231–6. PMID 2998068. doi:10.1016/0042-6822(85)90246-6.
- ↑ Chen Y, Wang S (2002). "Activation of Terminally Differentiated Human Monocytes/Macrophages by Dengue Virus: Productive Infection, Hierarchical Production of Innate Cytokines and Chemokines, and the Synergistic Effect of Lipopolysaccharide". J Virol 76 (19): 9877–87. PMC 136495. PMID 12208965. doi:10.1128/JVI.76.19.9877-9887.2002.
- ↑ Witayathawornwong P (2005). "Case report: fatal dengue encephalitis" (PDF). Southeast Asian J Trop Med Public Health 36 (1): 200–2. ISSN 0125-1562. PMID 15906668. Arquivado dende o orixinal (PDF) o 24 de xullo de 2011. Consultado o 2011-05-01.
- ↑ Rodenhuis-Zybert IA, Wilschut J, Smit JM (August 2010). "Dengue virus life cycle: viral and host factors modulating infectivity". Cell. Mol. Life Sci. 67 (16): 2773–86. PMID 20372965. doi:10.1007/s00018-010-0357-z.
- ↑ Guzman MG, Halstead SB, Artsob H, et al. (December 2010). "Dengue: a continuing global threat". Nat. Rev. Microbiol. 8 (12 Suppl): S7–S16. PMID 21079655. doi:10.1038/nrmicro2460.
- ↑ Dejnirattisai W, Jumnainsong A, Onsirisakul N, et al. (May 2010). "Cross-reacting antibodies enhance dengue virus infection in humans". Science 328 (5979): 745–8. Bibcode:2010Sci...328..745D. PMID 20448183. doi:10.1126/science.1185181.
- ↑ Naphak Modhiran; Siripen Kalayanarooj; Sukathida Ubol (2010). "Subversion of Innate Defenses by the Interplay between DENV and Pre-Existing Enhancing Antibodies: TLRs Signaling Collapse". PLoS Neglected Tropical Diseases (PLOS ONE) 4: e924. doi:10.1371/journal.pntd.0000924.
- ↑ Guzman, MG (2000). "Dr. Guzman et al. Respond to Dr. Vaughn". American Journal of Epidemiology 152 (9): 804. doi:10.1093/aje/152.9.804.
- ↑ 17,0 17,1 17,2 Willey, S; Aasa-Chapman, MI; O'Farrell, S; Pellegrino, P; Williams, I; Weiss, RA; Neil, SJD (2011). "Extensive complement-dependent enhancement of HIV-1 by autologous non-neutralising antibodies at early stages of infection". Retrovirology 8: 16. PMC 3065417. PMID 21401915. doi:10.1186/1742-4690-8-16.
- ↑ Levy, JA (2007). HIV and the pathogenesis of AIDS. Wiley-Blackwell. p. 247. ISBN 1-55581-393-3.
- ↑ 19,0 19,1 Yu, Q; Yu, R; Qin, X (2010). "The good and evil of complement activation in HIV-1 infection". Cellular and Molecular Immunology 7 (5): 334–40. PMID 20228834. doi:10.1038/cmi.2010.8.
- ↑ 20,0 20,1 Gras, GS; Dormont, D (1991). "Antibody-dependent and antibody-independent complement-mediated enhancement of human immunodeficiency virus type 1 infection in a human, Epstein-Barr virus-transformed B-lymphocytic cell line". Journal of Virology 65 (1): 541–5. PMC 240554. PMID 1845908.
- ↑ Bouhlal, H; Chomont, N; Réquena, M; Nasreddine, N; Saidi, H; Legoff, J; Kazatchkine, MD; Bélec, L; Hocini, H (2007). "Opsonization of HIV with Complement Enhances Infection of Dendritic Cells and Viral Transfer to CD4 T Cells in a CR3 and DC-SIGN-Dependent Manner". Journal of Immunology 178 (2): 1086–95. PMID 17202372. doi:10.4049/jimmunol.178.2.1086.
- ↑ Bouhlal, H; Chomont, N; Haeffner-Cavaillon, N; Kazatchkine, MD; Belec, L; Hocini, H (2002). "Opsonization of HIV-1 by Semen Complement Enhances Infection of Human Epithelial Cells". Journal of Immunology 169 (6): 3301–6. PMID 12218150. doi:10.4049/jimmunol.169.6.3301.
- ↑ Subbramanian, RA; Xu, J; Toma, E; Morisset, R; Cohen, EA; Menezes, J; Ahmad, A (2002). "Comparison of Human Immunodeficiency Virus (HIV)-Specific Infection-Enhancing and -Inhibiting Antibodies in AIDS Patients". Journal of Clinical Microbiology 40 (6): 2141–6. PMC 130693. PMID 12037078. doi:10.1128/JCM.40.6.2141-2146.2002.
- ↑ Beck, Z; Prohászka, Z; Füst, G (2008). "Traitors of the immune system—Enhancing antibodies in HIV infection: Their possible implication in HIV vaccine development". Vaccine 26 (24): 3078–85. PMID 18241961. doi:10.1016/j.vaccine.2007.12.028.
- ↑ Robinson Jr, WE; Montefiori, DC; Mitchell, WM (1990). "Complement-mediated antibody-dependent enhancement of HIV-1 infection requires CD4 and complement receptors". Virology 175 (2): 600–4. PMID 2327077. doi:10.1016/0042-6822(90)90449-2.
- ↑ Gilbert, PB; Peterson, ML; Follmann, D; Hudgens, MG; Francis, DP; Gurwith, M; Heyward, WL; Jobes, DV; et al. (2005). "Correlation between Immunologic Responses to a Recombinant Glycoprotein 120 Vaccine and Incidence of HIV‐1 Infection in a Phase 3 HIV‐1 Preventive Vaccine Trial". The Journal of Infectious Diseases 191 (5): 666–77. PMID 15688279. doi:10.1086/428405.
- ↑ 27,0 27,1 Takada, A; Kawaoka, Y (2003). "Antibody-dependent enhancement of viral infection: molecular mechanisms and in vivo implications". Reviews in Medical Virology 13 (6): 387–98. PMID 14625886. doi:10.1002/rmv.405.
- ↑ Takada, A; Feldmann, H; Ksiazek, TG; Kawaoka, Y (2003). "Antibody-Dependent Enhancement of Ebola Virus Infection". Journal of Virology 77 (13): 7539–44. PMC 164833. PMID 12805454. doi:10.1128/JVI.77.13.7539-7544.2003.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Pecado orixinal antixénico
- Virus da gripe A H7N9, onde se sospeita que se dá a ADE
