2-Butanol
| 2-Butanol | |
|---|---|
 | |
| Identificadores | |
| Número CAS | 78-92-2, 14898-79-4 (R), 4221-99-2 (S) |
| PubChem | 6568, 84682 (R), 444683 (S) |
| ChemSpider | 6320, 76392 (R), 392543 (S) |
| UNII | 0TUL3ENK62, DLH38K423J (R), 69KXU5NDTO (S) |
| Número CE | 201-158-5 |
| Número UN | 1120 |
| DrugBank | DB02606 |
| MeSH | 2-butanol |
| ChEBI | CHEBI:35687 |
| ChEMBL | CHEMBL45462 |
| Número RTECS | EO1750000 |
| Referencia Beilstein | 773649 1718764 (R) |
| Referencia Gmelin | 1686 396584 (R) |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C4H10O |
| Masa molar | 74,12 g mol−1 |
| Densidade | 0,808 g cm−3 |
| Punto de fusión | −115 °C; −175 °F; 158 K |
| Punto de ebulición | 98–100 °C; 208–212 °F; 371–373 K |
| Solubilidade en auga | 290 g/L[3] |
| log P | 0,683 |
| Presión de vapor | 1,67 kPa (a 20 °C) |
| Acidez (pKa) | 17,6 [4] |
| Índice de refracción (nD) | 1,3978 (a 20 °C) |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
−343,3 to −342,1 kJ mol−1 |
| Entalpía estándar de combustión ΔcH |
−2,6611 to −2,6601 MJ mol−1 |
| Entropía molar estándar S |
213,1 J K−1 mol−1 |
| Capacidade calorífica, C | 197,1 J K−1 mol−1 |
| Perigosidade | |
| Pictogramas GHS | 
|
| Palabra sinal GHS | WARNING |
| declaración de perigosidade GHS | H226, H319, H335, H336 |
| declaración de precaución GHS | P261, P305+351+338 |
| NFPA 704 | |
| Punto de inflamabilidade | 22 to 27 °C; 72 to 81 °F; 295 to 300 K |
| Límites de explosividade | 1,7–9,8% |
| Compostos relacionados | |
| butanois relacionados | n-Butanol Isobutanol ter-Butanol |
| Compostos relacionados | Butanona |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
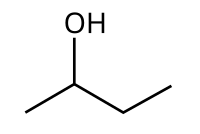
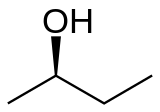
O 2-butanol, butan-2-ol ou sec-butanol é un composto orgánico coa fórmula CH3CH(OH)CH2CH3. Os seus isómeros estruturais son os seguintes: 1-butanol, isobutanol e ter-butanol. O 2-butanol é un composto quiral e pode formar dous estereoisómeros, R e S, designados como (R)-(−)-butan-2-ol e (S)-(+)-butan-2-ol. Ambos os estereoisómeros atópanse normalmente en mestura 1:1, o que se chama mestura racémica.
Este alcohol secundario é un líquido incoloro inflamable soluble en tres partes de auga e completamente miscible con solventes orgánicos. Produciuse a grande escala principalmente como precursor do solvente industrial metil etil cetona.
 |

|
 |

|
| (R)-(−)-2-butanol | (S)-(+)-2-butanol |
Produción e aplicacións[editar | editar a fonte]
O butan-2-ol prodúcese industrialmente por hidratación de 1-buteno ou 2-buteno:
Como catalizador para esta conversión utilízase o ácido sulfúrico.[5]
No laboratorio pode prepararse por medio da reacción de Grignard ao facer reaccionar o bromuro de etilmagnesio con acetaldehido en dietil éter secado ou tetrahidrofurano.
Aínda que parte do butan-2-ol producido se utiliza como solvente, a maior parte é convertido en butanona (metil etil cetona), un importante solvente industrial que se atopa en moitos produtos de limpeza domésticos e para quitar pintura. De todos modos, a maioría dos produtos utilizados para quitar pintura deixaron de usar a metil etil cetona debido a problemas de saúde e novas leis. Os ésteres volátiles do butan-2-ol teñen aromas agradables e utilízanse en pequenas cantidades en perfumes ou en aromas artificiais.[5]
Solubilidade[editar | editar a fonte]
A solubilidade publicada do butan-2-ol é con frecuencia incorrecta,[3] incluíndo algunhas das máis coñecidas referencias, como o Índice Merck, o CRC Handbook of Chemistry and Physics e o Lange's Handbook of Chemistry. Incluso o Programa Internacional de Seguridade Química (IPCS, polas súas siglas en inglés) publica nas súas listas unha solubilidade incorrecta. Este erro tan estendido orixinouse porque o Handbuch der Organischen Chemie de Beilstein cita unha solubilidade falsa de 12,5 g/100 g de auga. Moitas outras fontes usaron esta solubilidade, o cal espallou o erro como unha bóla de neve no mundo industrial. Os datos correctos (35,0 g/100 g a 20 °C, 29 g/100 g a 25 °C e 22 g/100 g a 30 °C) foron publicados primeiramente xa en 1886 por Alexejew e despois outros científicos informaron de datos similares, entre eles Dolgolenko e Dryer en 1907 e 1913, respectivamente.[3]
Precaucións[editar | editar a fonte]
Como outros butanois, o butan-2-ol ten unha baixa toxicidade. O LD50 é de 4400 mg/kg (rata, oral).[5]
Informouse de varias explosións[6][7][8] durante a destilación convencional de 2-butanol, aparentemente debido á acumulación de peróxidos cun punto de ebulición maior que o do alcohol puro (e, por tanto, concentrándose no alambique durante a destilación). Como os alcohois, a diferenza dos ésteres, non adoitan poder formar impurezas de peróxidos, o perigo foi probablemente pasado por alto. En realidade, o 2-butanol está incluído entre os compostos químicos formadores de peróxidos de clase B.[9]
Notas[editar | editar a fonte]
- ↑ "Alcohols Rule C-201.1". Nomenclature of Organic Chemistry (The IUPAC 'Blue Book'), Sections A, B, C, D, E, F, and H. Oxford: Pergamon Press. 1979.
Designacións como isopropanol, sec-butanol e ter-butanol son incorrectas porque non hai hidrocarburos isopropano, sec-butano e ter-butano aos cales se poida engadir o sufixo "-ol"; tales nomes deberían ser abandonados. Porén, alcohol isopropílico, alcohol sec-butílico e alcohol ter-butílico son permisibles (ver Regra C-201.3) porque os radicais isopropilo, sec-butilo e ter-butilo si existen.
- ↑ "2-butanol - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 26 de marzo de 2005. Identification and Related Records. Consultado o 12 de outubro de 2011.
- ↑ 3,0 3,1 3,2 Alger, Donald B. (November 1991). "The water solubility of butan-2-ol: A widespread error". Journal of Chemical Education 68 (11): 939. Bibcode:1991JChEd..68..939A. doi:10.1021/ed068p939.1.
- ↑ Serjeant, E.P., Dempsey B.; Ionisation Constants of Organic Acids in Aqueous Solution. International Union of Pure and Applied Chemistry (IUPAC). IUPAC Chemical Data Series No. 23, 1979. New York, New York: Pergamon Press, Inc., p. 989
- ↑ 5,0 5,1 5,2 Hahn, Heinz-Dieter; Dämbkes, Georg; Rupprich, Norbert (2005). "Butanols". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH..
- ↑ Doyle, R. R. (1986). "2-Butanol safety warning". Journal of Chemical Education 63 (2): 186. Bibcode:1986JChEd..63..186D. doi:10.1021/ed063p186.2.
- ↑ Peterson, Donald (11 de maio de 1981). "Letters: Explosion of 2-butanol". Chemical & Engineering News 59 (19): 3. doi:10.1021/cen-v059n019.p002.
- ↑ Watkins, Kenneth W. (maio de 1984). "Demonstration hazard". Journal of Chemical Education 61 (5): 476. Bibcode:1984JChEd..61..476W. doi:10.1021/ed061p476.3.
- ↑ "Classification List of Peroxide Forming Chemicals". ehs.ucsc.edu.



