Rodanase
| Dominio similar á rodanase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identificadores | |||||||||
| Símbolo | Rodanase | ||||||||
| Pfam | PF00581 | ||||||||
| InterPro | IPR001763 | ||||||||
| PROSITE | PDOC00322 | ||||||||
| SCOPe | 2ora / SUPFAM | ||||||||
| OPM superfamily | 413 | ||||||||
| OPM protein | 2mpn | ||||||||
| CDD | cd00158 | ||||||||
| Membranome | 571 | ||||||||
| |||||||||
| tiosulfato sulfurtransferase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Número EC | 2.8.1.1 | ||||||||
| Número CAS | 9026-04-4 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
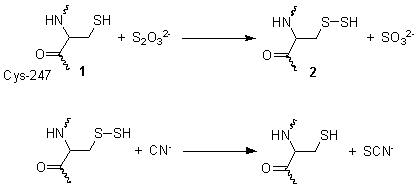
A rodanase ou rodanese é un encima mitocondrial que detoxifica o cianuro (CN−) ao convertelo en tiocianato (SCN−, tamén coñecido como "rodanato").[1] En encimoloxía, o nome común é tiosulfato sulfurtransferase (EC 2.8.1.1).[2] Cataliza a seguinte reacción:
- tiosulfato + cianuro sulfito + tiocianato
Nomenclatura[editar | editar a fonte]
Aínda que as regras de nomenclatura estándar para os encimas din que os seus nomes deben rematar en "ase" (neste caso sería rodanase), este encima é moitas veces coñecido como rodanese e así aparece en moitas bases de datos (rhodanese en inglés). Isto débese a que foi un encima descuberto en 1933,[3] antes de que se establecese a Comisión de Encimas en 1955; e daquela o nome orixinal estaba xa moi asentado e seguiu tendo un amplo uso ata os nosos días.
O nome sistemático desta clase de encimas é "tiosulfato:cianuro sulfurtransferase". Outros nomes en uso común son "tiosulfato cianuro transsulfurase", "tiosulfato tiotransferase", "tiosulfato sulfurtransferase", "rodanese" e "rodanase".
Estrutura e mecanismo[editar | editar a fonte]
Esta reacción ten lugar en dúas etapas. O diagrama da imaxe do cadro mostra a estrutura determinada por cristalografía de raios X da rodanase. En canto o seu mecanismo de acción, o primeiro paso é que o tiosulfato é reducido polo grupo tiol da cisteína-247 (1), para formar un persulfuro e un sulfito (2). O segundo paso é a reacción do persulfuro con cianuro para producir tiocianato, rexenerando o tiol da cisteína (1).[4]
A rodanase comparte relacións evolutivas cunha gran familia de proteínas, entre a que se inclúen as seguintes:
- dominio catalítico da Cdc25 fosfatase
- dominios non catalíticos das MAPK-fosfatases de especificidade dual de eucariotas
- dominios non catalíticos das MAPK-fosfatases de tipo PTP de lévedos
- dominios non catalíticos das Ubp4, Ubp5, Ubp7 de lévedos
- dominios non catalíticos da Ubp-Y de mamíferos
- proteína de choque térmico de Drosophila HSP-67BB
- varias proteínas de choque frío bacterianas e proteína de choque de fagos
- proteínas asociadas á senescencia de plantas
- dominios catalíticos e non catalíticos da rodanase[5]
A rodanase ten unha duplicación interna. Este dominio atópase como copia simple noutras proteínas, incluíndo fosfatases e as ubiquitina C-terminal hidrolases.[6]
Importancia clínica[editar | editar a fonte]
Esta racción é importante para o tratamento da exposición ao cianuro, xa que o tiocianato formado ten unha toxicidade 200 veces menor.[7]:p. 15938 O uso da solución do tiosulfato como antídoto para o envelenamento por cianuro está baseado na activación deste ciclo encimático.
Proteínas humanas[editar | editar a fonte]
A rodanase mitocondrial humana é a TST.
Estes outros xenes humanos teñen o dominio "similar a rodanase" en InterPro, pero non son a rodanase coa súa actividade catalítica típica (ver tamén a lista de proteínas relacionadas da familia en #Estrutura e mecanismo):
- fosfatase indutora da fase M: CDC25A; CDC25B; CDC25C;
- proteína fosfatase de especificidade dual: DUSP; DUSP1; DUSP2; DUSP4; DUSP5; DUSP6; DUSP7; DUSP10; DUSP16, tamén chamada MKP7;
- tiosulfato:glutatión sulfurtransferase: KAT, agora chamada "TSTD1";
- adenililtransferase e sulfurtransferase: MOCS3;
- 3-mercaptopiruvato sulfurtransferase: MPST, tamén coñecida como "TSTD2"
- non é un encima: TBCK; TSGA14;
- ubiquitina carboxilo-terminal hidrolase: USP8;
- de actividade descoñecida: TSTD3
Notas[editar | editar a fonte]
- ↑ Cipollone R, Ascenzi P, Tomao P, Imperi F, Visca P (2008). "Enzymatic detoxification of cyanide: clues from Pseudomonas aeruginosa Rhodanese". Journal of Molecular Microbiology and Biotechnology 15 (2–3): 199–211. PMID 18685272. doi:10.1159/000121331.
- ↑ EC 2.8.1.1, no International Union of Biochemistry and Molecular Biology
- ↑ Cipollone R, Ascenzi P, Visca P (febreiro de 2007). "Common themes and variations in the rhodanese superfamily". IUBMB Life 59 (2): 51–9. PMID 17454295. doi:10.1080/15216540701206859.
- ↑ Cipollone R, Ascenzi P, Tomao P, Imperi F, Visca P (2008). "Enzymatic detoxification of cyanide: clues from Pseudomonas aeruginosa Rhodanese". Journal of Molecular Microbiology and Biotechnology 15 (2–3): 199–211. PMID 18685272. doi:10.1159/000121331.
- ↑ "Thiosulphate sulfurtransferase, conserved site (IPR001307)". EMBL-EBI (en inglés). InterPro.
- ↑ Gliubich F, Gazerro M, Zanotti G, Delbono S, Bombieri G, Berni R (agosto de 1996). "Active site structural features for chemically modified forms of rhodanese". The Journal of Biological Chemistry 271 (35): 21054–61. PMID 8702871. doi:10.1074/jbc.271.35.21054.
- ↑ Jaszczak E, Polkowska Ż, Narkowicz S, Namieśnik J (xullo de 2017). "Cyanides in the environment-analysis-problems and challenges". Environmental Science and Pollution Research International 24 (19): 15929–15948. PMC 5506515. PMID 28512706. doi:10.1007/s11356-017-9081-7.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Rodanase |
Rhodanese Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.