Receptor de neurotransmisor
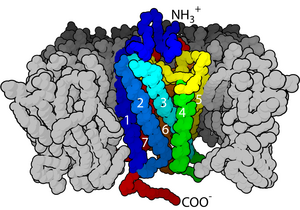
Un receptor de neurotransmisor, tamén chamado neurorreceptor, é unha proteína receptora de membrana das células do sistema nervioso, musculares e inmunitarias,[1] que é activada por un neurotransmisor.[2] Os compostos químicos de fóra da célula, como un neurotransmisor, poden chocar coa membrana celular e poden encontrar receptores ao longo da membrana. Se un neurotransmisor choca co seu receptor correspondente, únense e poden desencadear outros eventos dentro da célula. Por tanto, un receptor de membrana forma parte da maquinaria molecular que permite que as células se comuniquen entre elas. Un receptor de neurotransmisor é unha clase de receptores que se une especificamente con neurotransmisores e non a outras moléculas.
En células postsinápticas os receptores de neurotransmisores reciben sinais que desencadean un sinal eléctrico ao regularen a actividade de canles iónicas. O influxo de ións polas canles iónicas abertas debido á unión de neurotransmisores a receptores específicos pode cambiar o potencial de membrana dunha neurona. Isto pode resultar nun sinal que discorre ao longo do axón e transmítese a través da sinapse a outra neurona e posiblemente a unha rede neural.[1] Nas células presinápticas pode haber receptores específicos para os neurotransmisores liberados pola propia célula, que se denominan autorreceptores, o cal proporciona unha retroalimentación e evita unha excesiva liberación de neurotransmisores.[3]
Hai dous grandes tipos de receptores de neurotransmisores: ionotrópicos e metabotrópicos. Nos ionotrópicos os ións poden pasar a través do receptor, mentres que nos metabotrópicos un segundo mensaxeiro no interior da célula transmite a mensaxe (por tanto, os receptores metabotrópicos non teñen canles). Os receptores metabotrópicos son receptores acoplados á proteína G.[2][4] Os receptores ionotrópicos, tamén chamados canles iónicas reguladas por ligando, poden ser excitados por neurotransmisores (que son os ligandos) como o glutamato e aspartato. Estes receptores poden tamén ser inhibidos por neurotransmisores como o GABA e a glicina. Inversamente, os receptores acoplados á proteína G non son excitadores nin inhibidores, senón que teñen un amplo número de funcións como modular as accións de canles iónicas excitadoras e inhibidoras ou desencadear unha fervenza de sinalización que libera calcio dos almacéns do interior da célula.[2] A maioría dos receptores de neurotransmisores están acoplados á proteína G.[1]
Localización
[editar | editar a fonte]Os receptores de neurotransmisor están localizados na superficie das neuronas e células da glía[5]. Nunha sinapse unha neurona envía mensaxes a outras neuronas por medio de neurotransmisores. Por tanto, a neurona postsináptica, que é a que recibe a mensaxe, agrupa os receptores de neurotransmisores nese lugar da súa membrana. Os receptores de neurotransmisores poden estar inseridos en calquera rexión da membrana das neuronas, como as dendritas, axóns ou corpo celular.[6]
Tamén están localizados en células musculares (unión neuromuscular con receptores de acetilcolina)[7] e inmunitarias.[8]
Receptores ionotrópicos: canles iónicas reguladas por neurotransmisor
[editar | editar a fonte]
As canles iónicas reguladas por ligando son un tipo de receptor ionotrópico ou receptor ligado a canle. Son un grupo de canle iónica transmembrana que se abre ou pecha en resposta á unión dun mensaxeiro químico ou ligando (neste caso o neurotransmisor),[9]
O sitio de unión de ligandos endóxenos a complexos proteicos de canles iónicas reguladas por ligando está normalmente localizado en diferentes porcións da proteína (un sitio de unión alostérica) de onde está situado o poro de condución. A ligazón directa entre a unión ao ligando e a apertura ou peche da canle iónica, que é característica das canles iónicas reguladas por ligando, contraponse ao funcionamento directo dos receptores metabotrópicos, os cales usan un segundo mensaxeiro. As canles iónicas reguladas por ligando son tamén diferentes das canles iónicas reguladas por voltae (que se abren e pechan dependendo do potencial de membrana) e canles iónicas activadas por estiramento (que se abren e pechan dependendo da deformación mecánica da membrana celular).[9][10]
Receptores metabotrópicos: receptores acoplados á proteína G
[editar | editar a fonte]
Os receptores acoplados (ou ligados) á proteína G (GPCRs ou GPLR), tamén coñecidos como receptores de dominio sete transmembrana, receptores 7TM, receptores heptahelicoidais ou receptores serpentina, comprende unha gran familia de proteínas de receptores transmembrana que é sensible a moléculas de fóra da célula e activa vías de transdución de sinais internas e, finalmente, respostas celulares. Os receptores acoplados á proteína G encóntranse só en eucariotas, incluíndo os lévedos, coanoflaxelados,[11] e animais. Entre os ligandos que se unen e activan estes receptores están compostos sensibles á luz, cheiros, feromonas, hormonas e neurotransmisores e varían en tamaño desde pequenas moléculas a péptidos e grandes proteínas. Os receptores acoplados á proteína G están implicados en moitas enfermidades, e son tamén a diana de aproximadamente o 30% de todos os fármacos modernos.[12][13]
Hai dúas vías principais de transdución de sinais que implican os receptores acoplados á proteína G: as vías de sinalización por AMPc e a vía de sinalización por fosfatidilinositol.[14] Cando un ligando se une ao GPCR causa un cambio conformacional en dito receptor, o que fai que este actúe como un factor de intercambio do nucleótido guanina (GEF). O GPCR pode despois activar unha proteína G asociada intercambiando o seu GDP unido por un GTP. A sububnidade α da proteína G, xunto GTP unida, pode despois disociarse das subunidades β e γ para seguir afectando a proteínas de sinalización intercelular ou proteínas funcionais diana directamente dependendo do tipo de subunidade α (Gαs, Gαi/o, Gαq/11, Gα12/13).[15]:1160
Desensibilización e concentración do neurotransmisor
[editar | editar a fonte]Os receptores de neurotransmisores poden sufrir desensibilización inducida por ligando, é dicir, poden volverse insensibles por unha exposición prolongada aos seus neurotransmisores. Os receptores de neurotransmisores están presentes tanto nas neuronas postsinápticas coma nas presinápticas; nestas últimas teñen a función de recibir o neurotransmisor e nas primeiras a de impediren a liberación dun determinado neurotransmisor.[16] Ademais de en células neuronais, os receptores de neurotransmisores encóntranse tamén en varias células inmunitarias e musculares. Moitos receptores de neurotransmisores están categorizados como un receptor serpentina ou receptor acoplado á proteína G porque abranguen todo o grosor da membrana cruzándoa sete veces. Os receptores de neurotransmisores fanse insensibles ao tipo de neurotransmisor que reciben cando se expoñen durante extensos períodos de tempo. Este fenómeno coñécese como desensibilización inducida por ligando[16] ou regulación á baixa.
Exemplo de receptores de neurotransmisores
[editar | editar a fonte]Velaquí as principais clases de receptores de neurotransmisores:[17]
- Adrenérxico: α1A, α1b, α1c, α1d, α2a, α2b, α2c, α2d, β1, β2, β3.
- Dopaminérxico: D1, D2, D3, D4, D5.
- GABAérxico: GABAA, GABAB1a, GABAB1δ, GABAB2, GABAC.
- Glutamatérxico: NMDA, AMPA, cainato, mGluR1, mGluR2, mGluR3, mGluR4, mGluR5, mGluR6, mGluR7.
- Histaminérxico: H1, H2, H3.
- Colinérxico: muscarínico: M1, M2, M3, M4, M5; nicotínico: múscular, neuronal (insensible á α-bungarotoxina), neuronal (sensible á α-bungarotoxina).
- Opioide: μ, δ1, δ2, κ.
- Serotoninérxico: 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT3, 5-HT4, 5-HT5, 5-HT6, 5-HT7.
- Glicinérxico: glicina.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 Levitan, Irwin B.; Leonard K. Kaczmarek (2002). The Neuron (Third pg. 285 ed.). Oxford University Press.
- ↑ 2,0 2,1 2,2 "Neurological Control - Neurotransmitters". Brain Explorer. 2011-12-20. Consultado o 2012-11-04.
- ↑ "Neurotransmitter Receptors, Transporters, & Ion Channels". www.rndsystems.com.
- ↑ "3. Neurotransmitter Postsynaptic Receptors". Web.williams.edu. Consultado o 2012-11-04.
- ↑ Ciappelloni S, Murphy-Royal C, Dupuis JP, Oliet SHR, Groc L. Dynamics of surface neurotransmitter receptors and transporters in glial cells: Single molecule insights. Cell Calcium. 2017 Nov;67:46-52. doi: 10.1016/j.ceca.2017.08.009. Epub 2017 Aug 25. PMID 29029790
- ↑ F., Bear, Mark (2007). Neuroscience : exploring the brain. Connors, Barry W., Paradiso, Michael A. (3rd ed.). Philadelphia, PA: Lippincott Williams & Wilkins. p. 106. ISBN 9780781760034. OCLC 62509134.
- ↑ Kahn Academy Neurotransmitters and receptors
- ↑ Levite M. Neurotransmitters activate T-cells and elicit crucial functions via neurotransmitter receptors. Curr Opin Pharmacol. 2008 Aug;8(4):460-71. doi: 10.1016/j.coph.2008.05.001. Epub 2008 Jun 23. PMID 18579442
- ↑ 9,0 9,1 Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White (2008). Neuroscience. 4th ed. Sinauer Associates. pp. 156–7. ISBN 978-0-87893-697-7.
- ↑ Connolly CN, Wafford KA (2004). "The Cys-loop superfamily of ligand-gated ion channels: the impact of receptor structure on function". Biochem. Soc. Trans. 32 (Pt3): 529–34. PMID 15157178. doi:10.1042/BST0320529.
- ↑ King N, Hittinger CT, Carroll SB (2003). "Evolution of key cell signaling and adhesion protein families predates animal origins". Science 301 (5631): 361–3. PMID 12869759. doi:10.1126/science.1083853.
- ↑ Filmore, David (2004). "It's a GPCR world". Modern Drug Discovery (American Chemical Society) 2004 (November): 24–28.
- ↑ Overington JP, Al-Lazikani B, Hopkins AL (December 2006). "How many drug targets are there?". Nat Rev Drug Discov 5 (12): 993–6. PMID 17139284. doi:10.1038/nrd2199.
- ↑ Gilman A.G. (1987). "G Proteins: Transducers of Receptor-Generated Signals". Annual Review of Biochemistry 56: 615–649. PMID 3113327. doi:10.1146/annurev.bi.56.070187.003151.
- ↑ Wettschureck N, Offermanns S (October 2005). "Mammalian G proteins and their cell type specific functions". Physiol. Rev. 85 (4): 1159–204. PMID 16183910. doi:10.1152/physrev.00003.2005.
- ↑ 16,0 16,1 "THE Medical Biochemistry Page". Web.indstate.edu. Arquivado dende o orixinal o 10 de xaneiro de 2019. Consultado o 2012-11-04.
- ↑ ed. Kebabain, J. W. & Neumeyer, J. L. (1994). "RBI Handbook of Receptor Classification"
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Brain Explorer
- Neurotransmitters Postsynaptic Receptors
- Snyder (2009) Neurotransmitters, Receptors, and Second Messengers Galore in 40 Years. Journal of Neuroscience. 29(41): 12717-12721.
- Snyder and Bennett (1976) Neurotransmitter Receptors in the Brain: Biochemical Identification. Annual Review of Physiology. Vol. 38: 153-175 Arquivado 04 de xaneiro de 2019 en Wayback Machine.
- Neuroscience for Kids: Neurotransmitters
- Library of Congress Authorities and Vocabularies: Neurotransmitter Receptors
- Neurotransmitter Receptors, Transporters, & Ion Channels
- Neuroregulator Receptor Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
