Glicóxeno fosforilase
| Glicóxeno fosforilase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
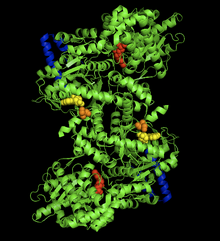
| Estrutura cristalina do complexo glicóxeno fosforilase-AMP do músculo de coello. O sitio alostérico do AMP (en amarelo), a Ser14 fosforilada (en laranxa), o sitio de unión ao glicóxeno (en azul), o sitio catalítico (en vermello).[1] | |||||||||
| Identificadores | |||||||||
| Número EC | 2.4.1.1 | ||||||||
| Número CAS | 9035-74-9 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A glicóxeno fosforilase é un encima fosforilase (EC 2.4.1.1) que cataliza a liberación de moléculas de glicosa 1-fosfato da molécula de glicóxeno. Este é o paso limitante da glicoxenólise nos animais. As glicosas libéranse nos enlaces glicosídicos terminais alfa-1,4 das cadeas de glicóxeno. A glicóxeno fosforilase estúdase tamén como unha proteína modelo regulada por fosforilación reversible (unión covalente reversible) e por efectos alostéricos.
Mecanismo
[editar | editar a fonte]A reacción global catalizada é:
(cadea de glicóxeno α-1,4)n + Pi ↔ (cadea de glicóxeno α-1,4)n-1 + D-glicosa 1-fosfato.[2]
A glicóxeno fosforilase rompe o glicóxeno en unidades de glicosa, que se liberan en forma de glicosa 1-fosfato. O glicóxeno queda cada vez que intervén o encima cunha unidade de glicosa menos. Para que a glicosa liberada poida ser utiizada no metabolismo debe converterse en glicosa 6-fosfato polo encima fosfoglicomutase.
Aínda que a reacción é reversible en solución, dentro da célula o encima só funciona na dirección degradativa porque a concentración de fosfato inorgánico é moito maior ca a de glicosa 1-fosfato.[2]
A glicóxeno fosforilase pode actuar só sobre cadeas liñais de glicóxeno (con enlace glicosídico α1-4). A súa actividade cesa inmediatamente catro residuos antes de que se chegue a un enlace α1-6, que están nos puntos de ramificación do glicóxeno, moi comúns na molécula. Neste situación, cómpre que actúe outro encima chamado encima desramificador do glicóxeno, o cal deixará recta a cadea nesa zona, e pode ralizar nos eucariotas dúas actividades (en E. coli fanas dous encimas distintos): actividade transferase e actividade α-1,6-glicosidase. Primeiramente actúa como encima transferase e cambia un bloque de tres residuos de glicosa da rama externa ao extremo doutra cadea, e despois actúa como α1-6 glicosidase e rompe o residuo de glicosa que queda con enlace α1-6 na nova cadea liñal. Despois de que se fixo todo isto, a glicóxeno fosforilase pode continuar separando máis residuos de glicosa. O encima é específico de cadeas α1-4, xa que ten unha fenda de 30 ángstrom de longo co mesmo raio ca a hélice formada pola cadea de glicóxeno; na fenda caben 4-5 residuos de glicosa, pero é demasiado estreita para as zonas con ramificacións. Esta fenda conecta o sitio de almacenamento do glicóxeno no encima co sitio activo catalítico.
O mecanismo ilústrase na figura de abaixo. A glicóxeno fosforilase ten un fosfato de piridoxal (PLP, derivado da vitamina B6) en cada sitio catalítico ou activo. O fosfato de piridoxal está unido a residuos básicos (neste caso lisina, a Lys680) e forma por enlace covalente unha base de Schiff. Unha vez que se forma a base de Schiff, mantendo a molécula de PLP no sitio activo, o grupo fosfato do PLP (en vermello na figura) facilmente doa un protón a unha molécula de fosfato inorgánico (en verde), o que fai que o fosfato inorgánico sexa á súa vez desprotonado polo oxíxeno do enlace glicosídico α-1,4 (en azul). A doada desprotonación do PLP débese a que a súa carga negativa non está só estabilizada no grupo fosfato, senón tamén no anel de piridina, e así a base conxugada orixinada pola desprotonación do PLP é bastante estable. O oxíxeno (azul) protonado agora é un bo grupo saínte lábil (leaving group), e a cadea de glicóxeno sepárase da glicosa terminal nunha reacción SN1, orixinando a formación dunha molécula de glicosa cun carbocatión secundario na posición 1. Finalmente, o fosfato inorgánico desprotonado actúa como un nucleófilo e únese co carbocatión, formando glicosa 1-fosfato e unha cadea de glicóxeno cun residuo de glicosa menos. Na reacción libérase unha molécula de auga, pero non é unha hidrólise, senón unha fosforólise.
Propúxose tamén un mecanismo alternativo que implica a intervención dun oxíxeno cargado positivamente en conformación de media-cadeira.[3]
Estrutura
[editar | editar a fonte]O monómero da glicóxeno fosforilase é unha proteína grande de 842 aminoácidos cunha masa de 97.434 Da nas células musculares. O encima pode existir na súa forma inactiva como monómero ou tetrámero, pero a súa forma bioloxicamente activa é un dímero formado por dúas subunidades idénticas (homodímero).[4]

O dímero de glicóxeno fosforilase ten moitas rexións de importancia biolóxica, incluíndo os sitios catalíticos, os sitios de unión ao glicóxeno ("de almacenamento"), os sitios alostéricos, e un residuo de serina que pode ser fosforilado reversiblemente.
Os sitios catalíticos están relativamente enterrados dentro da molécula, a 15Å da superficie da proteína e da interface da subunidade.[5] Este difícil acceso ao sitio catalítico desde a superficie é significativo no sentido de que fai que a actividade da proteína sexa moi susceptible á regulación, xa que pequenos efectos alostéricos poderían incrementar moito o acceso relativo do glicóxeno ao sitio.
Quizais o sitio regulatorio máis importante é Ser14, o sitio onde se produce a fosforilación reversible moi próximo á interface da subunidade. O cambio estrutural asociado coa fosforilación, e coa conversión da fosforilase b en fosforilase a, é a disposición que adoptan os residuos 10 a 22 orixinalmente desordenados que pasan a formar α hélices. Este cambio incrementa a actividade fosforilase ata nun 25% mesmo en ausencia de AMP, e ademais potencia a activación feita polo AMP.[6]
O sitio alostérico para o AMP nas isoformas musculares deste encima está próxima á interface da subunidade, igual que a Ser14. Cando se une un AMP a este sitio, o que se corresponde cun cambio do estado T (tenso) do encima ao estado R (relaxado), orixina pequenos cambios na estrutura terciaria na interface da subunidade que causan grandes cambios na estrutura cuaternaria.[7] A unión do AMP fai rotar as rexións da molécula chamadas hélices torre (residuos 262-278) das dúas subunidades 50˚ unha en relación a outra por medio dun incremento na organización e interaccións entre as subunidades. Esta rotación das hélices torre causa a rotación das dúas subunidades uns 10˚ unha en relación a outra, e o que é máis importante, desordena os residuos 282-286 (o bucle 280s) que bloquea o acceso ao sitio catalítico no estado T pero non no estado R.[5]
O último sitio e quizais o máis peculiar da glicóxeno fosforilase é o chamado "sitio de almacenamento de glicóxeno". Esta estrutura está formada polos residuos 397-437, e permite que a proteína se una covalentemente á cadea de glicóxeno a uns 30 Å do sitio catalítico. Este sitio é moi probablemente o sitio no cal se une o encima aos gránulos de glicóxeno antes de iniciar a clivaxe das glicosas terminais. De feito, o 70% da fosforilase dimérica da célula está unida aos gránulos de glicóxeno en lugar de flotando libre no citoplasma.[8]
Nos mamíferos, os principais isoencimas da glicóxeno fosforilase encóntranse no músculo, fígado e cerebro. O tipo cerebral é o que predomina no cerebro adulto e nos tecidos embrionarios, e os tipos hepático e muscular son os predominantes no fígado adulto e músculo esquelético, respectivamente.[9]
Importancia clínica
[editar | editar a fonte]glicóxeno fosforilase; músculo
| |
| Identificadores | |
| Símbolo | PYGM |
| Entrez | 5837 |
| HUGO | 9726 |
| OMIM | |
| RefSeq | NM_005609 |
| UniProt | P11217 |
| Outros datos | |
| Número EC | 2.4.1.1 |
| Locus | Cr. 11 q12-q13.2 |
glicóxeno fosforilase; fígado
| |
| Identificadores | |
| Símbolo | PYGL |
| Entrez | 5836 |
| HUGO | 9725 |
| OMIM | |
| RefSeq | NM_002863 |
| UniProt | P06737 |
| Outros datos | |
| Número EC | 2.4.1.1 |
| Locus | Cr. 14 q11.2-24.3 |
glicóxeno fosforilase; cerebro
| |
| Identificadores | |
| Símbolo | PYGB |
| Entrez | 5834 |
| HUGO | 9723 |
| OMIM | |
| RefSeq | NM_002862 |
| UniProt | P11216 |
| Outros datos | |
| Número EC | 2.4.1.1 |
| Locus | Cr. 20 p11.2-p11.1 |
Propúxose utilizar a inhibición da glicóxeno fosforilase como un método para o tratamento da diabetes tipo 2.[10] Como a produción de glicosa no fígado viuse que se incrementa nos pacientes con diabetes tipo 2,[11] a inhibición da liberación de glicosa da reserva de glicóxeno hepática pode ser un bo tratamento. A clonación da glicóxeno fosforilase hepática humana (HLGP) revelou un novo sitio de unión alostérica preto da interface da subunidade, que non está presente na glicóxeno fosforilase muscular de coello (RMGP) utilizada normalmente nos estudos. Este sitio non era sensible aos mesmos inhibidores ca o sitio alostérico para o AMP,[12] e o maior éxito na inhibición conseguiuse sintetizando novos inhibidores que imitan a estrutura da glicosa, xa que a glicosa 6-fosfato é un inhibidor coñecido da HLPG e estabiliza o estado T, que é menos activo.[13] Estes derivados da glicosa tiveron algún éxito inhibindo a HLPG, cuns baixos valores preditos de Ki de 0,016 mM.[14]
As mutacións na isoforma do músculo (PYGM) están asociadas coa enfermidade de McArdle (enfermidade de almacenamento de glicóxeno tipo V). Identificáronse ata agora máis de 65 mutacións no xene da PYGM que orixinan a enfermidade de McArdle.[15][16] Entre os síntomas da enfermidade de McArdle están a debilidade muscular, mialxia, e falta de resistencia, todos debidos aos baixos niveis de glicosa no tecido muscular.[17]
As mutacións na isoforma hepática da glicóxeno fosforilase (PYGL) están asociadas coa enfermidade de Hers (enfermidade de almacenamento de glicóxeno de tipo VI).[18][19] A enfermidade de Hers está a miúdo asociada con síntomas leves normalmente limitados a hipoglicemia, e ás veces é difícil de diagnosticar debido á actividade encimática residual.[20]
A isoforma cerebral da glicóxeno fosforilase (PYGLB) propúxose como biomarcador do cancro de estómago.[21]
Regulación
[editar | editar a fonte]A glicóxeno fosforilase está regulada por control alostérico e por fosforilación.
Hormonas como a adrenalina (epinefrina), a insulina e o glicagón regulan a glicóxeno fosforilase utilizando sistemas de amplificación de segundo mensaxeiro que están asociados a proteínas G. A adrenalina activa a adenilato ciclase por medio dun receptor acoplado á proteína G, que á súa vez activa a adenilato ciclase facendo incrementar as concentracións celulares de AMP cíclico (AMPc). O AMPc únese (e despois libérase) a unha forma activa de proteína quinase A (PKA). Despois, a proteína quinase A fosforila a fosforilase quinase, que á súa vez fosforila a glicóxeno fosforilase b, transformándoa na glicóxeno fosforilase a activa. Esta fosforilación realízase sobre a serina 14 da glicóxeno fosforilase b. No fígado, o glicagón activa outro receptor acoplado á proteína G que desencadea outra cascada de reaccións diferente, causando a activación da fosfolipase C (PLC). A fosfolipase C causa indirectamente a liberación de calcio do retículo endoplasmático dos hepatocitos no citosol. O aumento da dispoñibilidade de calcio fai que este se una á subunidade calmodulina e active a glicóxeno fosforilase quinase. A glicóxeno fosforilase quinase activa a glicóxeno fosforilase da mesma maneira mencionada previamente.
A glicóxeno fosforilase b non sempre é inactiva no músculo, xa que pode activarse alostericamente polo AMP. Un incremento na concentración de AMP, como a que ten lugar durante o exercicio extenuante, indica que hai unha gran demanda de enerxía. O AMP activa a glicóxeno fosforilase b cambiándolle a súa conformación desde unha forma tensa a unha forma relaxada. Esta forma relaxada ten propiedades encimáticas similares á do encima fosforilado. Un incremento na concentración de ATP oponse a esta activación ao desprazar o AMP do sitio de unión para o nucleótido no encima, indicando que hai reservas de enerxía dabondo.
Despois de comer hai unha liberación de insulina, o que indica que hai unha gran cantidade de glicosa no sangue. A insulina activa indirectamente a PP-1 e a fosfodiesterase. A proteína fosfatase 1 (PP-1) desfosforila directamente a glicóxeno fosforilase a, volvendo a orixinarse a glicóxeno fosforilase b inactiva. A fosfodiesterase converte o AMPc en AMP. Esta actividade elimina o segundo mensaxeiro (xerado polo glicagón e a adrenalina) e inhibe a proteína quinase A. Deste xeito, a proteína quinase A xa non pode causar a cascada de fosforilación que acaba coa formación de glicóxeno fosforilase a (activa). Estas modificacións iniciadas pola insulina deteñen a glicoxenólise para preservar as reservas de glicóxeno que quedan na célula e desencadear a glicoxenoxénese (formación de glicóxeno).
As fosforilases a e b poden existir en dúas formas, unha delas o estado T (tenso) inactivo e a outra o estado R (relaxado). A fosforilase b está normalmente no estado T, inactiva debido á presenza fisiolóxica de ATP e glicosa 6-fosfato, e a fosforilase a está normalmente no estado R (activa).
No fígado existe un isoencima da glicóxeno fosforilase sensible ás concentracións de glicosa, xa que o fígado actúa como exportador de glicosa. En esencia, a fosforilase do fígado é sensible á glicosa, o que causa unha transición moi sensible da forma R á T, inactivándoa; ademais, a fosforilase hepática é insensible ao AMP.
Importancia histórica
[editar | editar a fonte]A glicóxeno fosforilase foi o primeiro encima alostérico que se descubriu.[7] Este gran descubrimento foi un dos varios realizados por Carl e Gerty Cori. En 1943, coa axuda de Arda Green, determinaron que a glicóxeno fosforilase existía en dúas formas, a e b, dependendo do seu estado de fosforilación, e nos estados R ou T baseándose na presenza de AMP.[22]
Notas
[editar | editar a fonte]- ↑ PDB 3E3N
- ↑ 2,0 2,1 Livanova NB, Chebotareva NA, Eronina TB, Kurganov BI (2002). "Pyridoxal 5′_Phosphate as a Catalytic and Conformational Cofactor of Muscle Glycogen Phosphorylase b". Biochemistry (Moscow) 67 (10): 1089–1998. PMID 12460107. doi:10.1023/A:1020978825802.
- ↑ Palm D, Klein HW, Schinzel R, Buehner M, Helmreich, EJM (1990). "The role of pyridoxal 5'-phosphate in glycogen phosphorylase catalysis". Biochemistry 29 (5): 1099–1107. PMID 2182117. doi:10.1021/bi00457a001.
- ↑ Browner MF, Fletterick RJ (1992). "Phosphorylase: a biological transducer". Trends in Biochemical Science 17 (2): 66–71. PMID 1566331. doi:10.1016/0968-0004(92)90504-3.
- ↑ 5,0 5,1 Johnson LN (1992). "Glycogen phosphorylase: control by phosphorylation and allosteric effectors". FASEB Journal 6 (6): 2274–82. PMID 1544539.
- ↑ Newgard CB, Hwang PK, Fletterick, RJ (1989). "The family of glycogen phosphorylases: structure and function". Critical Reviews Biochemistry and Molecular Biology 24 (1): 69–99. PMID 2667896. doi:10.3109/10409238909082552.
- ↑ 7,0 7,1 Johnson LN, Barford, D (1990). "Glycogen phosphorylase. The structural basis of the allosteric response and comparison with other allosteric proteins.". Journal of Biological Chemistry 265 (5): 2409–2412. PMID 2137445.
- ↑ Meyer F, Heilmeyer LM Jr, Haschke RH, Fischer EH (1970). "Control of phosphorylase activity in a muscle glycogen particle. I. Isolation and characterization of the protein-glycogen complex". Journal of Biological Chemistry 245 (24): 6642–6648. PMID 4320610.
- ↑ David ES, Crerar MM (1986). "Quantitation of muscle glycogen phosphorylase mRNA and enzyme amounts in adult rat tissues". Biochim. Biophys. Acta 880 (1): 78–90. PMID 3510670.
- ↑ Somsák L, Nagya V, Hadady Z, Docsa T, Gergely P. (2003). "Glucose analog inhibitors of glycogen phosphorylases as potential antidiabetic agents: recent developments". Current Pharmacological Design 9 (15): 1177–89. PMID 12769745. doi:10.2174/1381612033454919.
- ↑ Moller DE (2001). "New drug targets for type 2 diabetes and the metabolic syndrome". Nature 414 (6865): 821–7. PMID 11742415. doi:10.1038/414821a.
- ↑ Coats WS, Browner MF, Fletterick RJ, Newgard CB (1991). "An engineered liver glycogen phosphorylase with AMP allosteric activation". Journal of Biological Chemistry 266 (24): 16113–9. PMID 1874749.
- ↑ Oikonomakos NG, Kontou M, Zographos SE, Tsitoura HS, Johnson LN, Watson KA, Mitchell EP, Fleet GW, Son JC, Bichard CJ; et al. (1994). "The design of potential antidiabetic drugs: experimental investigation of a number of beta-D-glucose analogue inhibitors of glycogen phosphorylase". European Journal of Drug Metabolism and Pharmacology 19 (3): 185–92. PMID 7867660. doi:10.1007/BF03188920.
- ↑ Hopfinger A J, Reaka A, Venkatarangan P, Duca J S, Wang S. (1999). "Prediction of Ligand−Receptor Binding Free Energy by 4D-QSAR Analysis: Application to a Set of Glucose Analogue Inhibitors of Glycogen Phosphorylase". Journal of Chemical Information and Computer Science 39: 1141–1150. doi:10.1021/ci9900332.
- ↑ Nogales-Gadea G, Arenas J, Andreu AL (2007). "Molecular genetics of McArdle's disease". Curr Neurol Neurosci Rep 7 (1): 84–92. PMID 17217859. doi:10.1007/s11910-007-0026-2.
- ↑ Andreu AL, Nogales-Gadea G, Cassandrini D, Arenas J, Bruno C (2007). "McArdle disease: molecular genetic update". Acta Myol 26 (1): 53–7. PMID 17915571.
- ↑ Grünfeld JP, Ganeval D, Chanard J, Fardeau M, Dreyfus JC (1972). "Acute renal failure in McArdle's disease. Report of two cases". New England Journal of Medicine 286 (23): 1237–41. PMID 4502558. doi:10.1056/NEJM197206082862304.
- ↑ Burwinkel B, Bakker HD, Herschkovitz E, Moses SW, Shin YS, Kilimann MW (1998). "Mutations in the liver glycogen phosphorylase gene (PYGL) underlying glycogenosis type VI". Am. J. Hum. Genet. 62 (4): 785–91. PMC 1377030. PMID 9529348. doi:10.1086/301790.
- ↑ Chang S, Rosenberg MJ, Morton H, Francomano CA, Biesecker LG (1998). "Identification of a mutation in liver glycogen phosphorylase in glycogen storage disease type VI". Hum. Mol. Genet. 7 (5): 865–70. PMID 9536091. doi:10.1093/hmg/7.5.865.
- ↑ Tang NL, Hui J, Young E, Worthington V, To KF, Cheung KL, Li CK, Fok TF (2003). "A novel mutation (G233D) in the glycogen phosphorylase gene in a patient with hepatic glycogen storage disease and residual enzyme activity". Molecular Genetics and Metabolism 79 (2): 142–145. PMID 12809646. doi:10.1016/S1096-7192(03)00068-4.
- ↑ Shimada S, Matsuzaki H, Marutsuka T, Shiomori K, Ogawa M (2001). "Gastric and intestinal phenotypes of gastric carcinoma with reference to expression of brain (fetal)-type glycogen phosphorylase". J. Gastroenterol. 36 (7): 457–64. PMID 11480789. doi:10.1007/s005350170068.
- ↑ Cori GT, Green AA (1943). "Crystalline muscle phosphorylase II prosthetic group". Journal of Biological Chemistry 151 (1): 21–29. Arquivado dende o orixinal o 27 de abril de 2017. Consultado o 29 de agosto de 2012.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Voet, Judith G.; Voet, Donald (1995). "Chapter 17: Glycogen Metabolism". Biochemistry (2nd ed.). New York: J. Wiley & Sons. ISBN 0-471-58651-X.
- Voet, Judith G.; Voet, Donald (2004). "Chapter 18: Glycogen Metabolism". Biochemistry (3rd ed.). New York: J. Wiley & Sons. ISBN 0-471-19350-X.
Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- GeneReviews/NCBI/NIH/UW entry on Glycogen Storage Disease Type VI - Hers disease
- Diwan JJ. "Glycogen Metabolism". Molecular Biochemistry I. Rensselaer Polytechnic Institute. Arquivado dende o orixinal o 25 de xaneiro de 2009. Consultado o 2009-01-10.
- Goodsell DS (2001-12-01). "Glycogen Phosphorylase". Molecule of the Month. RCSB Protein Data Bank. Arquivado dende o orixinal o 21 de xullo de 2010. Consultado o 2009-01-10.


