Condensina

As condensinas son grandes complexos de proteínas que desempeñan un papel central na ensamblaxe dos cromosomas e na súa segregación durante a mitose e meiose.[1][2]
Composición das subunidades[editar | editar a fonte]
Condensinas eucarióticas[editar | editar a fonte]

Moitas células eucarióticas posúen dous tipos de complexos de condensinas, chamadas condensina I e condensina II, cada un dos cales está composto por cinco subunidades.[3][4] As condensinas I e II comparten o mesmo par de subunidades centrais ou core, SMC2 e SMC4, que pertencen ambas á gran familia das ATPases cromosómicas chamadas proteínas SMC (SMC significa Structural Maintenance of Chromosomes, Mantemento estrutural dos cromosomas). Cada un destes complexos contén un conxunto distinto de subunidades reguladoras non SMC (unha subunidade kleisina[5] e un par de subunidades de repetición HEAT[6]). O nematodo Caenorhabditis elegans posúe un terceiro complexo (estreitamente relacionado coa condensina I) que participa na regulación xénica a escala cromosómica, é dicir, na compensación de dose.[7] Neste complexo, coñecido como condensina IDC, a auténtica subunidade SMC4 é substituída pola súa variante DPY-27.
| Complexo | Subunidade | Clasificación | S. cerevisiae | S. pombe | C. elegans | D. melanogaster | Vertebrados (xenes humanos) |
|---|---|---|---|---|---|---|---|
| condensina I & II | SMC2 | ATPase | Smc2 | Cut14 | MIX-1 | DmSmc2 | CAP-E (SMC2) |
| condensina I & II | SMC4 | ATPase | Smc4 | Cut3 | SMC-4 | DmSmc4 | CAP-C (SMC4) |
| condensina I | CAP-D2 | HEAT | Ycs4 | Cnd1 | DPY-28 | CG1911 | CAP-D2 (NCAPD2) |
| condensina I | CAP-G | HEAT | Ycg1 | Cnd3 | CAP-G1 | cap-g | CAP-G (NCAPG) |
| condensina I | CAP-H | kleisina | Brn1 | Cnd2 | DPY-26 | barren | CAP-H (NCAPH) |
| condensina II | CAP-D3 | HEAT | - | - | HCP-6 | CG31989 | CAP-D3 (NCAPD3) |
| condensina II | CAP-G2 | HEAT | - | - | CAP-G2 | -? | CAP-G2 (NCAPG2) |
| condensina II | CAP-H2 | kleisina | - | - | KLE-2 | CG14685 | CAP-H2 (NCAPH2) |
| condensina IDC | variante SMC4 | ATPase | - | - | DPY-27 | - | - |
A estrutura e función da condensina I foron conservadas desde os lévedos aos humanos, pero os lévedos carecen de condensina II.[8][9] Non hai relación aparente entre a presenza de condensina II e o tamaño dos xenomas eucarióticos. De feito, a alga vermella primitiva Cyanidioschyzon merolae ten tanto condensina I coma II, aínda que o tamaño do seu xenoma é pequeno e comparable ao dos lévedos.[10]
Condensinas procarióticas[editar | editar a fonte]
As especies procarióticas tamén tañen complexos similares a condensinas que xogan un importante papel na organización e segregación do cromosoma. As condensinas procarióticas poden clasificarse en dous tipos: SMC-ScpAB[11] e MukBEF.[12] Moitas especies de eubacterias e arqueas teñen SMC-ScpAB, mentres que un grupo de eubacterias (as Gammaproteobacteria) teñen MukBEF.
| Complexo | Subunidade | Clasificación | B. subtilis | Caulobacter | E.coli |
|---|---|---|---|---|---|
| SMC-ScpAB | SMC | ATPase | SMC/BsSMC | SMC | - |
| SMC-ScpAB | ScpA | kleisina | ScpA | ScpA | - |
| SMC-ScpAB | ScpB | ? | ScpB | ScpB | - |
| MukBEF | MukB | ATPase | - | - | MukB |
| MukBEF | MukE | ? | - | - | MukE |
| MukBEF | MukF | kleisina | - | - | MukF |
Mecanismos moleculares[editar | editar a fonte]
Actividades moleculares[editar | editar a fonte]
A condensina I purificada introduce unha tensión positiva na superhélice do ADN bicatenario dunha maneira dependente da hidrólise do ATP.[13] Tamén presenta unha actividade de ATPase estimulada polo ADN in vitro. Os dímeros de SMC2-SMC4 teñen a capacidade de realiñar (reanneal) ADNs monocatenarios complementarios.[14] Esta actividade non require ATP.
Estruturas moleculares[editar | editar a fonte]
Os dímeros SMC que actúan como subunidades centrais das condensinas mostran unha característica forma en V (ver proteína SMC).[15] O holocomplexo de condensina I foi observado con microscopio electrónico.[16]
Funcións mitóticas[editar | editar a fonte]
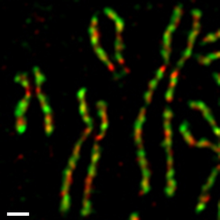
En células cultivadas de tecidos humanos, os dous complexos condensinas son regulados de forma diferencial durante o ciclo celular.[17][18] A condensina II está presente no núcleo celular durante a interfase e está implicado nunha etapa temnperá da condensación do cromosoma no núcleo en profase. Por outra parte, a condensina I está presente no citoplasma durante a interfase, e só pode acceder aos cromosomas despois de que rompe a envoltura nuclear ao final da profase. Durante a prometafase e metafase, tanto a condensina I coma a II contribúen á ensamblaxe de cromosomas condensados, que constan de dúas cromátides irmás.[4] Os dous complexos permanecen asociados aparentemente cos cromosomas despois de que as cromátides irmás se separan unha da outra na anafase. Sábese que polo menos unha das subunidades da condensina I é unha diana directa dunha quinase dependente de ciclina (Cdk).[19]
Funcións cromosómicas non mitóticas[editar | editar a fonte]
En recentes estudos atopouse que as condensinas participan nunha ampla variedade de funcións cromosómicas que non forman parte da mitose ou meiose. No lévedo de xemación, por exemplo, a condensina I (a única condensina deste organismo) está implicada na regulación do número de copias da repetición do ADNr[20] e no agrupamento dos xenes de ARNt.[21] En Drosophila, as subunidades da condensina II contribúen á disolución dos cromosomas politénicos[22] e á formación de territorios cromosómicos [23] en células nutricias do ovario. Tamén hai probas de que regulan negativamente a transvección en células diploides. Na planta Arabidopsis thaliana, a condensina II é esencial para a tolerancia ao exceso de estrés por boro, posiblemente porque alivia os danos no ADN.[24] En células humanas a contribución da condensina II para resolver as cromátides irmás iníciase xa na fase S da interfase.[25]
Proteínas relacionadas[editar | editar a fonte]
As células eucarióticas teñen dúas clases adicionais de complexos de proteínas SMC. A cohesina contén SMC1 e SMC3 e está implicada na cohesión de cromátides irmás. O complexo SMC5/6 contén SMC5 e SMC6 e está implicado na reparación recombinacional.
Notas[editar | editar a fonte]
- ↑ Hirano T (2012). "Condensins: universal organizers of chromosomes with diverse functions". Genes Dev 26 (15): 1659–1678. PMC 3418584. PMID 22855829. doi:10.1101/gad.194746.112.
- ↑ Wood AJ, Severson, AF, Meyer BJ (2010). "Condensin and cohesin complexity: the expanding repertoire of functions". Nat Rev Genet 11 (6): 391–404. PMC 3491780. PMID 20442714. doi:10.1038/nrg2794.
- ↑ Hirano T, Kobayashi R, Hirano M. (1997). "Condensins, chromosome condensation complex containing XCAP-C, XCAP-E and a Xenopus homolog of the Drosophila Barren protein". Cell 89 (4): 511–21. PMID 9160743. doi:10.1016/S0092-8674(00)80233-0.
- ↑ 4,0 4,1 Ono T, Losada A, Hirano M, Myers MP, Neuwald AF, Hirano T. (2003). "Differential contributions of condensin I and condensin II to mitotic chromosome architecture in vertebrate cells". Cell 115 (1): 109–21. PMID 14532007. doi:10.1016/S0092-8674(03)00724-4.
- ↑ Schleiffer A, Kaitna S, Maurer-Stroh S, Glotzer M, Nasmyth K, Eisenhaber F. (2003). "Kleisins: a superfamily of bacterial and eukaryotic SMC protein partners". Mol. Cell 11 (3): 571–5. PMID 12667442. doi:10.1016/S1097-2765(03)00108-4.
- ↑ Neuwald AF, Hirano T. (2000). "HEAT repeats associated with condensins, cohesins, and other complexes involved in chromosome-related functions". Genome Res. 10 (10): 1445–52. PMID 11042144. doi:10.1101/gr.147400.
- ↑ Csankovszki G, Collette K, Spahl K, Carey J, Snyder M, Petty E, Patel U, Tabuchi T, Liu H, McLeod I, Thompson J, Sarkeshik A, Yates J, Meyer BJ, Hagstrom K. (2009). "Three distinct condensin complexes control C. elegans chromosome dynamics". Curr. Biol. 19 (1): 9–19. PMID 19119011. doi:10.1016/j.cub.2008.12.006.
- ↑ Sutani T, Yuasa T, Tomonaga T, Dohmae N, Takio K, Yanagida M. (1999). "Fission yeast condensin complex: essential roles of non-SMC subunits for condensation and Cdc2 phosphorylation of Cut3/SMC4". Genes Dev. 13 (17): 2271–83. PMID 10485849. doi:10.1101/gad.13.17.2271.
- ↑ Freeman L, Aragon-Alcaide L, Strunnikov A. (2000). "The condensin complex governs chromosome condensation and mitotic transmission of rDNA". J. Cell Biol. 149 (4): 811–824. PMID 10811823. doi:10.1083/jcb.149.4.811.
- ↑ Fujiwara T, Tanaka K, Kuroiwa T, Hirano T. (2013). "Spatiotemporal dynamics of condensins I and II: evolutionary insights from the primitive red alga Cyanidioschyzon merolae". Mol. Biol. Cell. 24 (16): 2515–27. PMID 23783031. doi:10.1091/mbc.E13-04-0208.
- ↑ Mascarenhas J, Soppa J, Strunnikov AV, Graumann PL. (2002). "Cell cycle-dependent localization of two novel prokaryotic chromosome segregation and condensation proteins in Bacillus subtilis that interact with SMC protein". EMBO J. 21 (12): 3108–18. PMID 12065423. doi:10.1093/emboj/cdf314.
- ↑ Yamazoe M, Onogi T, Sunako Y, Niki H, Yamanaka K, Ichimura T, Hiraga S. (1999). "Complex formation of MukB, MukE and MukF proteins involved in chromosome partitioning in Escherichia coli". EMBO J. 18 (21): 5873–84. PMID 10545099. doi:10.1093/emboj/18.21.5873.
- ↑ Kimura K, Hirano T. (1997). "ATP-dependent positive supercoiling of DNA by 13S condensin: a biochemical implication for chromosome condensation". Cell 90 (4): 625–634. PMID 9288743. doi:10.1016/s0092-8674(00)80524-3.
- ↑ Sutani T, Yanagida M. (1997). "DNA renaturation activity of the SMC complex implicated in chromosome condensation". Nature 388 (6644): 798–801. PMID 9285594. doi:10.1038/42062.
- ↑ Melby TE, Ciampaglio CN, Briscoe G, Erickson HP. (1998). "The symmetrical structure of structural maintenance of chromosomes (SMC) and MukB proteins: long, antiparallel coiled coils, folded at a flexible hinge". J. Cell Biol. 142 (6): 1595–1604. PMID 9744887. doi:10.1083/jcb.142.6.1595.
- ↑ Anderson DE, Losada A, Erickson HP, Hirano T. (2002). "Condensin and cohesin display different arm conformations with characteristic hinge angles". J. Cell Biol. 156 (6): 419–424. PMID 11815634. doi:10.1083/jcb.200111002.
- ↑ Ono T, Fang Y, Spector DL, Hirano T (2004). "Spatial and temporal regulation of Condensins I and II in mitotic chromosome assembly in human cells". Mol. Biol. Cell 15 (7): 3296–308. PMID 15146063. doi:10.1091/mbc.E04-03-0242.
- ↑ Hirota T, Gerlich D, Koch B, Ellenberg J, Peters JM (2004). "Distinct functions of condensin I and II in mitotic chromosome assembly". J. Cell Sci. 117 (Pt 26): 6435–45. PMID 15572404. doi:10.1242/jcs.01604.
- ↑ Kimura K, Hirano M, Kobayashi R, Hirano T (1998). "Phosphorylation and activation of 13S condensin by Cdc2 in vitro". Science 282 (5388): 487–490. PMID 9774278. doi:10.1126/science.282.5388.487.
- ↑ Johzuka K, Terasawa M, Ogawa H, Ogawa T, Horiuchi T (2006). "Condensin loaded onto the replication fork barrier site in the rRNA gene repeats during S phase in a FOB1-dependent fashion to prevent contraction of a long repetitive array in Saccharomyces cerevisiae.". Mol Cell Biol. 26 (6): 2226–2236. PMID 16507999. doi:10.1128/MCB.26.6.2226-2236.2006.
- ↑ Haeusler RA, Pratt-Hyatt M, Good PD, Gipson TA, Engelke DR (2008). "Clustering of yeast tRNA genes is mediated by specific association of condensin with tRNA gene transcription complexes.". Genes Dev. 22 (16): 2204–2214. PMID 18708579. doi:10.1101/gad.1675908.
- ↑ Hartl TA, Smith HF, Bosco G (2008). "Chromosome alignment and transvection are antagonized by condensin II.". Science 322 (5906): 1384–1387. PMID 19039137. doi:10.1126/science.1164216.
- ↑ Bauer CR, Hartl TA, Bosco G. (2012). "Condensin II promotes the formation of chromosome territories by inducing axial compaction of polyploid interphase chromosomes.". PLoS Genet 8 (8): e1002873. PMID 22956908. doi:10.1371/journal.pgen.1002873.
- ↑ Sakamoto T, Inui YT, Uraguchi S, Yoshizumi T, Matsunaga S, Mastui M, Umeda M, Fukui K, Fujiwara T. (2011). "Condensin II alleviates DNA damage and is essential for tolerance of boron overload stress in Arabidopsis.". Plant cell 23 (9): 3533–3546. PMID 21917552. doi:10.1105/tpc.111.086314.
- ↑ Ono T, Yamashita D, Hirano T (2013). "Condensin II initiates sister chromatid resolution during S phase". J. Cell Biol. 200 (4): 429–441. PMID 23401001. doi:10.1083/jcb.201208008.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
| Commons ten máis contidos multimedia sobre: Condensina |
- condensin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
