Anfipático
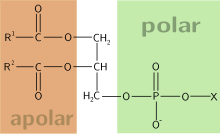
Un composto anfipático ou anfifílico é aquel que posúe unha parte hidrofílica ou polar (con afinidade pola auga) e unha parte hidrofóbica ou apolar (sen afinidade pola auga). A parte hidrófila formará pontes de hidróxeno coa auga, e a hidrófoba non. Exemplos de substancias anfipáticas son os xabóns e deterxentes ou os fosfolípidos das membranas biolóxicas.
O carácter anfipático dalgunhas moléculas é a base de certas áreas da química e bioquímica, como o estudo do polimorfismo de lípidos. Os compostos orgánicos que conteñen grupos hidrofílicos en ambos os extremos dunha cadea hidrocarbonada bastante longa denomínanse bolaanfifílicos; a presenza dos dous extremos hidrófilos aumenta a súa solubilidade.
Estrutura e propiedades
[editar | editar a fonte]O grupo hidrófobo das moléculas anfipáticas é tipicamente unha grande cadea hidrocarbonada, da forma CH3(CH2)n, con n > 4. O grupo hidrófilo dunha molécula anfipática pode pertencer a algunha das seguintes categorías:
- Grupos cargados
- Aniónicos. Exemplos, coa parte hidrófoba da molécula representada por R, son:
- carboxilatos: RCO2−;
- sulfatos: RSO4−;
- sulfonatos: RSO3−.
- fosfatos: Son o grupo funcional cargado negativamente nos fosfolípidos (xunto con outras posibles cabezas polares cargadas positivamente, como a colina, ou positiva e negativamente, como a serina).
- Catiónicos. Exemplos:
- Certas aminas: RNH3+.
- Aniónicos. Exemplos, coa parte hidrófoba da molécula representada por R, son:
- Grupos polares neutros. Exemplos son alcohois unidos a cadeas hidrocarbonadas longas, como os diacilglicéridos, e os oligoetilenglicois con longas cadeas alquilo.
Ás veces, os compostos anfipáticos teñen varias partes hidrofóbicas, varias hidrofílicas ou varias de ambas. As proteínas e algúns copolímeros en bloques son exemplos.
Como resultado de ter unha parte hidrófila e outra hidrófoba, algúns compostos anfipáticos poden disolverse en auga e en certa medida en solventes apolares. Os compostos anfipáticos disólvense formando micelas.
Cando se sitúan nun sistema inmiscible bifásico formado por un solvente acuoso e outro orgánico, o composto anfipático particiónase nas dúas fases. A extensión das porcións hidrofílicas e hidrofóbicas determina a extensión do particionamento.
Exemplos de compostos anfipáticos
[editar | editar a fonte]Hai moitos exemplos de moléculas que presentan propiedades anfifílicas ou anfipáticas:
Os surfactantes baseados en cadeas hidrocarbonadas son un exemplo. A súa rexión polar ou hidrófila pode ser iónica ou neutra. Algúns son: dodecilsulfato sódico (aniónico), cloruro de benzalconio (catiónico), cocamidopropilbetaína (zwitteriónica) e o octanol (alcohol de cadea longa neutro).
Moitos compostos biolóxicos son anfipáticos, como: fosfolípidos, colesterol, glicolípidos, ácidos graxos, ácidos biliares, saponinas etc.
Funcións biolóxicas
[editar | editar a fonte]
Os fosfolípidos, un tipo de moléculas anfipáticas, son os principais compoñentes das membranas celulares. A súa natureza anfipática determina o modo en que se forman as membranas. Dispóñense en bicapas lipídicas, nas que os seus grupos polares se sitúan nas partes externas da membrana, en contacto co medio acuoso, e as súas cadeas hidrófobas sitúanse na parte interna da bicapa, lonxe do contacto coa auga. Deste xeito, a membrana consta dunha rexión apolar central situada entre dúas rexións polares.
Ademais dos fosfolípidos, nas membranas atopamos tamén outras moléculas anfipáticas, como o colesterol e os glicolípidos, que se dan á membrana propiedades físicas e biolóxicas especiais.
Moitas outras substancias anfipáticas, como as pepducinas [1], interaccionan fortemente coas membranas biolóxicas ao inserir a súa porción hidrofóbica dentro das membranas, e expoñer a súa porción hidrofílica ao medio acuoso, alterando o seu comportamenteo físico e ás veces interrompéndoas.
Aplicacións
[editar | editar a fonte]As principais aplicacións son:
- Os xabóns están baseados nas propiedades anfipáticas dos ácidos graxos ionizados que conteñen. A parte hidrófila ou lipófila únese ás moléculas orgánicas, que doutro modo son insolubles en auga, e a parte hidrófila queda no exterior e a auga arrastra a partícula, producindo o lavado.
- Son tensoactivos que poden reforzar as interfaces entre dous medios, para crear por exemplo burbullas de xabón, as cales están formadas por finas capas de auga entre dúas capas de xabón. A parte hidrófila do xabón encerra a auga no grosor da parede da burbulla, entanto que a parte hidrófila, que mira ao exterior, forma unha membrana relativemente forte, sostida polas forzas de London.
- Son bos co-solventes, que permiten mesturar na mesma solución moléculas hidrófilas e hidrófobas para facelas reaccionar. Por exemplo permiten facer reaccionar ións (pouco solubles en medios orgánicos pouco polares, e moi solubles en auga) e grandes moléculas orgánicas insolubles en auga. Nesta tarefa son imprescindibles en química.
- Estase investigando na creación de moléculas que poidan incorporar no interior da súa estrutura fármacos encapsulados, como o son os polímeros cristal-líquido colestéricos. Ditos polímeros poden transportar e atrapar moléculas de menor tamaño grazas ás súas moléculas anfifílicas que se autoasocian. Actualmente o seu estudo baséase no transporte de fármacos específicos e biomacromoléculas.[2]
- As propiedades das moléculas anfipáticas probablemente xogaron un papel moi importante na aparición da vida na Terra, facilitando a formación das primeiras membranas prebióticas.
Notas
[editar | editar a fonte]- ↑ Bibliografía Pepducin Arquivado 11 de novembro de 2011 en Wayback Machine. (en inglés)
- ↑ Aplicaciones biomédicas de los polímeros [1] Arquivado 20 de xullo de 2011 en Wayback Machine. (en castelán)
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Bohinski, Robert C. “Bioquímica”. Editorial Adisson Wesley. Quinta edición. Páx: 40 – 46
- Nelson, David L. COX, Michael. “Principios de Bioquímica” Edicións Omega. Terceira edición. Páx: 86 – 90, 392 – 395.
- Torres, Héctor N. “Bioquímica General”. Editorial El Ateneo. Páx: 85 – 90.
- Nelson, Philip. “Física Biológica: energía, información y vida”. Editorial Reverté. 2005. Páx: 317 – 364.
- J. M. Seddon, R. H. Templer. Polymorphism of Lipid-Water Systems, from the Handbook of Biological Physics, Vol. 1, ed. R. Lipowsky, and E. Sackmann. (c) 1995, Elsevier Science B.V. ISBN 0-444-81975-4
