Zona pelúcida

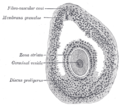
A zona pelúcida é unha capa de glicoproteína que rodea a membrana plasmática dos ovocitos de mamíferos. É unha parte constitutiva vital do ovocito. A zona pelúcida aparece primeiro nos ovocitos primarios unilaminares. Segrégana tanto o propio ovocito coma as células dos folículos ováricos. A zona pelúcida está rodeada polo cúmulo oóforo. O cúmulo está composto por células que protexen o ovo cando este é expulsado do ovario.[1] A zona pelúcida é esencial para o crecemento do ovocito e a fecundación.
Esta estrutura únese aos espermatozoides, e requírese para iniciar a reacción acrosómica. No rato (o sistema de mamíferos mellor estudado), a glicoproteína da zona, ZP3, é responsable da unión do espermatozoide, adheríndose a proteínas da membrana plasmática do espermatozoide. A ZP3 intervén despois na indución da reacción acrosómica, na cal o espermatozoide libera o contido da súa vesícula acrosómica. A caracterización exacta do que ocorre noutras especies é máis complicada porque nelas se identificaron máis proteínas da zona.[2][3]
En humanos, cinco días despois da fertilización, o blastocisto realiza a eclosión da zona; a zona pelúcida dexenera e descomponse, para ser substituída pola capa subxacente de células trofoblásticas.
Estrutura
[editar | editar a fonte]A zona pelúcida é unha matriz translúcida de glicoproteínas que rodea o ovocito de mamíferos, cuxa formación é esencial para a fecundación (fusión de óvulo e espermatozoide).[4] En animais non mamíferos denomínase membrana vitelina ou envoltura vitelina.[5]
Función
[editar | editar a fonte]A grosa membrana da zona pelúcida funciona permitindo a fecundación específica de especie, impedindo a polispermia e permitindo a reacción acrosómica para que se produza unha adhesión e penetración exitosa do espermatozoide. As principais glicoproteínas da cuberta do ovo denomínanse proteínas de unión aos espermatozoides.[6]
As catro principais proteínas de unión ao espermatozoide ou receptores do esperma, son: ZP1, ZP2, ZP3 e ZP4. Únense aos espermatozoiddes capacitados e inducen a reacción acrosómica. Unha correcta fecundación depende da capacidade do espermatozoide de penetrar a matriz extracelular da zona pelúcida que rodea o ovo. No rato:
- A ZP3 permite a unión de espermatozoides específica de especie.
- A ZP2 media a unión do espermatozoide.
- A ZP1 establece enlaces cruzados con ZP2 e ZP3.
Non se dispón actualmente de datos das proteínas humanas nativas equivalentes.
Inmunocontracepción
[editar | editar a fonte]As glicoproteínas que conteñen o módulo ZP, como ZP1, ZP2, ZP3 e ZP4 son dianas para a inmunocontracepción en mamíferos.
En animais non mamíferos a zona pelúcida denomínase envoltura ou membrana vitelina, e en insectos envoltura vitelina, e xoga un importante papel na prevención da hibridación entre distintas especies, especialmente en especies como as de peixes que realizan a fecundación fóra do corpo.
A zona pelúcida utilízase comunmente para o control das poboacións de animais silvestres por medio da inmunocontracepción. Cando a zona pelúcida dunha especie animal é inxectada na corrente circulatoria doutra especie, orixina esterilidade nos individuos da segunda especie debido á resposta inmune. Este efecto pode ser temporal ou permanente, dependendo do método utilizado. Un exemplo do uso da inmunocontracepción foi un ensaio para o control de cervos na natureza feito en Nova Jersey usando a zona pelúcida porcina.[7]
Galería
[editar | editar a fonte]-
Primeiros estados de segmentación do ovo de mamíferos
-
Sección dun folículo ovárico vesicular de gato, x 50
-
Estadios iniciais da embrioxénese humana
Notas
[editar | editar a fonte]- ↑ Gilbert, Scott (2013). Developmental Biology. Sinauer Associates Inc. p. 123. ISBN 9781605351926.
- ↑ Conner, SJ; Hughes, DC (2003). "Analysis of fish ZP1/ZPB homologous genes--evidence for both genome duplication and species-specific amplification models of evolution". Reproduction 126 (3): 347–52. PMID 12968942. doi:10.1530/rep.0.1260347.
- ↑ Conner, S.J.; Lefièvre, L; Hughes, DC; Barratt, CL (2005). "Cracking the egg: Increased complexity in the zona pellucida". Human Reproduction 20 (5): 1148–52. PMID 15760956. doi:10.1093/humrep/deh835.
- ↑ Gupta, SK; et al. (September 2012). "Mammalian zona pellucida glycoproteins: structure and function during fertilization.". Cell and tissue research 349 (3): 665–78. PMID 22298023. doi:10.1007/s00441-011-1319-y.
- ↑ Monné, M; Jovine, L (October 2011). "A structural view of egg coat architecture and function in fertilization.". Biology of reproduction 85 (4): 661–9. PMID 21715714. doi:10.1095/biolreprod.111.092098.
- ↑ Gupta, SK; Bansal, P; Ganguly, A; Bhandari, B; Chakrabarti, K (December 2009). "Human zona pellucida glycoproteins: functional relevance during fertilization.". Journal of reproductive immunology 83 (1-2): 50–5. PMID 19850354. doi:10.1016/j.jri.2009.07.008.
- ↑ "Community-Based Deer Management". New Jersey Department of Environmental Protection. 24 September 2014. Consultado o 8 July 2015.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Bork, Peer; Sander, Chris (1992). "A large domain common to sperm receptors (Zp2 and Zp3) and TGF-β type III receptor". FEBS Letters 300 (3): 237–40. PMID 1313375. doi:10.1016/0014-5793(92)80853-9.
- Oehninger, Sergio (2003). "Biochemical and functional characterization of the human zona pellucida". Reproductive BioMedicine Online 7 (6): 641–8. PMID 14748962. doi:10.1016/S1472-6483(10)62086-X.
- Boja, E. S.; Hoodbhoy, T; Fales, HM; Dean, J (2003). "Structural Characterization of Native Mouse Zona Pellucida Proteins Using Mass Spectrometry". Journal of Biological Chemistry 278 (36): 34189–202. PMID 12799386. doi:10.1074/jbc.M304026200.
- Jovine, Luca; Darie, Costel C.; Litscher, Eveline S.; Wassarman, Paul M. (2005). "Zona Pellucida Domain Proteins". Annual Review of Biochemistry 74: 83–114. PMID 15952882. doi:10.1146/annurev.biochem.74.082803.133039.
- Monné, Magnus; Han, Ling; Jovine, Luca (2006). "Tracking Down the ZP Domain: From the Mammalian Zona Pellucida to the Molluscan Vitelline Envelope". Seminars in Reproductive Medicine 24 (4): 204–16. PMID 16944418. doi:10.1055/s-2006-948550.
- Wassarman, P. M. (2008). "Zona Pellucida Glycoproteins". Journal of Biological Chemistry 283 (36): 24285–9. PMC 2528931. PMID 18539589. doi:10.1074/jbc.R800027200.
- Wassarman, Paul M.; Litscher, Eveline S. (2008). "Mammalian fertilization:the eggs multifunctional zona pellucida". The International Journal of Developmental Biology 52 (5–6): 665–76. PMID 18649280. doi:10.1387/ijdb.072524pw.
- Monné, Magnus; Han, Ling; Schwend, Thomas; Burendahl, Sofia; Jovine, Luca (2008). "Crystal structure of the ZP-N domain of ZP3 reveals the core fold of animal egg coats". Nature 456 (7222): 653–7. PMID 19052627. doi:10.1038/nature07599.
- Han, Ling; Monné, Magnus; Okumura, Hiroki; Schwend, Thomas; Cherry, Amy L.; Flot, David; Matsuda, Tsukasa; Jovine, Luca (2010). "Insights into Egg Coat Assembly and Egg-Sperm Interaction from the X-Ray Structure of Full-Length ZP3". Cell 143 (3): 404–15. PMID 20970175. doi:10.1016/j.cell.2010.09.041.
Ligazóns externas
[editar | editar a fonte]- Imaxe de Histoloxía: 18404loa – Histology Learning System na Universidade de Boston - "Female Reproductive System: ovary, cumulus oophorus "
- Imaxe de Histoloxía: 14805loa – Histology Learning System na Universidade de Boston - "Female Reproductive System: ovary, multilaminar primary follicle"
- Anatomy photo: Reproductive/mammal/ovary2/ovary7 - Comparative Organology at University of California, Davis - "Mammal, canine ovary (LM, High)"
- Image at um.edu.mt
- Image at um.edu.mt