Viniloxía
A viniloxía[1] é a transmisión de efectos electrónicos a través dun sistema de enlace orgánico conxugado.[2] O concepto foi introducido en 1926 por Ludwig Claisen para explicar as propiedades ácidas da formilacetona e os cetoaldehidos relacionados[3]. A súa forma adxectival, viníloga, úsase para describir grupos funcionais nos que os restos estándar do grupo están separados por un dobre enlace carbono-carbono. Por exemplo, un ácido carboxílico cun dobre enlace carbono-carbono (-HC=CH-, un resto "vinilo"; en realidade un grupo vinileno) entre un grupo carbonilo e un grupo hidroxilo denomínase ácido carboxílico vinílogo .
Debido á transmisión de información electrónica a través da conxugación, os grupos funcionais vinílogos a miúdo posúen reactividade ou propiedades químicas "análogas" en comparación co grupo funcional proxenitor. Polo tanto, a viniloxía é unha heurística útil para a predición do comportamento de sistemas estruturalmente similares pero que conteñen enlaces C=C intermedios que están conxugados aos grupos funcionais anexos. Por exemplo, unha propiedade clave dos ácidos carboxílicos é a súa acidez de Brønsted. O ácido carboxílico máis simple, o ácido fórmico (HC(=O)–OH), é un ácido orgánico moderadamente forte con ap K a de 3,7. Esperaríamos que os ácidos carboxílicos vinílogos tivesen unha acidez similar. De feito, o vinílogo do ácido fórmico, 2-formil-1-eten-1-ol, HC(=O)–CH=CH–OH ten unha acidez de Brønsted substancial, cun p K a ~ 5–6 estimado. En particular, os ácidos carboxílicos vinílogos son ácidos substancialmente máis fortes que os enois típicos (p K a ~ 12). A vitamina C (ácido ascórbico, ver a continuación ) é un exemplo bioloxicamente importante de ácido carboxílico vinílogo.
A inserción dun o- ou p - fenileno (é dicir, un anel de benceno na orientación 1,2 ou 1,4) tamén dá lugar a algunhas semellanzas na reactividade (chamadas "feniloxía"), aínda que o efecto é xeralmente máis débil, xa que a conxugación a través do anel arilo require a consideración de formas de resonancia ou intermediarios nos que a aromaticidade está interrompida.[4] [5]

Reactividade viníloga
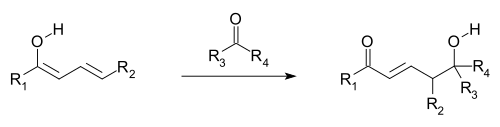
[editar | editar a fonte]Crese que as reaccións vinílogas ocorren cando os orbitais dos dobres enlaces do grupo vinilo e dun grupo receptor de electróns (EWG; os orbitais π) están aliñados e poden solaparse e mesturarse (é dicir, conxugarse). A deslocalización electrónica permite que o EWG reciba densidade electrónica mediante a participación do sistema conxugado. As reaccións vinílogas tamén inclúen adicións de conxugados, onde un nucleófilo reacciona no extremo vinilo, así como unha variación viníloga da reacción aldólica, onde un electrófilo é atacado por un enolato vinílogo nucleófilo (ver imaxe primeira e seguinte). O enolato vinílogo reacciona na posición terminal do sistema de dobre enlace (o carbono γ), en lugar do carbono α inmediatamente adxacente ao carbonilo, como o faría un enolato simple. Os electrófilos alílicos adoitan reaccionar por ataque vinílogo dun nucleófilo en lugar de por adición directa.
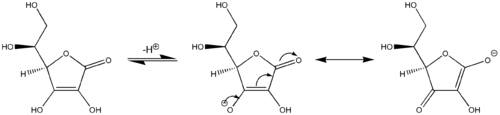
Outro exemplo de reactividade viníloga: a ácido ascórbico (vitamina C) compórtase como un ácido carboxílico vinílogo pola implicación do seu resto carbonilo, un grupo vinilo dentro do anel e o par solitario do grupo hidroxilo que actúa como sistema conxugado . A acidez do protón hidroxilo no extremo do grupo vinilo no ácido ascórbico é máis comparable a un ácido carboxílico típico que a un alcohol porque dúas estruturas de resonancia principais estabilizan a carga negativa na base conxugada do ácido ascórbico (estruturas do centro e da dereita na última imaxe), análoga ás dúas estruturas de resonancia que estabilizan a carga negativa do anión que resulta da eliminación dun protón dun ácido carboxílico simple (cf. primeira imaxe). De xeito análogo, os derivados do ácido sórbico, estendidos por outro resto "vinílico" tamén mostran un comportamento vinílogo.
Notas
[editar | editar a fonte]- ↑ "bUSCatermos". aplicacions.usc.es; viniloxía. Consultado o 2022-07-04.
- ↑ The Vinylogous Aldol Reaction: A Valuable, Yet Understated Carbon-Carbon Bond-Forming Maneuver Giovanni Casiraghi, Franca Zanardi, Giovanni Appendino, e Gloria Rassu Chem. Rev. 2000; 100(6) pp 1929 - 1972; (Rev.) doi 10.1021/cr990247i
- ↑ Zu den O-Alkylderivaten des Benzoyl-acetons und den aus ihnen entstehenden Isoxazolen. (Entgegnung an Hrn. O. Weygand.) "Berichte der deutschen chemischen Gesellschaft (A and B Series)". Volume 59, I 2, Data: 10. Febreiro 1926, Páx.: 144-153 L. Claisen. doi 10.1002/cber.19260590206
- ↑ Yamasaki, Ryu; Ikeda, Hirokazu; Masu, Hyuma; Azumaya, Isao; Saito, Shinichi (2012-10-07). "Synthesis and properties of phenylogous amides". Tetrahedron (en inglés) 68 (40): 8450–8456. ISSN 0040-4020. doi:10.1016/j.tet.2012.07.084.
- ↑ Lawrence, Anthony J.; Hutchings, Michael G.; Kennedy, Alan R.; McDouall, Joseph J. W. (2010-02-05). "Benzodifurantrione: A Stable Phenylogous Enol". The Journal of Organic Chemistry (en inglés) 75 (3): 690–701. ISSN 0022-3263. doi:10.1021/jo9022155.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Viniloxía |
Bibliografía
[editar | editar a fonte]- Lisboa, Marilda.; Hoang, Tung.; Dudley, Gregory B. (2011). "Tandem Neucleophilic Addition / Fragmentation of Vinylogous Acyl Triflates: 2-Methyl-2-(1-Oxo-5-Heptynyl)-1, 3-Dithiane" 88. 2011: 353. doi:10.15227/orgsyn.088.0353.
