Triosa-fosfato isomerase
| Triosa-fosfato isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
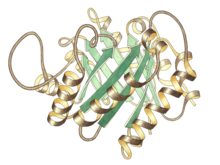
| Vista lateral do monómero da triosa-fosfato isomerase co sitio activo na parte central superior. | |||||||||
| Identificadores | |||||||||
| Número EC | 5.3.1.1 | ||||||||
| Número CAS | 9023-78-3 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A triosa-fosfato isomerase (TPI ou TIM, tamén escrita triosa fosfato isomerase ou triosafosfato isomerase) é un encima do grupo das isomerases co Número EC:5.3.1.1 que cataliza a interconversión reversible entre as dúas triosas fosfato isómeras, que son a dihidroxiacetona fosfato e o D-gliceraldehido 3-fosfato. Intervén na glicólise e gliconeoxénese.
| Dihidroxiacetona fosfato | triosa-fosfato isomerase | D-Gliceraldehido 3-fosfato | |

|

| ||

| |||
| triosa-fosfato isomerase | |||
A triosa-fsofato isomerase xoga un importante papel na glicólise e é esencial para unha produción de enerxía eficiente. A triosa-fosfato isomerase atopouse en case todos os organismos en que se procurou, incluíndo animais como os mamíferos e os insectos e en fungos, plantas, e bacteriaa. Porén, algunhas bacterias que non realizan a glicólise, como Ureaplasma, carecen deste encima.
Nos humanos, as deficiencias en triosa-fosfato isomerase están asociadas cun trastorno neurolóxico grave progresivo chamado deficiencia de triosa-fosfato isomerase, que está caracterizada por unha anemia hemolítica crónica. Aínda que hai varias mutacións que causan esta doenza, a maioría inclúe unha mutación no ácido glutámico na posición 104 que cambia a ácido aspártico.[1]
A triosa-fosfato isomerase é un encima moi eficiente, que realiza a súa reacción miles de millóns de veces máis rápido do que ocorrería naturalmente en solución sen encima. A reacción é tan eficiente que se di que é perfecta cataliticamente, é dicir, está limitada só pola velocidade con que o substrato pode difundir dentro e fóra do centro activo do encima.[2][3]
Mecanismo[editar | editar a fonte]
O mecanismo catalítico implica a formación dun intermediato "enediol". A enerxía libre relativa de cada estado basal e estado de transición foi determinada experimentalmente, e móstrase na figura.[2]
A estrutura da triosa-fosfato isomerase facilita a conversión entre a dihidroxiacetona fosfato (DHAP) e o gliceraldehido 3-fosfato (GAP). O residuo glutamato 165 nucleofílico da triosa-fosfato isomerase desprotona o substrato,[4] e o residuo de histidina 95 electrofílico doa un protón para formar o intermediato enediol.[5][6] Cando se desprotona, o enediolato colápsase e, tomando un protón do glutamato 165 protonado, forma o produto gliceraldehido 3-fosfato. A catálise da reacción inversa procede analogamente, formando o mesmo enediol pero con colapso do enediolato desde o oxíxeno en C2.[7]
A triosa-fosfato isomerase está limitada pola difusión. En termos termodinámicos, a formación de dihidroxiacetona fosfato está favorecida nunha proporción de 20:1 sobre a produción de gliceraldehido 3-fosfato.[8] Porén, na glicólise o uso do gliceraldehido 3-fosfato nos seguintes pasos da ruta fai que a reacción se incline cara á súa produción. A triosa-fosfato isomerase é inhibida polos ións sulfato, fosfato, e arseniato, que se unen ao centro activo.[9] Outros inhibidores son o 2-fosfoglicolato, un análogo do estado de transición, e o D-glicerol 1-fosfato, un análogo do substrato.[10]
Estrutura[editar | editar a fonte]
| Triosa-fosfato isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | TIM | ||||||||
| Pfam | PF00121 | ||||||||
| Pfam clan | CL0036 | ||||||||
| InterPro | IPR000652 | ||||||||
| PROSITE | PDOC00155 | ||||||||
| SCOPe | 1tph / SUPFAM | ||||||||
| |||||||||

A triosa-fosfato isomerase é unha proteína dímera formada por dúas subunidades idénticas, cada unha das cales está formada por uns 250 residuos de aminoácidos. A estrutura tridimensional de cada subunidade presenta oito hélices α na parte externa e oito cadeas β paralelas no interior. Na ilustración, o modelo de fitas de cada subunidade está coloreado con cor degradada do azul ao vermello desde o N-terminal ao C-terminal. Este motivo estrutural denomínase barril αβ, ou barril TIM. O centro activo deste encima está no centro do barril. No mecanismo catalítico están implicados un residuo de ácido glutámico e unha histidina. A secuencia arredor dos residuos do centro activo está conservada en todas as triosas-fosfato isomerases coñecidas.
A estrutura da triosa-fosfato isomerase contribúe á súa función. Ademais dos residuos de glutamato e histidina situados con precisión para formar o enediol, ten unha cadea de dez ou once aminoácidos que actúa como un bucle que estabiliza o intermediato. O bucle, formado polos residuos 166 ao 176, péchase e forma un enlace de hidróxeno co grupo fosfato do substrato. Esta acción estabiliza o intermediato enediol e o outro estado de transición da reacción.[7]
Ademais de facer que a reacción sexa factible cineticamente, o bucle confina o intermediato enediol, que é moi reactivo, para impedir a descomposición de metilglioxal e fosfato inorgánico. O enlace de hidróxeno entre o encima e o grupo fosfato do substrato fai que esa descomposición sexa estereoelectronicamente desfavorable.[7] O metilglioxal é unha toxina e, en caso de que se forme, é eliminada por medio do chamado sistema glioxilase.[11] A perda dun enlace fosfato de alta enerxía e do substrato para o resto da glicólise fai que a formación de metilglioxal sexa ineficiente.
Os estudos suxiren que unha lisina próxima ao centro activo (na posición 12) é tamén fundamental para a función do encima. A lisina, protonada a pH fisiolóxico, pode axudar a neutralizar a carga negativa do grupo fosfato. Nos mutantes en que esta lisina está substituída por un aminoácido neutro, o encima deixa de funcionar, pero nos mutantes cun aminoácido diferente pero cargado positivamente mantén a súa funcionalidade.[12]
Notas[editar | editar a fonte]
- ↑ Orosz, F.; Oláh, J. (2008). "Triosephosphate isomerase deficiency: facts and doubts". IUBMB Life 58 (12): 703–715. PMID 17424909. doi:10.1080/15216540601115960.
- ↑ 2,0 2,1 Albery, W. J.; Knowles, J. R. (1976). "Free-Energy Profile for the Reaction Catalyzed by Triosephosphate Isomerase". Biochemistry 15 (25): 5627–5631. PMID 999838. doi:10.1021/bi00670a031.
- ↑ Rose, I.A.; Fung, W.J., Warms, J.V.B. (1990). "Proton diffusion in the active site of triosephosphate isomerase". Biochemistry 29 (18): 4312–4317. PMID 2161683. doi:10.1021/bi00470a008.
- ↑ Alber, T.; Banner, D.W.; Wilson, I.A. (1981). "On the three-dimensional structure and catalytic mechanism of triose phosphate isomerase.". Phil. Trans. R. Soc. 293 (1063): 159–171. PMID 6115415. doi:10.1098/rstb.1981.0069.
- ↑ Nickbarg, E.B.; Davenport, R.C.; Knowles, J.R. (1988). "Triose Phosphate Isomerase: Removal of a Putatively Electrophilic Histidine Residue Results in a Subtle Change in Catalytic Mechanism.". Biochemistry 27 (16): 5948–5960. PMID 2847777. doi:10.1021/bi00416a019.
- ↑ Komives, E.A.; Chang, L.C. (1991). "Electrophilic Catalysis in Triosephosphate Isomerase: the Role of Histidine-95.". Biochemistry 30 (12): 3011–3019. PMID 2007138. doi:10.1021/bi00226a005.
- ↑ 7,0 7,1 7,2 Knowles, J.R. (1991). "Enzyme catalysis: not different, just better". Nature 350 (6314): 121–124. PMID 2005961. doi:10.1038/350121a0.
- ↑ Harris, T.K.; Cole, R.N.; Mildvan, A.S. (1998). "Proton Transfer in the Mechanism of Triosephosphate Isomerase.". Biochemistry 37 (47): 16828–16838. PMID 9843453. doi:10.1021/bi982089f.
- ↑ Lambeir, A.-M.; Opperdoes, F.R.; Wierenga, R.K. (1987). "Kinetic properties of triose-phosphate isomerase from Trypanosama brucei brucei". European Journal of Biochemistry 168 (1): 69–74. PMID 3311744. doi:10.1111/j.1432-1033.1987.tb13388.x.
- ↑ Lolis, E.; Petsko, G.A. (1990). "Crystallographic Analysis of the Complex between Triosephosphate Isomerase and 2-Phosphoglycolate at 2.5-Å Resolution: Implications for Catalysis". Biochemistry 29 (28): 6619–6625. PMID 2204418. doi:10.1021/bi00480a010.
- ↑ Creighton, D.J.; Hamilton, D.S. (2001). "Brief History of Glyoxalase I and What We Have Learned about Metal Ion-Dependent, Enzyme-Catalyzed Isomerizations.". Archives of Biochemistry and Biophysics 387 (1): 1–10. PMID 11368170. doi:10.1006/abbi.2000.2253.
- ↑ Lodi, P.J.; Chang, L.C.; Komives, E.A. (1990). "Triosephosphate Isomerase Requires a Positively Charged Active Site: The Role of Lysine-12.". Biochemistry 33 (10): 2809–2814. PMID 8130193. doi:10.1021/bi00176a009.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Triosafosfato isomerase en 3D interactivo en Proteopedia
- Familia da triosafosfato isomerase (TIM) en PROSITE

