Repetición de anquirina
| Dominio de repeticións de anquirina | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
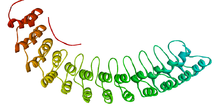 Diagrama de fitas dun fragmento do dominio de unión á membrana da anquirina R.[1] | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Ank | ||||||||||
| Pfam | PF00023 | ||||||||||
| InterPro | IPR002110 | ||||||||||
| SMART | SM00248 | ||||||||||
| PROSITE | PDOC50088 | ||||||||||
| SCOPe | 1awc / SUPFAM | ||||||||||
| |||||||||||
A repetición de anquirina (na literatura inglesa ankyrin repeat) é un motivo de 33 residuos nas proteínas que consiste en dúas hélices alfa separadas por bucles, que se descubriu primeiro en poteínas de sinalización celular no Cdc10 de lévedo e na proteína Notch de Drosophila . Os dominios que teñen repeticións en tándem de anquirina son mediadores nas interaccións proteína-proteína e están entre os motivos estruturais máis comúns en proteínas coñecidas. Aparecen en proteínas de bacterias, arqueas e eucariotas, pero son moito máis comúns en eucariotas. As proteínas con repeticións de anquirina, aínda que están ausentes na maioría dos virus, son comúns nos poxvirus. A maioría das proteínas que conteñen o motivo teñen de catro a seis repeticións, aínda que a proteína que lles dá o nome, a anquirina, contén 24, e o número de repeticións maior coñecido é 34, predito nunha proteína expresada por Giardia lamblia.[2]
As repeticións de anquirina caracteristicamente préganse xuntas para formar unha soa estrutura en solenoide liñal chamada dominio de repeticións de anquirina. Estes dominios son unha das plataformas de intracción proteína-proteína máis comúns na natureza. Aparecen nun gran número de proteínas funcionalmente diversas, principalmente eucariotas. Os poucos exemplos coñecidos en procariotas e virus poden ser o resultado da transferencia horizontal de xenes.[3] Esta repetición atopouse en proteínas con funcións tan diversas como iniciadores da transcrición, reguladores do ciclo celular, proteínas citoesqueléticas, transportadores de ións e transdutores de sinais. O pregamento de anquirina parece definirse pola súa estrutura en vez de pola súa función, xa que non hai unha estrutura ou secuencia que sexa universalmente recoñecida por ela.
Considerando as estruturas atómicas de repeticións de anquirina individuais, o bucle adoita ser un bucle vulto beta tipo 1, mentres que ambas as hélices alfa adoitan ter un bucle Schellman no seu N-terminal.
Papel no pregamento de proteínas
[editar | editar a fonte]O motivo de secuencia de repetición de anquirina foi estudado usando aliñamento de secuencias múltiples para determinar os residuos de aminoácidos conservados esenciais para o pregamento e a estabilidade. Os residuos na ampla superficie lateral das estruturas de repeticións de anquirina son variables, a miúdo hidrófobos, e están implicados principalmente na mediación de interaccións proteína-proteína. Sintetizouse un deseño de proteínas artificial baseado nunha secuencia consenso derivada do aliñamento de secuencias e visuse que se pregaba establemente, e representa a primeira proteína deseñada con repeticións múltiples.[4] Estratexias de deseño máis amplas utilizaron as secuencias combintorias para facer "evolucionar" repeticións de anquirina que recoñecen determinadas dianas proteicas, unha técnica que foi presentada como unha alternativa ao deseño de anticorpos para aplicacións que requiren unha alta afinidade de unión.[5] Un estudo baseado na estrutura dun conxunto de proteínas anquirina de estrutura coñecida, mostra que as proteínas anquirina baseadas no consenso son moi estables porque maximizan a diferenza enerxética entre as estrutras pregadas e despregadas, codificando unha rede densamente conectada de interaccións favorables entre os motivos de secuencia conservados, como o motivo TPLX.[6] O mesmo estudo mostra que as insercións no marco canónico de repeticións de anquirina están enriquecidas con interaccións conflitivas, que están relacionadas coa función. O mesmo aplícase ás interaccións que rodean os puntos quentes de deleción. Estes poderían estar relacionados con complexas transicións pregamento/despregamento que son importantes para o recoñecemento da diana e a interacción.
As proteínas de repetición de anquirina presentan un problema pouco común no estudo do pregamento de proteínas, que está en gran medida centrado nas proteínas globulares que forman unha estrutura terciaria ben definida por contactos residuo-residuo non locais de longo rango. As repeticións de anquirina, ao contrario, conteñen moi poucos deses contactos (é dicir, teñen unha baixa orde de contacto). A maioría dos estudos atoparon que as repeticións de anquirina se pregan nun mecanismo de pregamento en dous estados, o que suxire un alto grao de cooperatividade de pregamento malia os contactos inter-residuos locais e a evidente necesidade dun pregamento correcto con número de repeticións diverso. Algunhas evidencias, baseadas na síntese de versións truncadas de proteínas repetidas naturais,[7] e no exame de vlores fi,[8] suxiren que o C-terminal forma o sitio de nucleación do pregamento.
Importancia clínica
[editar | editar a fonte]As proteínas con repeticións de anquirina foron asociadas cun varias doenzas humanas. Estas proteínas inclúen o inhibidor do ciclo celular p16, que está asociado co cancro, e a protína Notch (un compoñente clave das vías de sinalización celular), que pode causar o trastorno neurolóxico CADASIL cando o dominio de repetición está alterado por unha mutación.[2]
Unha familia especializada de proteínas anquirina coñecida como proteínas de repeticións de anquirina do músculo (MARPs) están implicadas na reparación e rexeneración do tecido muscular despois de danos causados por lesións ou estrés.[9]
Estudouse tamén unha variación natural entre a glutamina e a lisina na posición 703 na 11ª repetición de anquirina de ANKK1, coñecida como alelo TaqI A1, que podería estar asociada con predisposición a adiccións.[10]
Proteínas humanas que conteñen esta repetición
[editar | editar a fonte]ABTB1; ABTB2; ACBD6; ACTBL1; ANK1; ANK2; ANK3; ANKAR; ANKDD1A; ANKEF1; ANKFY1; ANKHD1; ANKIB1; ANKK1; ANKMY1; ANKMY2; ANKRA2; ANKRD1; ANKRD10; ANKRD11; ANKRD12; ANKRD13; ANKRD13A; ANKRD13B; ANKRD13C; ANKRD13D; ANKRD15; ANKRD16; ANKRD17; ANKRD18A; ANKRD18B; ANKRD19; ANKRD2; ANKRD20A1; ANKRD20A2; ANKRD20A3; ANKRD20A4; ANKRD21; ANKRD22; ANKRD23; ANKRD24; ANKRD25; ANKRD26; ANKRD27; ANKRD28; ANKRD30A; ANKRD30B; ANKRD30BL; ANKRD32; ANKRD33; ANKRD35; ANKRD36; ANKRD36B; ANKRD37; ANKRD38; ANKRD39; ANKRD40; ANKRD41; ANKRD42; ANKRD43; ANKRD44; ANKRD45; ANKRD46; ANKRD47; ANKRD49; ANKRD50; ANKRD52; ANKRD53; ANKRD54; ANKRD55; ANKRD56; ANKRD57; ANKRD58; ANKRD60; ANKRD6; ANKRD7; ANKRD9; ANKS1A; ANKS3; ANKS4B; ANKS6; ANKZF1; ASB1; ASB10; ASB11; ASB12; ASB13; ASB14; ASB15; ASB16; ASB2; ASB3; ASB4; ASB5; ASB6; ASB7; ASB8; ASB9; ASZ1; BARD1; BAT4; BAT8; BCL3; BCOR; BCORL1; BTBD11; CAMTA1; CAMTA2; CASKIN1; CASKIN2; CCM1; CDKN2A; CDKN2B; CDKN2C; CDKN2D; CENTB1; CENTB2; CENTB5; CENTG1; CENTG2; CENTG3; CLIP3; CLIP4; CLPB; CTGLF1; CTGLF2; CTGLF3; CTGLF4; CTGLF5; CTTNBP2; DAPK1; DDEF1; DDEF2; DDEFL1; DGKI; DGKZ; DP58; DYSFIP1; DZANK; EHMT1; EHMT2; ESPN; FANK1; FEM1A; FEM1B; GABPB2; GIT1; GIT2; GLS; GLS2; HACE1; HECTD1; IBTK; ILK; INVS; KIDINS220; KRIT1; LRRK1; MAIL; MIB1; MIB2; MPHOSPH8; MTPN; MYO16; NFKB1; NFKB2; NFKBIA; NFKBIB; NFKBIE; NFKBIL1; NFKBIL2; NOTCH1; NOTCH2; NOTCH3; NOTCH4; NRARP; NUDT12; OSBPL1A; OSTF1; PLA2G6; POTE14; POTE15; POTE8; PPP1R12A; PPP1R12B; PPP1R12C; PPP1R13B; PPP1R13L; PPP1R16A; PPP1R16B; PSMD10; RAI14; RFXANK; RIPK4; RNASEL; SHANK1; SHANK2; SHANK3; SNCAIP; TA-NFKBH; TEX14; TNKS; TNKS2; TNNI3K; TP53BP2; TRP7; TRPA1; TRPC3; TRPC4; TRPC5; TRPC6; TRPC7; TRPV1; TRPV2; TRPV3; TRPV4; TRPV5; TRPV6; UACA; USH1G; ZDHHC13; ZDHHC17;
Notas
[editar | editar a fonte]- ↑ PDB 1N11; Michaely P, Tomchick DR, Machius M, Anderson RG (decembro de 2002). "Crystal structure of a 12 ANK repeat stack from human ANK1". EMBO J. 21 (23): 6387–96. PMC 136955. PMID 12456646. doi:10.1093/emboj/cdf651.
- ↑ 2,0 2,1 Mosavi L, Cammett T, Desrosiers D, Peng Z (2004). "The ankyrin repeat as molecular architecture for protein recognition". Protein Sci 13 (6): 1435–48. PMC 2279977. PMID 15152081. doi:10.1110/ps.03554604. Arquivado dende o orixinal o 2004-09-07.
- ↑ Bork P (decembro de 1993). "Hundreds of ankyrin-like repeats in functionally diverse proteins: mobile modules that cross phyla horizontally?". Proteins 17 (4): 363–74. PMID 8108379. doi:10.1002/prot.340170405.
- ↑ Mosavi LK, Minor DL, Peng ZY (decembro de 2002). "Consensus-derived structural determinants of the ankyrin repeat motif". Proc Natl Acad Sci USA 99 (25): 16029–34. Bibcode:2002PNAS...9916029M. PMC 138559. PMID 12461176. doi:10.1073/pnas.252537899.
- ↑ Binz HK, Amstutz P, Kohl A, et al. (maio de 2004). "High-affinity binders selected from designed ankyrin repeat protein libraries". Nat. Biotechnol. 22 (5): 575–82. PMID 15097997. doi:10.1038/nbt962.
- ↑ Parra RG, Espada R, Verstraete N, Ferreiro DU, et al. (decembro de 2015). "Structural and Energetic Characterization of the Ankyrin Repeat Protein Family.". PLOS Comput. Biol. 12 (11): 575–82. Bibcode:2015PLSCB..11E4659P. PMC 4687027. PMID 26691182. doi:10.1371/journal.pcbi.1004659.
- ↑ Zhang B, Peng Z (xuño de 2000). "A minimum folding unit in the ankyrin repeat protein p16(INK4)". J Mol Biol 299 (4): 1121–32. PMID 10843863. doi:10.1006/jmbi.2000.3803.
- ↑ Tang KS, Fersht AR, Itzhaki LS (xaneiro de 2003). "Sequential unfolding of ankyrin repeats in tumor suppressor p16". Structure 11 (1): 67–73. PMID 12517341. doi:10.1016/S0969-2126(02)00929-2.
- ↑ Miller MK, Bang ML, Witt CC, et al. (novembro de 2003). "The muscle ankyrin repeat proteins: CARP, ankrd2/Arpp and DARP as a family of titin filament-based stress response molecules". J Mol Biol 333 (5): 951–64. PMID 14583192. doi:10.1016/j.jmb.2003.09.012.
- ↑ Neville MJ, Johnstone EC, Walton RT (Jun 2004). "Identification and characterization of ANKK1: a novel kinase gene closely linked to DRD2 on chromosome band 11q23.1". Hum. Mutat. 23 (6): 540–5. PMID 15146457. doi:10.1002/humu.20039.
changes in ANKK1 activity may provide an alternative explanation for previously described associations between the DRD2 Taq1A RFLP and neuropsychiatric disorders such as addiction. (Os cambios na actividade de ANKK1 poden proporcionar unha explicación alternativa ás asociacións descritas previamente entre o DRD2 Taq1A RFLP e os trastornos neuropsiquiátricos como a adicción).
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- DARPin (do inglés designed ankyrin repeat protein, proteína de repetición de anquirina deseñada), un anticorpo feito por enxeñaría mimético baseado na estrutura das repeticións de anquirina
Ligazóns externas
[editar | editar a fonte]- Eukaryotic Linear Motif resource: motivo de tipo LIG_TNKBM_1
- Ankyrin repeat Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
Este artigo incorpora textos en dominio público procedentes de Pfam e InterPro IPR002110
