Complexo silenciador inducido por ARN
O complexo silenciador inducido por ARN, abreviado como RISC (do inglés RNA-induced silencing complex), é un complexo multiproteico ou máis especificamente unha ribonucleoproteína, que contén unha das febras dun fragmento de ARN bicatenario, como pode ser un ARN interferente pequeno (siRNA) ou un microARN (miRNA).[1] Esta febra monocatenaria de ARN que leva incorporada actúa como un molde para que o RISC recoñeza un transcrito de ARN mensaxeiro (ARNm) complementario, que é o ARNm diana sobre o que actuará o RISC. Unha vez que o encontra, unha das proteínas que forma parte do RISC, chamada Argonauta, actívase e cliva (corta) o ARNm. Este proceso denomínase interferencia de ARN (RNAi) e prodúcese en moitos eucariotas; é un proceso clave no silenciamento de xenes e unha defensa contra as infeccións virais.[2][3]
Descubrimento
[editar | editar a fonte]A identificación bioquímica do RISC realizárona Gregory Hannon e os seus colegas no Cold Spring Harbor Laboratory.[4] Ocorreu só un par de anos despois do descubrimento da interferencia de ARN en 1998 feito por Andrew Fire e Craig Mello, que compartiron o Premio Nobel de Medicina de 2006.[2]

Hannon e os seus colegas intentaban identificar os mecanismos da interferencia de ARN implicados no silenciamento de xenes por ARNs bicatenarios (dsRNA) en células de Drosophila. As células S2 de Drosophila eran transfectadas cun vector de expresión lacZ para cuantificar a expresión xénica coa actividade da β-galactosidase. Os seus resultados indicaron que a co-transfección con ARN bicatenario de lacZ reducía significativamente a actividade da β-galactosidase en comparación co ARN bicatenario control. Por tanto, os ARNs bicatenarios controlan a expresión xénica por medio da complementaridade de secuencia.
As células S2 foron despois transfectadas con ARN bicatenario de ciclina E de Drosophila. A ciclina E é un xene esencial para a progresión do ciclo celular na fase S. O ARN bicatenario de ciclina E facía parar o ciclo celular na fase G1 (antes da fase S). Por tanto, a interferencia de ARN pode ter como diana xenes endóxenos.
Ademais, os ARN bicatenarios de ciclina E só facían diminuír o ARN de ciclina E. Un resultado similar obtívose usando o ARN bicatenario correspondente a ciclina A, que actúa nas fases S, G2 e M do ciclo celular. Isto mostra a característica definitoria da interferencia de ARN: os niveis reducidos de ARNm correspóndense cos niveis do ARN bicatenario engadido.
Para comprobar se as súas observacións de diminución dos niveis de ARNm eran resultado de que o ARNm era atacado directamente (como suxerían os datos obtidos noutros sistemas), transfectáronse as células S2 de Drosophila con ARNs bicatenarios de ciclina E de Drosophila ou con ARNs bicatenarios de lacZ e despois incubáronse con ARNm sintético para a ciclina E ou lacZ. As células transfectadas con ARN bicatenario de ciclina E só mostraron degradación nos transcritos de ciclina E (os transcritos de lacZ eran estables). Inversamente, as células transfectadas con ARN bicatenario de lacZ só mostraron degradación nos transcritos de lacZ e non nos transcritos de ciclina E. Estes resultados levaron a Hannon e os seus colegas a suxerir que a transferencia de ARN degrada o ARNm diana por medio dunha 'actividade de nuclease específica de secuencia'. Denominaron o encima nuclease implicado RISC.[4]
Función na interferencia de ARN
[editar | editar a fonte]
Carga dos ARNs bicatenarios
[editar | editar a fonte]A RNase III Dicer colabora co RISC na interferencia de ARN ao clivar os ARNs bicatenarios orixinando fragmentos de 21 a 23 nucleótidos de longo cun extremo 3' que sobrease de dous nucleótidos.[5][6] Estes fragmentos de ARN bicatenario son cargados no RISC e cada febra vai ter un destino diferente baseándose no fenómeno da regra da asimetría.[7][8][9]
- A febra co extremo 5' menos estable é seleccionada pola RNase Argonauta e integrada no RISC.[9][10] Esta febra coñécese como febra guía.
- A outra febra, coñecida como febra pasaxeira, é degradada polo RISC.[11]

Regulación xénica
[editar | editar a fonte]O RISC usa a febra guía unida para unirse á rexión 3'-UTR complementaria de transcritos de ARNm por apareamento de bases.[12][13] O RISC pode agora regular a expresión xénica do transcrito de ARNm de varios modos.
Degradación do ARNm
[editar | editar a fonte]A función máis coñecida do RISC é degradar un ARNm diana, o cal reduce os niveis de transcrito dispoñibles para ser traducidos nos ribosomas. Para que teña lugar a degradación do ARNm son precisas dúas cousas:
- unha correspondencia por complementariedade de bases case perfecta entre a febra guía e a secuencia do ARNm diana, e
- unha proteína Argonauta cataliticamente activa, chamada "rebandadora" ("slicer") para que clive o ARNm diana.[13]
A degradación do ARNm está localizada nos corpos citoplasmáticos chamados corpos P.[14]
Represión transcricional
[editar | editar a fonte]O RISC pode modular a carga do ribosoma e de factores accesorios para a tradución para reprimir a expresión do transcrito de ARNm unido. A represión traducional só require unha correspondencia de secuencia de bases parcial entre a febra guía e o ARNm diana.[13]
A tradución pode ser regulada no paso de iniciación por medio do seguinte:
- impedir a unión do factor de iniciación da tradución eucariótico (eIF) á carapucha 5'. O RISC pode desadenilar a cola poli(A) 3', o cal podería contribuír á represión pola vía da carapucha 5'.[1][12]
- impedir a unión da subunidade ribosómica de 60S ao ARNm pode reprimir tamén a tradución.[15]
A tradución pode regularse en pasos post-iniciación por medio do seguinte:
- promover a terminación prematura da tradución nos ribosomas,[16] ou,
- facer máis lenta a elongación.[17]
Aínda se especula sobre se as represións traducionais na iniciación ou post-iniciación son mutuamente excluíntes.
Formación da heterocromatina
[editar | editar a fonte]Algúns RISCs poden unirse directamente ao xenoma ao recrutar histona metiltransferases para formar heterocromatina no locus xénico e, por tanto, silenciar o xene. Estes RISCs toman a forma do que se chama complexo silenciador transcricional inducido por ARN ou RITS (do inglés RNA-induced transcriptional silencing complex). O exemplo mellor estudado é o do RITS de lévedos.[13][18][19]
O mecanismo non se comprende ben pero o RITS degrada os transcritos de ARNm nacentes. Propúxose que este mecanismo actúa como un 'bucle de retroalimentación autorreforzado' ao utilizárense os transcritos nacentes degradados pola ARN polimerase dependente de ARN (RdRp) para xerar máis ARNs interferentes pequenos.[20]
Eliminación do ADN
[editar | editar a fonte]Os RISCs parecen ter un papel na degradación do ADN durante o desenvolvemento do macronúcleo somático nos protozoos Tetrahymena. É similar á formación da heterocromatina e está implicada na defensa contra elementos xenéticos invasores.[21]
Proteínas asociadas ao RISC
[editar | editar a fonte]A estrutura completa do RISC aínda non está resolta. Diversos estudos informaron de varios valores de tamaños e compoñentes do RISC, máis non é completamente seguro se esta diverxencia se debe a que hai varios complexos RISC distintos ou a que os diferentes estudos utilizaron distintas fontes de mostras.[22]
| Complexo | Fonte | Compoñentes coñecidos/aparentes | Tamaño estimado | Función aparente na vía da interferencia de ARN |
|---|---|---|---|---|
| Dcr2-R2D2[23] | células S2 de D. melanogaster | Dcr2, R2D2 | ~250 kDa | procesamento do ARN bicatenario, unión de siRNA |
| RLC (A)[24][25] | embrións de D. melanogaster | Dcr2, R2D2 | NR | procesamento de ARNs bicatenarios, unión de siRNA, precursor do RISC |
| Holo-RISC[24][25] | embrións de D. melanogaster | Ago 2, Dcr1, Dcr2, Fmr1/Fxr, R2D2, Tsn, Vig | ~80S | unión ao ARN diana e clivaxe |
| RISC[4][26][27][28] | células S2 de D. melanogaster | Ago2, Fmr1/Fxr, Tsn, Vig | ~500 kDa | unión ao ARN diana e clivaxe |
| RISC[29] | células S2 de D. melanogaster | Ago2 | ~140 kDa | unión ao ARN diana e clivaxe |
| Complexo asociado a Fmr1[30] | células S2 de D. melanogaster | L5, L11, 5S rRNA, Fmr1/Fxr, Ago2, Dmp68 | NR | posible unión ao ARN diana e clivaxe |
| RISC mínimo[31][32][33][34] | células HeLa | eIF2C1 (Ago1) ou eIF2C2 (Ago2) | ~160 kDa | unión ao ARN diana e clivaxe |
| miRNP[35][36] | células HeLa | eIF2C2 (ago2), Gemin3, Gemin4 | ~550 kDa | asociación do miARN, unión ao ARN diana e clivaxe |
Ago, Argonauta; Dcr, Dicer; Dmp68, ortólogo de D. melanogaster da p68 RNA unwindase de mamíferos; eIF2C1, factor de iniciación da tradución eucariótico 2C1; eIF2C2, factor de iniciación da tradución eucariótico 2C2; Fmr1/Fxr, ortólogo de D. melanogaster da proteína de atraso mental X fráxil; miRNP, complexo miARN-proteína; NR, non reportado (sen datos); Tsn, nuclease estafilocócica tudor; Vig, xene intrónico vasa.

En calquera caso, parece que as proteínas Argonauta están presentes e son esenciais para o funcionamento do proceso. Ademais, téñense coñecementos de varias proteínas claves do complexo (ademais da Argonauta), que permiten ao RISC levar a cabo a súa función.
Proteínas Argonauta
[editar | editar a fonte]As proteínas Argonauta (Argonaute) son unha familia de proteínas que se encontra en procariotas e eucariotas. As súas funcións nos procariotas son descoñecidas pero en eucariotas son as responsables da interferencia de ARN.[37] A familia de proteínas Argonauta humanas ten oito membros dos cales só a Argonauta 2 está exclusivamente implicada na clivaxe do ARN diana no RISC.[34]

Complexo de carga de RISC
[editar | editar a fonte]O complexo de carga de RISC (RLC) é a estrutura esencial necesaria para cargar os fragmentos de ARN bicatenarios no RISC para por medio deles unirse ao ARNm diana. O RLC consta de Dicer, a proteína de unión ao ARN de resposta transactivante ao VIH (TRBP) e Argonauta 2.
- Dicer é unha endonuclease RNase III que xera os fragmentos de ARN bicatenario para ser cargados que dirixe a interferencia de ARN.
- TRBP é unha proteína con tres dominios de unión a ARN bicatenario.
- Argonauta 2 é unha RNase e é o centro catalítico do RISC.
Dicer asóciase coa TRBP e Argonauta 2 para facilitar a transferencia dos fragmentos de ARN bicatenarios xerados por Dicer a Argonauta 2.[38][39]
Investigacións máis recentes mostraron que a ARN helicase A humana podería tamén facilitar a ensamblaxe do RLC.[40]
Outras proteínas
[editar | editar a fonte]Algúns membros recentemente identificados do RISC son SND1 e MTDH.[41] SND1 e MTDH son oncoxenes e regulan a expresión de varios xenes.[42]
| Proteína | Especies nas que se encontrou a proteína |
|---|---|
| Dcr1[24] | D. melanogaster |
| Dcr2[23][24][25] | D. melanogaster |
| R2D2[24][25] | D. melanogaster |
| Ago2[24][26][29][30] | D. melanogaster |
| Dmp68[30] | D. melanogaster |
| Fmr1/Fxr[24][27][30] | D. melanogaster |
| Tsn[24][28] | D. melanogaster |
| Vig[24][27] | D. melanogaster |
| Polirribosomas, compoñentes ribosómicos[4][24][26][30][43] | D. melanogaster, T. brucei |
| eIF2C1 (Ago1)[31] | H. sapiens |
| eIF2C2 (Ago2)[31][32][34][36] | H. sapiens |
| Gemin3[35][36] | H. sapiens |
| Gemin4[35][36] | H. sapiens |
Ago, Argonauta; Dcr, Dicer; Dmp68, ortólogo de D. melanogaster da p68 ARN unwindase de mamífero; eIF2C1, factor de iniciación da tradución eucariótico 2C1; eIF2C2, factor de iniciación da tradución eucariótico 2C2; Fmr1/Fxr, ortólogo de D. melanogaster da proteína de atraso mental X fráxil; Tsn, nuclease estafilocócica tudor; Vig, xene intrónico vasa.
Unión ao ARNm
[editar | editar a fonte]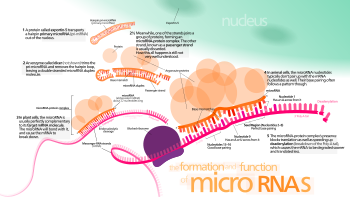
Aínda non está claro como o complexo RISC activado localiza os ARNm diana na célula, aínda que se demostrou que o proceso pode ocorrer en situacións distintas ás dunha tradución en curso de proteínas a partir do ARNm.[44]
O miARN expresado endoxenamente en animais xeralmente non é perfectamente complementario a un gran número de xenes e modula a expresión por medio da represión traducional.[45][46] Porén, nas plantas, o proceso ten unha especificidade moito maior para unirse ao ARNm e normalmente cada miARN só se une a un ARNm. Unha maior especificidade significa que é máis probable que ocorra a degradación do ARNm.[47]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Filipowicz W, Bhattacharyya SN and Sonenber N (2008). "Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?". Nature Reviews Genetics 9 (2): 102–114. doi:10.1038/nrg2290.
- ↑ 2,0 2,1 Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE and Mello CC (1998). "Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans". Nature 391 (6669): 806–811. doi:10.1038/35888.
- ↑ Watson, James D. (2008). Molecular Biology of the Gene. San Francisco, CA: Cold Spring Harbor Laboratory Press. pp. 641–648. ISBN 978-0-8053-9592-1.
- ↑ 4,0 4,1 4,2 4,3 Hammond SM, Bernstein E, Beach D and Hannon GJ (2000). "An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells". Nature 404 (6775): 293–296. doi:10.1038/35005107.
- ↑ Zamore PD, Tuschl T, Sharp PA and Bartel DP (2000). "RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals". Cell 101 (1): 25–33. doi:10.1016/S0092-8674(00)80620-0.
- ↑ Vermeulen A, Behlen L, Reynolds A, Wolfson A, Marshall W, Karpilow J and Khvorova A (2005). "The contributions of dsRNA structure to Dicer specificity and efficiency". RNA 11 (5): 674–682. doi:10.1261/rna.7272305.
- ↑ Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N and Zamore PD (2003). "Asymmetry in the assembly of the RNAi enzyme complex". Cell 115 (2): 199–208. doi:10.1016/S0092-8674(03)00759-1.
- ↑ Khvorova A, Reynolds A and Jayasena SD (2003). "Functional siRNAs and miRNAs exhibit strand bias". Cell 115 (2): 209–216. doi:10.1016/S0092-8674(03)00801-8.
- ↑ 9,0 9,1 Siomi H and Siomi MC (2009). "On the road to reading the RNA-interference code". Nature 457 (7228): 396–404. doi:10.1038/nature07754.
- ↑ Preall JB, He Z, Gorra JM and Sontheimer EJ (2006). "Short interfering RNA strand selection is independent of dsRNA processing polarity during RNAi in Drosophila". Current Biology 16 (5): 530–535. doi:10.1016/j.cub.2006.01.061.
- ↑ Gregory RI, Chendrimada TP, Cooch N and Shiekhattar R (2005). "Human RISC couples microRNA biogenesis and posttranscriptional gene silencing". Cell 123 (4): 631–640. doi:10.1016/j.cell.2005.10.022.
- ↑ 12,0 12,1 Wakiyama M, Takimoto K, Ohara O and Yokoyama S (2007). "Let-7 microRNA-mediated mRNA deadenylation and translational repression in a mammalian cell-free system". Genes & Development 21 (15): 1857–1862. doi:10.1101/gad.1566707.
- ↑ 13,0 13,1 13,2 13,3 Pratt AJ and MacRae IJ (2009). "The RNA-induced silencing complex: A versatile gene-silencing machine". Journal of Biological Chemistry 284 (27): 17897–17901. doi:10.1074/jbc.R900012200.
- ↑ Sen GL and Blau HM (2005). "Argonaute2/RISC resides in sites of mammalian mRNA decay known as cytoplasmic bodies". Nature Cell Biology 7 (6): 633–636. doi:10.1038/ncb1265.
- ↑ Chendrimada TP, Finn KJ, Ji X, Baillat D, Gregory RI, Liebhaber SA, Pasquinelli AE and Shiekhattar R (2007). "MicroRNA silencing through RISC recruitment of eIF6". Nature 447 (7146): 823–828. doi:10.1038/nature05841.
- ↑ Petersen CP, Bordeleau M-E, Pelletier J and Sharp PA (2006). "Short RNAs repress translation after initiation in mammalian cells". Molecular Cell 21 (4): 533–542. doi:10.1016/j.molcel.2006.01.031.
- ↑ Maroney PA, Yu Y, Fisher J and Nilsen TW (2006). "Evidence that microRNAs are associated with translating messenger RNAs in human cells". Nature Structural & Molecular Biology 13 (12): 1102–1107. doi:10.1038/nsmb1174.
- ↑ Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal SI and Moazed D (2004). "RNAi-mediated targeting of heterchromatin by the RITS complex". Science 303 (5658): 672–676. doi:10.1126/science.1093686.
- ↑ Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal SI and Moazed D (2004). "RITS acts in cis to promote RNA interference-mediated transcription and post-transcriptional silencing". Nature Genetics 36 (11): 1174–1180. doi:10.1038/ng1452.
- ↑ Sugiyama T, Cam H, Verdel A, Moazed D and Grewal SI (2005). "RNA-dependent RNA polymerase is an essential component of a self-enforcing loop coupling heterochromatin assembly to siRNA production". Proceedings of the National Academy of Sciences of the United States of America 102 (1): 152–157. doi:10.1073/pnas.0407641102.
- ↑ Mochizuki K and Gorovsky MA (2004). "Small RNAs in genome arrangement in Tetrahymena". Current Opinion in Genetics & Development 14 (2): 181–187. doi:10.1016/j.gde.2004.01.004.
- ↑ 22,0 22,1 22,2 Sontheimer EJ (2005). "Assembly and function of RNA silencing complexes". Nature Reviews Molecular Cell Biology 6 (2): 127–138. doi:10.1038/nrm1568.
- ↑ 23,0 23,1 Liu Q, Rand TA, Kalidas S, Du F, Kim HE, Smith DP and Wang X (2003). "R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway". Science 301 (5641): 1921–1925. doi:10.1126/science.1088710.
- ↑ 24,00 24,01 24,02 24,03 24,04 24,05 24,06 24,07 24,08 24,09 Pham JW, Pellio JL, Lee YS, Carthew RW and Sontheimer EJ (2004). "A Dicer-2-dependent 80S complex cleaves targeted mRNAs during RNAi in Drosophila". Cell 117 (1): 83–94. doi:10.1016/S0092-8674(04)00258-2.
- ↑ 25,0 25,1 25,2 25,3 Tomari Y, Du T, Haley B, Schwarz DS, Bennett R, Cook HA, Koppetsch BS, Theurkauf WE and Zamore PD (2004). "RISC assembly defects in the Drosophila RNAi mutant armitage". Cell 116 (6): 831–841. doi:10.1016/S0092-8674(04)00218-1.
- ↑ 26,0 26,1 26,2 Hammond SM, Boettcher S, Caudy AA, Kobayashi R and Hannon GJ. "Argonaute2, a link between genetic and biochemical analyses of RNAi". Science 293 (5532): 1146–1150. doi:10.1126/science.1064023.
- ↑ 27,0 27,1 27,2 Caudy AA, Myers M, Hannon GJ and Hammond SM. "Fragile X-related protein and VIG associate with the RNA interference machinery". Genes & Development 16 (19): 2491–2496. doi:10.1101/gad.1025202.
- ↑ 28,0 28,1 Caudy AA, Ketting RF, Hammond SM, Denli AM, Bathoorn AM, Tops BB, Silva JM, Myers MM, Hannon GJ and Plasterk RH (2003). "A micrococcal nuclease homologue in RNAi effector complexes". Nature 425 (6956): 411–414. doi:10.1038/nature01956.
- ↑ 29,0 29,1 Rand TA, Ginalski K, Grishin NV and Wang X (2004). "Biochemical identification of Argonaute 2 as the sole protein required for RNA-induced silencing complex activity". Proceedings of the National Academy of Sciences of the United States of America 101 (40): 14385=14389. doi:10.1073/pnas.0405913101.
- ↑ 30,0 30,1 30,2 30,3 30,4 Ishizuka A, Siomi MC and Siomi H (2002). "A Drosophila fragile X protein interacts with components of RNAi and ribosomal proteins". Genes & Development 16 (19): 2497–2508. doi:10.1101/gad.1022002.
- ↑ 31,0 31,1 31,2 Martinez J, Patkaniowska A, Urlaub H, Luhrmann R and Tuschl T (2002). "Single-stranded antisense siRNAs guide target RNA cleavage in RNAi". Cell 110 (5): 563–574. doi:10.1016/S0092-8674(02)00908-X.
- ↑ 32,0 32,1 Liu J, Carmell MA, Rivas FV, Marsden CG, Thomson JM, Song JJ, Hammond SM, Joshua-Tor L and Hannon GJ (2004). "Argonaute2 is the catalytic engine of mammalian RNAi". Science 305 (5689): 1437–1441. doi:10.1126/science.1102513.
- ↑ Martinez J and Tuschl T (2004). "RISC is a 5′ phosphomonoester-producing RNA endonuclease". Genes & Development 18 (9): 975–980. doi:10.1101/gad.1187904.
- ↑ 34,0 34,1 34,2 Meister G, Landthaler M, Patkaniowska A, Dorsett Y, Teng G and Tuschl T (2004). "Human Argonaute2 mediates RNA cleavage targeted by miRNAs and siRNAs". Molecular Cell 15 (2): 1403–1408. doi:10.1016/j.molcel.2004.07.007.
- ↑ 35,0 35,1 35,2 Mourelatos Z, Dostie J, Paushkin S, Sharma A, Charroux B, Abel L, Rappsilber J, Mann M and Dreyfuss G (2002). "miRNPs: a novel class of ribonucleoproteins containing numerous microRNAs". Genes & Development 16 (6): 720–728. doi:10.1101/gad.974702.
- ↑ 36,0 36,1 36,2 36,3 Hutvágner G and Zamore PD (2002). "A microRNA in a multiple-turnover RNAi enzyme complex". Science 297 (5589): 2056–2060. doi:10.1126/science.1073827.
- ↑ Hall TM (2005). "Structure and function of Argonaute proteins". Cell 13 (10): 1403–1408. doi:10.1016/j.str.2005.08.005.
- ↑ Chendrimada TP, Gregory RI, Kumaraswamy E, Norman J, Cooch N, Nishikura K and Shiekhatter R (2005). "TRBP recruits the Dicer complex to Ago2 for microRNA processing and gene silencing". Nature 436 (7051): 740–744. doi:10.1038/nature03868.
- ↑ Wang HW, Noland C, Siridechadilok B, Taylor DW, Ma E, Felderer K, Doudna JA and Nogales E (2009). "Structural insights into RNA processing by the human RISC-loading complex". Nature Structural & Molecular Biology 16 (11): 1148–1153. doi:10.1038/nsm.
- ↑ Fu Q and Yuan YA (2013). "Structural insights into RISC assembly facilitated by dsRNA-binding domains of human RNA helices A (DHX9)". Nucleic Acids Research 41 (5): 3457–3470. doi:10.1093/nar/gkt042.
- ↑ Yoo BK, Santhekadur PK, Gredler R, Chen D, Emdad L, Bhutia S, Pannell L, Fisher PB and Sarkar D (2011). "Increased RNA-induced silencing complex (RISC) activity contributes to hepatocellular carcinoma". Hepatology 53 (5): 1538–1548. doi:10.1002/hep.24216.
- ↑ Yoo BK, Emdad L, Lee SG, Su Z, Santhekadur P, Chen D, Gredler R, Fisher PB and Sarkar D (2011). "Astrocyte elevated gene (AEG-1): a multifunctional regulator of normal and abnormal physiology". Pharmacology & Therapeutics 130 (1): 1–8. doi:10.1016/j.pharmthera.2011.01.008.
- ↑ Djikeng A, Shi H, Tschudi C, Shen S and Ullu E (2003). "An siRNA ribonucleoprotein is found associated with polyribosomes in Trypanosoma brucei". RNA 9 (7): 802–808. doi:10.1261/rna.5270203.
- ↑ Sen GL, Wehrman TS and Blau HM (2005). "mRNA translation is not a prerequisite for small interfering RNA-mediated mRNA cleavage". Differentiation 73 (6): 287–293. doi:10.1111/j.1432-0436.2005.00029.
- ↑ Saumet A and Lecellier CH (2006). "Anti-viral RNA silencing: do we look like plants?". Retrovirology 3: 3. doi:10.1186/1742-4690-3-3.
- ↑ Bartel DP (2009). "MicroRNAs: target recognition and regulatory functions". Cell 136 (2): 215–233. doi:10.1016/j.cell.2009.01.002.
- ↑ Jones-Rhoades MW, Bartel DP and Bartel B (2006). "MicroRNAs and their regulator roles in plants". Annual Review of Plant Biology 57: 19–53. doi:10.1146/annurev.arplant.57.032905.105218.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Sontheimer, EJ (2005). "Assembly and function of RNA silencing complexes". Nature Reviews Molecular Cell Biology 6 (2): 127. doi:10.1038/nrm1568.
- Fu, Q.; Yuan, Y. A. (2013). "Structural insights into RISC assembly facilitated by dsRNA-binding domains of human RNA helicase A (DHX9)". Nucleic Acids Research 41 (5): 3457. doi:10.1093/nar/gkt042.
- Schwarz D S, Tomari Y, Zamore P D (2004). "The RNA-induced silencing complex is a Mg2+-dependent endonuclease". Current Biology 14 (9): 787–91. PMID 15120070. doi:10.1016/j.cub.2004.03.008.
