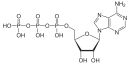Anhídrido de ácido
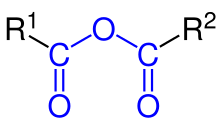
Xeralmente, un anhídrido de ácido é un composto orgánico formado por dous grupos acilo enlazados ao mesmo átomo de oxíxeno.[1] Normalmente, os grupos acilo son dun mesmo tipo de ácido carboxílico, polo que se di que son anhídridos simétricos con fórmula (RC(O))2O. Estes anhídridos simétricos noméanse substituíndo a palabra ácido do nome do seu ácido carboxílico parental pola palabra anhídrido.[2] Así, (CH3CO)2O denomínase anhídrido acético. Tamén existen anhídridos ácidos mixtos ou asimétricos, como o anhídrido acético fórmico (neste caso os nomes dos dous ácidos colócanse por orde alfabética).
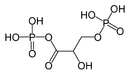
Un ou ambos os grupos acilo dun anhídrido de ácido poden tamén derivar doutro tipo de ácidos orgánicos, como o ácido sulfónico ou o ácido fosfónico. Ademais, un dos grupos acilo do anhidro de ácido pode derivar dun ácido inorgánico como o ácido fosfórico. O anhídrido de ácido mixto 1,3-bisfosfoglicerato é un intermediato na formación do ATP na glicólise;[3] é o anhídrido mixto entre o ácido 3-fosfoglicérico e o ácido fosfórico. Os óxidos ácidos son o equivalente inorgánico dos anhídridos de ácidos e ás veces son clasificados como anhídridos de ácidos.
Preparación
[editar | editar a fonte]Os anhídridos de ácidos prepáranse na industria de diversas maneiras. O anhídrido acético prodúcese principalmente por carbonilación do metil acetato.[4] O anhídrido maleico prodúcese por oxidación do benceno ou o butano. As rutas de síntese no laboratorio enfatizan a deshidratación dos correspondentes ácidos. As condicións requiridas varían dun ácido a outro, pero un axente deshidratante común é o pentóxido de fósforo:
- 2 CH3COOH + P4O10 → CH3C(O)OC(O)CH3 + "(HO)2P4O9"
Os cloruros ácidos son tamén precursores efectivos [5]
- CH3C(O)Cl + HCO2Na → HCO2COCH3 + NaCl
Anhídridos mixtos que conteñen o grupo acetilo prepáranse a parti de cetenas:
- RCO2H + H2C=C=O → RCO2C(O)CH3
Reaccións
[editar | editar a fonte]Os anhídridos de ácido son unha fonte de grupos acilo reactivos, e as súas reaccións e usos lembran ás dos haluros de acilo. En reaccións con substratos próticos, as reaccións dan iguais cantidades de produtos acilados e ácidos carboxílicos:
- RC(O)OC(O)R + HY → RC(O)Y + RCO2H
onde HY = HOR (alcohois), HNR'2 (amoníaco, aminas primarias e secundarias), anel aromático (ver acilación de Friedel-Crafts).
Os anhídridos de ácido tenden a ser menos electrofílicos que os cloruros de acilo, e só se transfire un grupo acilo por molécula de anhídrido de ácido, o cal dá lugar a unha menor eficiencia de átomo. Porén, o baixo custo do anhídrido acético faino unha elección común para as reaccións de acetilación.
Aplicacións e exemplos de anhídridos de ácidos
[editar | editar a fonte]- Exemplos de anhídridos de ácidos
-
O anhídrido acético prodúcese a grande escala para moitas aplicacións.
-
O dianhídrido naftalenotetracarboxílico utilízase na formación de compostos orgánicos complexos, e é un exemplo de dianhídrido.
-
O anhídrido maleico é un anhídrido cíclico, moi utilizado para facer recubrimentos industriais.
-
O anhídrido mixto 1,3-bisfosfoglicerato (mostrado en forma protonada) é unha molécula común no metabolismo.
-
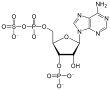
A 3'-fosfoadenosina-5'-fosfosulfato (APS) é un anhídrido mixto dos ácidos fosfótrico e sulfúrico, que é un intermediato metabólico.
O anhídrido acético é un importante composto químico industrial amplamente utilizado para producir ésteres, por exemplo, acetato de celulosa. O anhídrido maleico é o precursor de varias resinas por copolimerización con estireno. O anhídrido maleico é un dienoófilo na reacción de Diels-Alder.[6]
As moléculas de dianhídridos, que conteñen dúas funcións de anhídrido de ácido, utilízanse para sintetizar poliimidas e ás veces poliésteres e poliamidas. Exemplos de dianhídridos son: dianhídrido piromelítico (PMDA), dianhídrido 3,3’,4,4’-oxidiftálico (ODPA), dianhídrido 3,3’,4,4’-benzofenona tetracarboxílico (BTDA), anhídrido 4,4’-diftálico (hexafluoroisopropilideno) (6FDA), dianhídrido benzoquinonetetracarboxílico, dianhídrido etilenotetracarboxílico. Os polianhídridos son unha clase de polímeros caracterizados por teren enlaces anhídrido que conectan unidades repetidas do esqueleto da cadea do polímero.
Análogos de xofre
[editar | editar a fonte]O xofre pode substituír o oxíxeno, tanto no grupo carbonilo coma na ponte. No primeiro caso, o nome do grupo acilo encérrase entre parénteses para evitar a ambigüidade no nome,[2] por exemplo, anhídrido (tioacético) (CH3C(S)OC(S)CH3). Cando dous grupos acilo están unidos ao mesmo átomo de xofre, o composto resultante denomínase tioanhídrido,[2] por exemplo, tioanhídrido acético ((CH3C(O))2S).
Notas
[editar | editar a fonte]- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "acid anhydrides"
- ↑ 2,0 2,1 2,2 Panico, R.; Powell, W. H.; Richer, J. C., eds. (1993). "Recommendation R-5.7.7". A Guide to IUPAC Nomenclature of Organic Compounds. IUPAC/Blackwell Science. pp. 123–25. ISBN 0-632-03488-2. [1] Arquivado 08 de xuño de 2011 en Wayback Machine.
- ↑ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. "Eastman Chemical Company Acetic Anhydride Process" Catalysis Today (1992), volume 13, pp.73-91. doi 10.1016/0920-5861(92)80188-S
- ↑ Lewis I. Krimen (1988), "Acetic Formic Anhydride", Org. Synth.; Coll. Vol. 6: 8. [2]
- ↑ Heimo Held, Alfred Rengstl, Dieter Mayer "Acetic Anhydride and Mixed Fatty Acid Anhydrides" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a01_065