Endonuclease homing

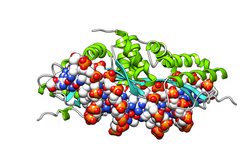
Homodímero de I-CreI sobre o ADN: o encima móstrase completo, cada monómero dunha cor, rosa ou amarela. Os átomos do ADN móstranse como esferas coloreadas segundo o elemento químico.
As endonucleasas homing (ou endonucleases buscadoras de dianas) son un tipo especial de encimas de restrición codificados en xenes situados en intróns, como fusións con proteínas do hóspede, ou en inteínas con autosplicing, que actúan sobre o ADN da propia célula que as sintetiza, e só sobre un punto concreto (ou moi poucos) do xenoma, xeralmente sobre o alelo oposto ao que as codifica. A palabra inglesa homing que lles dá nome alude ao movemento ou traslado deses xenes de intróns ou inteínas cara a dito alelo, como se procuraran ou se guiaran cara a unha diana determinada situada nun punto do xenoma.[1] A reparación do ADN hidrolizado pola célula hóspede frecuentemente ten como resultado que a endonuclease homing se copia no sitio de clivaxe. As endonucleases homing poden transmiir os seus xenes horizontalmente nunha poboación, incrementando a súa frecuencia alélica a máis que na proporcion mendeliana esperada.
Comparación con encimas de restrición típicos
[editar | editar a fonte]Comparadas cos encimas de restrición tradicionais de tipo II, as endonucleases homing diferéncianse no seguinte:[2]
- Únense a secuencias de recoñecemento asimétricas e de grande lonxitude (de 12 a 40 pb), mentres que os encimas de restrición típicos se unen a secuencias de recoñecemento curtas (de 3 a 8 pb), normalmente simétricas.
- Toleran certa dexeneración na súa secuencia de recoñecemento, é dicir, lixeiras variacións en dita secuencia diminúen a actividade do encima, pero non a inhiben completamente.[3][4]
- Estruturalmente comparten motivos que permiten agrupalas en 4 familias, mentres que os encimas de restrición clásicos non se clasifican en familias estruturais claramente recoñecibles.
- A natureza das súas asociacións moleculares: estes encimas actúan como monómeros ou homodímeros, a miúdo unidas a outras proteínas asociadas, ou ben a moléculas de ARN formando ribonucleoproteínas,[5] mentres que os encimas de restrición típicos, cando necesitan subunidades accesorias, requiren outro tipo de cofactores.
- A súa distribución filoxenética: estes encimas atopáronse nos tres dominios de seres vivos (arqueas, bacterias e eucariotas) mentres que os encimas de restrición clásicos só aparecen en procariotas (bacterias e arqueas) e algúns tipos de virus de eucariotas.[6][7]
Nomenclatura
[editar | editar a fonte]O sistema de nomenclatura que se adoptou para elas é similar ao dos encimas de restrición pero con algunhas engádegas:
- Indícase en primeiro lugar un prefixo seguido de guión, "I-" se o encima é codificado por un intrón ou "PI-" se o for por unha inteína (do inglés "protein insert", "inserto de proteína").
- Seguidamente, van tres letras que indican o xénero e a especie do organismo que a produce, das cales, a primeira letra vai en maiúsculas e corresponde ao xénero e as dúas seguintes, en minúsculas, á especie.
- Finalmente, un número romano que distingue os múltiples encimas encontrados dentro dun mesmo organismo.
Como exemplo, podemos citar o enzima PI-TliII, que é o segundo encima codificado nunha inteína descuberto no organismo Thermococcus litoralis; ou H-DreI, primeira endonuclease homing artificial creada no laboratorio a partir dos encimas I-DmoI e I-CreI de Desulfurococcus mobilis e Chlamydomonas reinhardtii, respectivamente.
Orixe e mecanismo de funcionamento
[editar | editar a fonte]Aínda que a orixe e a función das endonucleases homing aínda se encontra en proceso de investigación, as últimas hipóteses considéranas como elementos xenéticos egoístas,[9] de xeito similar aos transposóns, xa que estes encimas facilitan a autoperpetuación do elemento xenético ao que pertencen sen que se puidese determinar de forma clara que isto ofrece unha vantaxe selectiva ao organismo.
A secuencia de recoñecemento á que se unen é longa dabondo como para que a súa presenza se produza ao chou cunha probabilidade moi reducida (aproximadamente cada 7•1010 pb),[10] e habitualmente hai unha única repetición desta secuencia en todo o xenoma, que é o xene que codifica a endonuclease (xene HEG, homing endonuclease gene). Este xene HEG atópase precisamente en medio da secuencia de recoñecemento que ten que recoñecer o encima que codifica, interrompéndoa, e impedindo así que a endonuclease homing corte o ADN que o leva.
Na situación inicial previa á transmisión, o xene que leva o xene HEG denomínase alelo HEG+, mentres que no cromosoma homólogo o xene homólogo non leva o xene HEG e denomínase "alelo HEG-", polo que este último é susceptible de ser cortado polo encima. Unha vez que o encima é sintetizado exerce a súa acción rompendo o cromosoma no alelo HEG-, e despois o sistema de reparación do ADN celular responde realizando unha recombinación, utilizando como patrón o ADN intacto do alelo oposto HEG+ para así reparar o dano. Este ADN que é utilizado como patrón contén o xene da endonuclease. Deste xeito, o xene cópiase no alelo que inicialmente non o tiña, polo que o xene se propaga.[11]
Este proceso de procura da diana (o alelo que non ten o xene, para despois integrarse nel) é coñecido como homing (xeralmente a palabra non se traduce).[11]
Familias estruturais
[editar | editar a fonte]
| ||||||||||||||||
Actualmente, recoñécense 6 familias estruturais destes encimas, segundo aos motivos conservados que presentan:[2]
- LAGLIDADG: Conteñen 1 ou 2 motivos LAGLIDADG. A secuencia LAGLIDADG é unha secuencia conservada de aminoácidos onde cada letra corresponde a un residuo. Esta secuencia intervén directamente na catálise da actividade encimática, é dicir, no corte do ADN. Os encimas que posúen un único motivo, forman homodímeros creando unha fenda na súa interface que interacciona co suco menor do ADN. Nesta fenda dispóñense os dous motivos LAGLIDADG. Os encimas que posúen dous motivos, actúan como monómeros creando unha fenda de maneira similar.
- GIY-YIG: Conteñen un único motivo CIY-YIG, na rexión N-terminal, que interacciona co ADN no sitio de corte. O encima prototípico desta familia é o I-TevI, que actúa como monómero.
- His-Cys box: Os encimas desta familia conteñen unha rexión de 30 aminoácidos na que se inclúen 5 aminoácidos conservados: dúas histidinas e tres cisteínas; que coordinan o catión metálico necesario para a catálise. O encima mellor caracterizado desta familia é I-PpoI, que actúa como monómero.
- H-N-H: Conteñen unha secuencia consenso de aproximadamente 30 aminoácidos, que inclúe dúas parellas de histidinas conservadas e unha asparaxina, que forman un domino "dedo de cinc". I-HmuI is the best characterized enzyme of this family, and acts as a monomer. Its structure was reported in 2004.[13]
- PD-(D/E)xK: Estes encimas conteñen un dominio catalítico de nuclease canónico típico das endonucleases de restrición de tipo II. Os encimas mellor caracterizados desta familia é I-Ssp6803I, que actúa como tetrámero. A súa estrutura foi resolta en 2007.[14]
- Vsr-like: Estes encimas foron descubertos na Base de datos Metaxenómica de Mostraxe do Océano Global (Global Ocean Sampling Metagenomic Database) e descritas en 2009. O termo 'Vsr-like' refírese á presenza dun dominio nuclease C-terminal que mostra unha homoloxía recoñecible coas endonucleases bacterianas VSR (Very Short Patch Repair).[15]
Arquitectura do dominio
[editar | editar a fonte]| Endonuclease homing | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura e recoñecemento do ADN dunha endonuclease homing bifuncional e un factor de splicing do intrón de grupo i | |||||||||
| Identificadores | |||||||||
| Símbolo | LAGLIDADG_1 | ||||||||
| Pfam | PF00961 | ||||||||
| Pfam clan | CL0324 | ||||||||
| InterPro | IPR001982 | ||||||||
| SCOPe | 1af5 / SUPFAM | ||||||||
| |||||||||
| Endonuclease homing | |||||||||
|---|---|---|---|---|---|---|---|---|---|
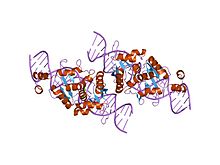 a endonuclease homing i-scei unida á súa rexión de recoñecemento do ADN | |||||||||
| Identificadores | |||||||||
| Símbolo | LAGLIDADG_2 | ||||||||
| Pfam | PF03161 | ||||||||
| Pfam clan | CL0324 | ||||||||
| InterPro | IPR004860 | ||||||||
| |||||||||
| Endonuclease homing | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura cristalina do miniprecursor pi-scei | |||||||||
| Identificadores | |||||||||
| Símbolo | Hom_end | ||||||||
| Pfam | PF05204 | ||||||||
| Pfam clan | CL0324 | ||||||||
| InterPro | IPR007869 | ||||||||
| SCOPe | 1gpp / SUPFAM | ||||||||
| |||||||||
| Endonuclease homing | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura cristalina do miniprecursor pi-scei | |||||||||
| Identificadores | |||||||||
| Símbolo | Hom_end_hint | ||||||||
| Pfam | PF05203 | ||||||||
| Pfam clan | CL0363 | ||||||||
| InterPro | IPR007868 | ||||||||
| SCOPe | 1gpp / SUPFAM | ||||||||
| |||||||||
A estrutura cristalina da endonuclease homing PI-Sce revelou que consta de dous dominios: un centro endonucleolítico que lembra ao domino C-terminal da proteína Hedgehog de Drosophila melanogaster, e un segundo dominio (o dominio Hint asociado á endonuclease homing) que contén o sitio activo para o splicing da proteína.[16]
Notas
[editar | editar a fonte]- ↑ Cf. Barry L. Stoddard, «Homing endonuclease structure and function», Quarterly Reviews of Biophysics, 38, 1 (2006), págs. 49–95 (50).
- ↑ 2,0 2,1 2,2 Belfort M and Roberts RJ (1995). "Homing endonucleases: keeping the house in order". Nucleic Acids Res 25 (17): 3379–88. PMID 9254693. doi:10.1093/nar/25.17.3379.
- ↑ Gimble FS, Wang J (1996). "Substrate recognition and induced DNA distortion by the PI-SceI endonuclease, an enzyme generated by protein splicing". J Mol Biol 263 (2): 163–80. PMID 8913299. doi:10.1006/jmbi.1996.0567.
- ↑ Argast GM, Stephens KM, Emond MJ, Monnat RJ Jr (1998). "I-PpoI and I-CreI homing site sequence degeneracy determined by random mutagenesis and sequential in vitro enrichment". J Mol Biol 280 (3): 345–53. PMID 9665841. doi:10.1006/jmbi.1998.1886.
- ↑ Zimmerly S, Guo H, Eskes R, Yang J, Perlman PS, Lambowitz AM (1995). "A group II intron RNA is a catalytic component of a DNA endonuclease involved in intron mobility". Cell 83 (4): 529–38. PMID 7585955. doi:10.1016/0092-8674(95)90092-6.
- ↑ Roberts RJ, Macelis D (1997). "REBASE-restriction enzymes and methylases". Nucleic Acids Res 25 (1): 248–62. PMID 9016548.
- ↑ Lambowitz AM, Belfort M (1993). "Introns as mobile genetic elements". Annu Rev Biochem 62: 587–622. PMID 8352597. doi:10.1146/annurev.bi.62.070193.003103.
- ↑ Chevalier BS, Kortemme T, Chadsey MS, Baker D, Monnat RJ, Stoddard BL (2002). "Design, activity, and structure of a highly specific artificial endonuclease". Moll Cell 10 (4): 895–905. PMID 12419232. doi:10.1016/S1097-2765(02)00690-1.
- ↑ Edgell DR (2009). "Selfish DNA: homing endonucleases find a home". Curr Biol 19 (3): R115–R117. PMID 19211047. doi:10.1016/j.cub.2008.12.019.
- ↑ Jasin M (1996). "Genetic manipulation of genomes with rare-cutting endonucleases". Trends Genet 12 (6): 224–8. PMID 8928227. doi:10.1016/0168-9525(96)10019-6.
- ↑ 11,0 11,1 Burt A, Koufopanou V (2004). "Homing endonuclease genes: the rise and fall and rise again of a selfish element". Curr Opin Genet Dev 14 (6): 609–15. PMID 15531154. doi:10.1016/j.gde.2004.09.010.
- ↑ Jurica MS, Monnat RJ, Stoddard BL (1998). "DNA recognition and cleavage by the LAGLIDADG homing endonuclease I-CreI". Moll Cell 2 (4): 469–76. PMID 9809068. doi:10.1016/0092-8674(95)90092-6.
- ↑ Shen, B.W.; et al. (2004). "DNA binding and cleavage by the HNH homing endonuclease I-HmuI". J. Mol. Biol. 342 (1): 43–56. PMID 15313606. doi:10.1016/j.jmb.2004.07.032.
- ↑ Zhao, L.; et al. (2007). "The restriction fold turns to the dark side: a bacterial homing endonuclease with a PD-(D/E)-XK motif". EMBO Journal 26 (9): 2432–2442. PMC 1864971. PMID 17410205. doi:10.1038/sj.emboj.7601672.
- ↑ Dassa, B.; et al. (2009). "Fractured genes: a novel genomic arrangement involving new split inteins and a new homing endonuclease family". Nucleic Acids Research 37 (8): 2560–2573. PMC 2677866. PMID 19264795. doi:10.1093/nar/gkp095.
- ↑ Moure CM, Gimble FS, Quiocho FA (outubro 2002). "Crystal structure of the intein homing endonuclease PI-SceI bound to its recognition sequence". Nat. Struct. Biol. 9 (10): 764–70. PMID 12219083. doi:10.1038/nsb840.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]Bases de datos:
- Base de datos exhaustiva de endonucleases, en New England Biolabs© con información biolóxica, estrutural, cinética e comercial sobre miles de encimas. Tamén contén referencias bibliográficas específicas para cada molécula: Roberts RJ, Vincze T, Posfai, J, Macelis D. "REBASE" (en inglés). Consultado o 08-02-2014.
Restriction Enzyme Database
- Base de datos de inteínas, en New England Biolabs©. Perler FB. "InBase" (en inglés). Arquivado dende o orixinal o 02-08-2010. Consultado o 08-02-2014.
The Intein Database and Registry
. (Perler FB. InBase: the Intein Database. (2002). Nucleic Acids Res, 30, 1, xaneiro, páxinas 383-4, PMID 11752343).