Enantiómero
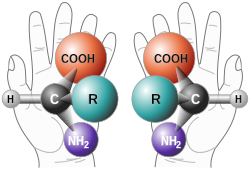

En química os enantiómeros (ou isómeros ópticos) son unha clase de estereoisómeros tales que na parella de compostos isómeros un é imaxe especular do outro e non son superpoñibles, de xeito similar ao que ocorre coas dúas mans dunha persoa.[1] A enantiomería é un tipo de estereoisomería. O termo deriva do grego ἐνάντιος, enantios (oposto), e μέρος, meros (parte ou porción). Os compostos enantiopuros son mostras que posúen, dentro dos límites de detección, só unha das dúas moléculas quirais.[2]
Un obxecto quiral e a súa imaxe especular denomínanse tamén enantiomorfos ou formas enantiomorfas. A isomería óptica denomínase tamén enantiomerismo,
Propiedades[editar | editar a fonte]
As dúas formas enantiómeras teñen as mesmas propiedades físicas agás a interacción coa luz polarizada (a cal oscila nun só plano): un isómero desvía o plano de polarización cara á dereita, e o outro isómero desvíao en dirección contraria.

Tamén teñen as mesmas propiedades químicas, excepto se reaccionan con outras moléculas quirais. Os enantiómeros presentan moi diferente actividade biolóxica, e a maioría das moléculas presentes nos seres vivos son quirais. Por exemplo, a R(-)adrenalina é máis potente que a S(+)adrenalina.[4]
A mestura en cantidades equimolares de cada enantiómero nunha solución denomínase mestura racémica, a cal é opticamente inactiva.

Características[editar | editar a fonte]
As moléculas que conteñen un só estereocentro (carbono asimétrico, centro estereoxénico ou centro quiral) son sempre opticamente activas (quirais). Aínda que isto non é certo necesariamente para algunhas moléculas con máis dun estereocentro. Este é o caso das formas meso, as cales teñen centros asimétricos que son iguais e opostos, polo que a molécula é opticamente inactiva, como ocorre co ácido meso-tartárico. Os enantiómeros teñen as mesmas propiedades químicas e físicas, a excepción da súa resposta ante a luz polarizada (actividade óptica), polo que se denominan isómeros ópticos.
As moléculas aquirais, sen estereocentros, son opticamente inactivas.
A rotación específica da luz polarizada, que se mide utilizando un polarímetro, é unha propiedade física característica da estrutura de cada enantiómero, da súa concentración e do disolvente empregado na medición.
A medida da rotación específica indica a composición enantiomérica do produto.
Representación[editar | editar a fonte]

Por comodidade, os enantiómeros adoitan representarse por medio da proxección de Fischer. Esta consiste en imaxinar que se observa a molécula de tal maneira que dous dos enlaces (representados horizontalmente) están cara a adiante e os outros dous (representados verticalmente) cara a atrás. Desta maneira fórmase unha especie de cruz, co carbono asimétrico no centro, que se mostra como a intersección das liñas. Os grupos que se encontren na liña horizontal (X, Z) están cara a adiante, e os verticais (W, Y) na parte de atrás.
Nomenclaturas[editar | editar a fonte]
Formas dextro e levo[editar | editar a fonte]
Un enantiómero que fai rotar o plano da luz polarizada á dereita (no sentido das agullas do reloxo), dise que é dextrorrotatorio, dextroxiro ou unha forma dextro, e xeralmente se lle coloca diante do seu nome unha letra "de" minúscula (d), ou un signo positivo (+). Se fai rotar o plano á esquerda, é levorrotatorio, levoxiro ou unha forma levo, e pode colocárselle como prefixo un "ele" minúsculo (l), ou un signo negativo (- [5]).
Nomenclatura D-L[editar | editar a fonte]
- Artigo principal: Nomenclatura D-L.
Pártese da proxección de Fischer: proxéctase a molécula sobre o plano do papel coas seguintes condicións:
- A cadea carbonada sitúase en vertical, cos grupos que a integran en dirección á parte posterior do plano.
- A cadea oriéntase coa parte máis oxidada cara a arriba e a máis reducida cara a abaixo.
- Os substituíntes que non integran a cadea carbonada quedan horizontais e están dirixidos cara a parte anterior do plano.[6]
Cando se aplica este convenio, chamamos isómero D ao que presenta o grupo funcional á dereita desde o punto de vista do observador, e chamamos isómero L ao que o ten cara á esquerda.
- Nas pentosas e hexosas considérase grupo funcional o grupo OH do penúltimo carbono (por ser o carbono asimétrico máis afastado do grupo aldehido ou cetona.)
- Nos aminoácidos considérase grupo funcional ao grupo amino (NH2) do segundo carbono (chamado carbono α.)
Nomenclatura R-S[editar | editar a fonte]

Unha forma non experimental de nomealos é a que segue as regras de Cahn-Ingold-Prelog: Consiste en numerar os grupos ou átomos enlazados ao carbono asimétrico, de acordo coa súa prioridade (o número 1 ao máis importante e o 4 ao de menor importancia), se seguindo o sentido das agullas do reloxo (sen contar ao de menor importancia) esta numeración segue a mesma dirección de ditas agullas colócase un R (do latín rectus), entanto que se o fai en sentido contrario ás agullas do reloxo ponse un S (do latín sinister). No caso de que o grupo ou átomo con menor prioridade se encontre adiante segundo a proxección de Fisher (na horizontal), considérase que se está vendo desde atrás da molécula, polo que se considera ao revés. Noutras palabras se segundo Cahn-Ingold-Prelog, é R debe agora considerarse como S. No caso de que exista máis dun carbono asimétrico debe colocarse xunto á letra R ou S, o número do carbono correspondente. A prioridade do átomo está definida en primeiro lugar polo seu número atómico ou peso atómico en orde crecente (normalmente o de menor prioridade adoita a ser un hidróxeno), e en segundao lugar polo número atómico dos átomos aos que está enlazado, considerando os dobres enlaces como se estivese unido a dous deses átomos e de maneira análoga os triplos enlaces como se estivese unido a tres deses átomos.
Separación de enantiómeros[editar | editar a fonte]
A separación de enantiómeros presentes nunha mestura racémica denomínase resolución. Os métodos de resolución máis utilizados son:
- Resolución química. Consiste na separación dos enantioméros por conversión da mestura racémica nunha mestura de diastereoisómeros. Para iso, a mestura de enantiómeros faise reaccionar cun composto quiral, denominado axente de resolución, de modo que os enantiómeros se transforman en diastereoisómeros, os cales poden separarse por destilación, cristalización ou cromatografía. Unha vez separados, procédese á eliminación do axente de resolución para obter cada un dos enantiómeros puros.
- Resolución cromatográfica. Baséase na utilización de técnicas cromatográficas empregando como fase estacionaria un composto quiral. A separación baséase na diferente interacción de ambos os enantiómeros coa fase estacionaria quiral. O enantiómero que forma complexos máis estables coa fase estacionaria quiral móvese máis lentamente que o enantiómero que forma complexos menos estables; como resultado, elúen a diferentes velocidades e sepáranse ao longo da columna.
Notas[editar | editar a fonte]
- ↑ IUPAC Gold Book. Compendium of Chemical Terminology, 2ª ed. (1997). Versión en liña: (2006-) "enantiomer"
- ↑ IUPAC Gold Book. Compendium of Chemical Terminology, 2ª ed. (1997). Versión en liña: (2006-) "enantiomerically pure (enantiopure)"
- ↑ Medicamentos: Un viaje a lo largo de la evolución histórica del descubrimiento de fármacos Volume 2. Enrique Raviña Rubira, Editorial da Universidade de Santiago de Compostela, 2008. ISBN 8498870089. Páxina 816
- ↑ Química farmacéutica. En: Remington Farmacia. The Science and Practice of Pharmacy. Volume 1. Alfonso R. Gennaro, Ed. Médica Panamericana, 2003. ISBN 9500618664. Páxina 532
- ↑ Tratado de Química Orgánica: Tomo 1 (1ª parte). Química Orgánica sistemática. F. Klages. Editorial Reverté, 1968. ISBN 8429173145. Páxina 21
- ↑ Nomenclatura D-L. Curso de biomoléculas. Juan Manuel González Mañas. Universidade do País Vasco.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]

![{\displaystyle {\left[\alpha \right]}_{D}^{25^{\circ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0d38060bd8c58c32cb4bf04d93affd485f48a67f)



