Beta-péptido
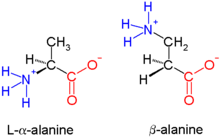

Os beta-péptidos (β-péptidos) son péptidos derivados de β-aminoácidos, nos cales o grupo amino está unido ao carbono β (é dicir, o carbono que está a dous átomos de carbono de distancia do grupo carboxilato). O β-aminoácido parental é a β-alanina (H2NCH2CH2CO2H), unha substancia natural, pero a maioría dos exemplos presentan substituíntes en lugar dun ou máis enlaces C-H. Os β-péptidos xeralmente non aparecen na natureza. Están explorándose antibióticos baseados en β-péptidos como un xeito de evadir a resistencia a antibióticos.[1] Os estudos iniciais neste campo publicáronos en 1996 os grupos de Dieter Seebach[1] e de Samuel Gellman.[2]
Estrutura[editar | editar a fonte]
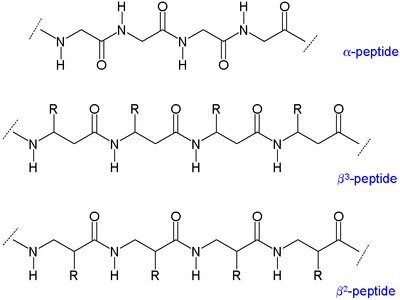
Como os β-aminoácidos teñen dous carbonos dispoñibles para a substitución, teñen catro sitios para que se una o grupo do residuo orgánico (incluída a quiralidade; a diferenza dos dous que teñen os α-aminoácidos).[3] En consecuencia, existen dous grandes tipos de β-aminoácidos que difiren no carbono ao cal está unido o residuo: os que teñen o residuo orgánico (R) despois do grupo amino denomínanse β3 e os que o teñen despois do grupo carbonilo denomínanse β2. Un β-péptido pode constar de aminoácidos dun só destes tipos (β2-péptidos e β3-péptidos), ou ter unha combinación de ambos os dous. Ademais, un β-aminoácido pode formar un anel usando ambos os sitios e tamén ser incorporado a un péptido.[3]
Síntese[editar | editar a fonte]
Os β-aminoácidos poden prepararse por moitas rutas,[4][5] incluíndo algunhas baseados na síntese de Arndt-Eistert.
Estrutura secundaria[editar | editar a fonte]
Como os seus esqueletos moleculares son máis longos que os dos péptidos normais, os β-péptidos forman estruturas secundarias dispares. Os substituíntes alquilo tanto nas posicións α coma nas β nun β-aminoácido favorecen a conformación gauche no enlace entre o carbono α e o β. Isto tamén afecta a estabilidade termodinámica da estrutura.
Informouse de moitos tipos de estruturas helicoidais consistentes en β-péptidos. Estes tipos de conformación distínguense polo número de átomos do anel de enlaces de hidróxeno que se forma en solución; informouse de hélices de 8 átomos no anel, hélices de 10 átomos, de 12, de 14,[6] e de 10/12. En xeral, os β-péptidos forman unha hélice máis estable que os α-péptidos.[7]
Potencial clínico[editar | editar a fonte]
Os β-péptidos son estables contra a degradación proteolítica in vitro e in vivo, o cal é unha potencial vantaxe sobre os péptidos naturais.[8] Os β-péptidos foron usados para imitar antibióticos baseados en péptidos naturais como as magaininas, que son moi potentes pero difíciles de usar como medicamentos porque son degradados por encimas proteolíticos.[9]
Exemplos de β-aminoácidos[editar | editar a fonte]
Existen β-aminoácidos cunha ampla variedade de substituíntes. Noméanse por analoxía cos α-aminoácidos biolóxicos. Os seguintes atópanse na natureza: β-alanina, β-leucina, β-lisina, β-arxinina, β-glutamato, β-glutamina, β-fenilalanina e β-tirosina.[10]:23 Deles, a β-alanina atópase en mamíferos e é incorporada ao ácido pantoténico (vitamina B5), un nutriente esencial.[10]:2 Dous α-aminoácidos son tamén estruturalmente β-aminoácidos: ácido aspártico e asparaxina.[10]:218 As microcistinas son unha clase de compostos que conteñen un residuo β-isoaspartil (é dicir, un ácido aspártico enlazado polo seu beta-carboxilo).[10]:23
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 Seebach D, Overhand M, Kühnle FNM, Martinoni B, Oberer L, Hommel U, Widmer H (xuño de 1996). "β-Peptides: Synthesis by Arndt-Eistert homologation with concomitant peptide coupling. Structure determination by NMR and CD spectroscopy and by X-ray crystallography. Helical secondary structure of a -hexapeptide in solution and its stability towards pepsin". Helvetica Chimica Acta 79 (4): 913–941. doi:10.1002/hlca.19960790402.
- ↑ Appella DH, Christianson LA, Karle IL, Powell DR, Gellman SH (1996). "β-Peptide Foldamers: Robust Helix Formation in a New Family of -Amino Acid Oligomers". J. Am. Chem. Soc. 118 (51): 13071–2. doi:10.1021/ja963290l.
- ↑ 3,0 3,1 Seebach D, Matthews JL (1997). "β-Peptides: a surprise at every turn" (PDF). Chem. Commun. (21): 2015–22. doi:10.1039/a704933a.
- ↑ Basler B, Schuster O, Bach T (novembro de 2005). "Conformationally constrained β-amino acid derivatives by intramolecular [2 + 2]-photocycloaddition of a tetronic acid amide and subsequent lactone ring opening". J. Org. Chem. 70 (24): 9798–808. PMID 16292808. doi:10.1021/jo0515226.
- ↑ Murray JK, Farooqi B, Sadowsky JD, et al. (setembro de 2005). "Efficient synthesis of a β-peptide combinatorial library with microwave irradiation". J. Am. Chem. Soc. 127 (38): 13271–80. PMID 16173757. doi:10.1021/ja052733v.
- ↑ Vasantha, Basavalingappa; George, Gijo; Raghothama, Srinivasarao; Balaram, Padmanabhan (xaneiro de 2017). "Homooligomeric β3 (R)-valine peptides: Transformation between C14 and C12 helical structures induced by a guest Aib residue". Biopolymers 108 (1): e22935. ISSN 1097-0282. PMID 27539268. doi:10.1002/bip.22935. Arquivado dende o orixinal o 2022-02-13. Consultado o 2022-05-07.
- ↑ Gademann K, Hintermann T, Schreiber JV (outubro de 1999). "Beta-peptides: twisting and turning". Curr. Med. Chem. 6 (10): 905–25. PMID 10519905. doi:10.2174/092986730610220401154606.
- ↑ Beke T, Somlai C, Perczel A (xaneiro de 2006). "Toward a rational design of β-peptide structures". J Comput Chem 27 (1): 20–38. PMID 16247761. doi:10.1002/jcc.20299.
- ↑ Porter EA, Weisblum B, Gellman SH (2002). "Mimicry of host-defense peptides by unnatural oligomers: antimicrobial β-peptides". J. Am. Chem. Soc. 124 (25): 7324–30. PMID 12071741. doi:10.1021/ja0260871.
- ↑ 10,0 10,1 10,2 10,3 Juaristi, E.; Soloshonok, Vadim A. (6 de maio de 2005). Enantioselective Synthesis of Beta-Amino Acids. Hoboken, New Jersey (NJ): Wiley Inc. ISBN 9780471698470. OCLC 559972352. Arquivado dende o orixinal o 7 de maio de 2022. Consultado o 7 de maio de 2022.
