Potencial de eléctrodo
O potencial de eléctrodo (E) en electroquímica, é, de acordo coa definición da IUPAC,[1] a forza electromotriz dunha cela galvánica construída con dous eléctródos:
- na parte esquerda da cela está o eléctrodo de hidróxeno estándar, e
- na parte dereita, está o outro eléctrodo do cal se define o potencial.
Por convención:
- ECela = ECátodo − EÁnodo
Para a cela co eléctrodo de hidróxeno estándar (cuxo potencial é cero por convención), obtense:
- ECela = EDereita − 0 = EEléctrodo
A convención esquerda-dereita é consistente co acordo internacional de que os potenciais redox se dean para reaccións escritas na forma de semirreaccións de redución.
O potencial de eléctrodo mídese en voltios (V).
Orixe e interpretación[editar | editar a fonte]
O potencial de eléctrodo aparece na interface entre un eléctrodo e un electrólito debido á transferencia de especies cargadas a través da interface, adsorción específica de ións na interface, e adsorción específica/orientación de moléculas polares, incluíndo as do solvente.
O potencial de eléctrodo é o potencial eléctrico nun compoñente eléctrodo. Nunha cela galvánica, haberá un potencial de eléctrodo para o cátodo, e outro para o ánodo. A diferenza entre os dous potenciais de eléctrodo é igual ao potencial da cela.
ECela = ECátodo − EÁnodo
O potencial de eléctrodo medido pode ser ou ben o do equilibrio no eléctrodo de traballo ("potencial reversible"), ou un potencial cunha reacción neta que non é cero no eléctrodo de traballo pero con corrente neta cero ("potencial de corrosión", "potencial mixto"), ou un potencial cunha corrente neta que non é cero no eléctrodo de traballo (como na corrosión galvánica ou voltametría). Os potenciais reversibles poden ser ás veces convertidos ao potencial estándar de eléctrodo para unha especie electroactiva dada por extrapolación dos valores medidos ao estado estándar.
O valor do potencial de eléctrodo en condicións de non equilibrio depende da natureza e composición das fases en contacto, e da cinética das reaccións de eléctrodo na interface (ver ecuación de Butler-Volmer).
Medida[editar | editar a fonte]
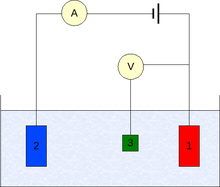
A medición faise xeralmente utilizando unha montaxe de tres eléctrodos como a da figura, que consta de:
- Eléctrodo de traballo
- Eléctrodo auxiliar
- Eléctrodo de referencia (eléctrodo de hidróxeno estándar ou equivalente).
O potencial de eléctrodo mídese por un voltímetro co terminal positivo conectado ao eléctrodo de traballo e o negativo ao de referencia. Na semicela asociada ao eléctrodo de traballo ten lugar a reacción baixo estudo; a semicela de referencia serve só para a medida do potencial.[2]
No caso de que a corrente neta non sexa cero no eléctrodo, é esencial minimizar a caída debida á lei de Ohm no electrólito, por exemplo, situando o eléctrodo de referencia preto da superficie do eléctrodo de traballo (por exemplo, como no capilar de Luggin), ou usando un electrólito de apoio (inerte) de condutividade o suficientemente alta. As medicións do potencial realízanse coa terminal positiva do electrómetro conectada ao eléctrodo de traballo e a terminal negativa conectada ao eléctrodo de referencia.
Notas[editar | editar a fonte]
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). versión XML online corrixida: http://goldbook.iupac.org (2006- ) creado por M. Nic, J. Jirat, B. Kosata; actualizacións compiladas por A. Jenkins. ISBN 0-9678550-9-8. doi 10.1351/goldbook. Entrada: "Electrode Potential"
- ↑ Cynthia G. Zoski, Handbook of Electrochemistry, Elsevier Science, 2007, páxina 5, ISBN 978-0-444-51958-0.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- John O'M. Bockris, Amulya K. N. Reddy, Modern Electrochemistry: An introduction to an interdisciplinary area - Volume 2, Plenum Press, 1977, ISBN 0-306-25002-0.
