ADN monocatenario multicopia
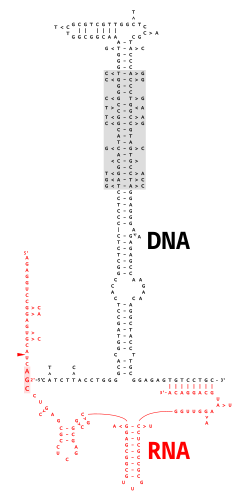
O ADN monocatenario multicopia (msDNA, do inglés multicopy single-stranded DNA) é un tipo de ADN satélite extracromosómico bacteriano que consta dunha molécula de ADN monocatenaria ligada covalentemente por medio dun enlace fosfodiéster 2'-5' a unha guanosina interna dunha molécula de ARN. Poden existir moitas copias do msDNA na célula. A quimera de ADN/ARN resultante posúe dous talos-bucles unidos por unha rama similar ás ramas que se encontran nos intermediarios do empalme do ARN. A rexión codificante do msDNA, chamada "retron", tamén codifica un tipo de reversotranscriptase, que é esencial para a síntese de msDNA.[2]
Descubrimento[editar | editar a fonte]
Antes do descubrimento do msDNA nas mixobacterias,[3][4] que son un grupo de bacterias que se enxamean e viven no solo, críase que os encimas reversotranscriptases (RT) só existían en eucariotas e virus. Este descubrimento levou a un aumento das investigacións neste campo. Como resultado, atopouse que o msDNA estaba amplamente distribuído entre as bacterias, incluíndo varias cepas de Escherichia coli e de bacterias patóxenas.[5] Posteriores investigacións descubriron semellanzas entre a reversotranscriptase codificada polo VIH e un marco de lectura aberto (ORF, open reading frame) atopado na rexión codificante do msDNA. As probas realizadas confirmaron a presenza de actividade de reversotranscriptase en lisados crus de cepas que contiñan retrons.[6] Aínda que se identificou provisionalmente un dominio RNase H no ORF retron, posteriormente viuse que a actividade de RNase H necesaria para a síntese de msDNA é subministrada en realidade polo hóspede.[7]
Retrons[editar | editar a fonte]
O descubrimento do msDNA suscitou grandes preguntas sobre en que seres vivos se orixinou a reversotranscriptase, xa que os xenes que codifican a reversotranscriptase (non necesariamente asociados con msDNA) se atoparon en procariotas, eucariotas, virus e arqueas. Despois de que se descubriu un fragmento de ADN que codificaba para a produción de msDNA en E. coli,[8] conxecturouse que os bacteriófagos puideron ser os responsables da introdución do xene da RT en E. coli.[9] Estes descubrimentos suxiren que a reversotranscriptase xogou un papel na evolución dos virus a partir de bacterias, e unha das hipóteses sostén que, coa axuda da transcriptase inversa, puideron orixinarse os virus como unha escisión e separación dun xene de msDNA que adquiriu unha cuberta proteica. Como case todos os xenes de RT funcionan na replicación de retrovirus ou no movemento dos elementos transpoñibles, é razoable imaxinar que os retrons puideron ser elementos xenéticos móbiles, aínda que hai poucas evidencias que apoien esta hipótese, agás o feito observado de que o msDNA está amplamente aínda que esporadicamente espallado entre as especies bacterianas dunha maneira que fai pensar que houbo tanto transferencia horizontal de xenes coma vertical.[5][10][11] Como non se sabe se as secuencias retron representan per se elementos móbiles, os retrons son definidos funcionalmente pola súa capacidade de producir msDNA evitando deliberadamente especular con outras posibles actividades.
Función[editar | editar a fonte]
A función do msDNA segue sendo descoñecida pesar das moitas copias del que están presentes na célula. As mutacións knockout nas que non se expresa un msDNA son viables, polo que a produción de msDNA non é esencial para a vida en condicións de laboratorio. A sobreexpresión do msDNA é mutaxénica, aparentemente porque afecta ás proteínas de reparación debido aos pares de bases mal apareados que son típicos da súa estrutura.[10] Suxeriuse que o msDNA podería ter algún papel na patoxenidade ou a adaptación a condicións de estrés.[12] A comparación de secuencias entre os msDNAs de Myxococcus xanthus, Stigmatella aurantiaca,[1] e moitas outras bacterias[5][12] revela dominios hipervariables conservados que lembran as secuencias hipervariables conservadas atopadas en moléculas de alorrecoñecemento.[13] Os principais msDNAs de M. xanthus e S. aurantiaca, por exemplo, comparten un 94% de homoloxía de secuencias excepto dentro do dominio de 19 pares de bases, que comparte unha homoloxía de secuencias de só o 42%.[1] A presenza de tales dominios é significativa porque as mixobacterias mostran comportamentos sociais cooperativos complexos, como o exameamento e a formación de corpos frutíferos, mentres que E. coli e outras bacterias patóxenas forman biopelículas que mostran un aumento da resistencia a antibióticos e deterxentes. A sostibilidade das ensamblaxes sociais bacterianas para as que cómpre un investimento individual de enerxía depende xeralmente da evolución de mecanismos de alorrecoñecemento, que permiten que os grupos distingan o propio do alleo.[14]
Biosíntese[editar | editar a fonte]

A biosíntese do msDNA pénsase que segue unha única vía que non se encontra en ningún outro proceso da bioquímica do ADN/ARN. Debido á semellanza da unión da rama 2'-5' coas unións de rama encontradas en intermediarios do empalme de ARN, podería en principio esperarse que a formación da rama se fixese por medio do espliceosoma ou ligazón mediada por ribozima. Pero, sorprendentemente, os experimentos feitos en sistemas libres de células usando reversotranscriptase retron purificada indican que a síntee do ADNc está cebada directamente desde o grupo 2'-OH do residuo de G interno específico do cebador ou primer de ARN.[15] A reversotranscriptase (RT) recoñece estruturas en talo-bucle específicas no ARN precursor, facendo que a síntese do msDNA pola RT sexa moi específica do seu propio retron.[16] O cebado da síntese do msDNA supón un reto fascinante para os nosos coñecementos sobre a síntese do ADN. A ADN polimerases (que inclúe a RT) comparte características estruturais moi conservadas, o que significa que os seus sitios catalíticos varían pouco de especie a especie, ou incluso entre ADN polimerases que usan o ADN como molde e ADN polimerases que usan como molde o ARN. A rexión catlítica da reversotranscriptase eucariota comprende tres dominios denominados "dedos", "palma" e "polgar", que manteñen o molde cebador bicatenario nunha suxeición coa "man dereita" co grupo 3'-OH do cebador enterrado profundamente no sitio activo da polimerase,[17] unha agrupación de residuos polares e ácidos moi conservada situada na "palma" entre o que serían os "dedos" índice e medio. Nas RT eucariotas, o dominio de RNase H sitúase no "pulso da man" entre a base do "polgar", pero as RT retron carecen de actividade de RNase H. A fenda de unión do ácido nucleico, que se estende desde o sitio activo da polimerse ao sitio activo da RNase H, é duns 60 Å de lonxitude nas RT eucariotas, o que corresponde a case dous xiros de hélice.[18] Cando as RT eucariotas estenden un cebador convencional, a dobre hélice de ADN/ARN en crecemento espiralízase ao longo da fenda, e a medida que a dobre hélice pasa polo dominio RNase H, o ARN molde é dixerido para liberar a febra nacente de ADNc. Porén, no caso da extensión do cebador do msDNA, un ARN de febra longa permanece unido ao 3'-OH da G cebadora. Aínda que é posible modelar un complexo molde de cebador de RT que faría que o 2'-OH fose accesible para a reacción de cebado,[16] a posterior extensión da febra de ADN presenta un problema: a medida que progresa a síntese de ADN, a voluminosa febra de ARN que se estende desde o 3'-OH necesita algunha maneira de poder espiralizarse pola fenda de unión sen ser bloqueado polo impedimento estérico. Para superar este problema, a reversotranscriptase do msDNA necesitará claramente características especiais non compartidas por outras RT.[10]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 Dhundale A, Lampson B, Furuichi T, Inouye M, Inouye S (December 1987). "Structure of msDNA from Myxococcus xanthus: evidence for a long, self-annealing RNA precursor for the covalently linked, branched RNA". Cell 51 (6): 1105–12. PMID 2446773. doi:10.1016/0092-8674(87)90596-4.
- ↑ Inouye S, Herzer PJ, Inouye M (February 1990). "Two independent retrons with highly diverse reverse transcriptases in Myxococcus xanthus". Proc. Natl. Acad. Sci. U.S.A. 87 (3): 942–5. Bibcode:1990PNAS...87..942I. PMC 53385. PMID 1689062. doi:10.1073/pnas.87.3.942.
- ↑ Yee T, Furuichi T, Inouye S, Inouye M (August 1984). "Multicopy single-stranded DNA isolated from a gram-negative bacterium, Myxococcus xanthus". Cell 38 (1): 203–9. PMID 6088065. doi:10.1016/0092-8674(84)90541-5.
- ↑ Furuichi T, Inouye S, Inouye M (January 1987). "Biosynthesis and structure of stable branched RNA covalently linked to the 5′ end of multicopy single-stranded DNA of Stigmatella aurantiaca". Cell 48 (1): 55–62. PMID 2431795. doi:10.1016/0092-8674(87)90355-2.
- ↑ 5,0 5,1 5,2 Das R, Shimamoto T, Hosen S, Arifuzzaman M (2011). "Comparative Study of different msDNA (multicopy single-stranded DNA) structures and phylogenetic comparison of reverse transcriptases (RTs): evidence for vertical inheritance" (PDF). Bioinformation 7 (4): 176–9. PMC 3218519. PMID 22102774. doi:10.6026/97320630007176.
- ↑ Lampson BC, Sun J, Hsu MY, Vallejo-Ramirez J, Inouye S, Inouye M (February 1989). "Reverse transcriptase in a clinical strain of Escherichia coli: production of branched RNA-linked msDNA" (PDF). Science 243 (4894 Pt 1): 1033–8. Bibcode:1989Sci...243.1033L. PMID 2466332. doi:10.1126/science.2466332. Arquivado dende o orixinal (PDF) o 22 de decembro de 2014. Consultado o 18 de novembro de 2017.
- ↑ Lima TM, Lim D (1995). "Isolation and Characterization of Host Mutants Defective in msDNA Synthesis: Role of Ribonuclease H in msDNA Synthesis". Plasmid 33 (3): 235–8. PMID 7568472. doi:10.1006/plas.1995.1026.
- ↑ Hsu MY, Inouye M, Inouye S (December 1990). "Retron for the 67-base multicopy single-stranded DNA from Escherichia coli: a potential transposable element encoding both reverse transcriptase and Dam methylase functions". Proc. Natl. Acad. Sci. U.S.A. 87 (23): 9454–8. Bibcode:1990PNAS...87.9454H. PMC 55184. PMID 1701261. doi:10.1073/pnas.87.23.9454.
- ↑ Inouye S.; Inouye M. (1993). "Bacterial Reverse Transcriptase". En Goff, Stephen and Anna M. Skalka. Reverse transcriptase. Cold Spring Harbor monograph series 23. Plainview, N.Y: Cold Spring Harbor Laboratory Press. ISBN 0-87969-382-7.
- ↑ 10,0 10,1 10,2 10,3 Lampson BC, Inouye M, Inouye S (2005). "Retrons, msDNA, and the bacterial genome" (PDF). Cytogenet. Genome Res. 110 (1–4): 491–9. PMID 16093702. doi:10.1159/000084982. Arquivado dende o orixinal (PDF) o 05 de marzo de 2016. Consultado o 18 de novembro de 2017.
- ↑ Simon, Dawn M.; Zimmerly, Steven (2008). "A diversity of uncharacterized reverse transcriptases in bacteria". Nucleic Acids Research 36 (22): 7219–7229. doi:10.1093/nar/gkn867. Consultado o 31 May 2015.
- ↑ 12,0 12,1 Das R, Shimamoto T, Arifuzzaman M (2011). "A Novel msDNA (Multicopy Single-Stranded DNA) Strain Present in Yersinia frederiksenii ATCC 33641 Contig01029 Enteropathogenic Bacteria with the Genomic Analysis of Its Retron". Journal of Pathogens 2011 (693769): 1–6. doi:10.4061/2011/693769.
- ↑ Sherman LA, Chattopadhyay S (1993). "The Molecular Basis of Allorecognition". Annual Review of Immunology 11: 385–402. PMID 8476567. doi:10.1146/annurev.iy.11.040193.002125.
- ↑ Buss, Leo (2006). The Evolution of Individuality. Princeton University Press. ISBN 978-0-691-08469-5.
- ↑ Shimamoto T, Kawanishi H, Tsuchiya T, Inouye S, Inouye M (June 1998). "In Vitro Synthesis of Multicopy Single-Stranded DNA, Using Separate Primer and Template RNAs, by Escherichia coli Reverse Transcriptase". Journal of Bacteriology 180 (11): 2999–3002. PMC 107272. PMID 9603895.
- ↑ 16,0 16,1 Inouye S, Hsu MY, Xu A, Inouye M (1999). "Highly Specific Recognition of Primer RNA Structures for 2′-OH Priming Reaction by Bacterial Reverse Transcriptases". Journal of Biological Chemistry 274 (44): 31236–44. PMID 10531319. doi:10.1074/jbc.274.44.31236.
- ↑ Jacobo-Molina A, Ding J, Nanni RG, Clark Jr AD, Lu X, Tantillo C, Williams RL, Kamer G, Ferris AL, Clark P (1993). "Crystal structure of human immunodeficiency virus type 1 reverse transcriptase complexed with double-stranded DNA at 3.0 A resolution shows bent DNA" (PDF). Proc. Natl. Acad. Sci. USA 90 (13): 6320–4. Bibcode:1993PNAS...90.6320J. PMC 46920. PMID 7687065. doi:10.1073/pnas.90.13.6320. Arquivado dende o orixinal (PDF) o 24 de setembro de 2015. Consultado o 18 de novembro de 2017.
- ↑ Sarafianos SG, Das K, Tantillo C, Clark Jr AD, Ding J, Whitcomb JM, Boyer PL, Hughes SH, Arnold E (2001). "Crystal structure of HIV-1 reverse transcriptase in complex with a polypurine tract RNA:DNA". The EMBO Journal 20 (6): 1449–61. PMC 145536. PMID 11250910. doi:10.1093/emboj/20.6.1449.
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Lampson, Bert, Masayori Inouye, and Sumiko Inouye (2001). "The msDNAs of bacteria". Prog. Nuc. Acid Res. And Mol. Biol. Progress in Nucleic Acid Research and Molecular Biology 67: 65–91. ISBN 9780125400671. doi:10.1016/S0079-6603(01)67025-9.
- Zimmerly, Steven (2005). "Mobile introns and retroelements in bacteria". En Mullany, Peter. The Dynamic Bacterial Genome. Advances in Molecular and Cellular Microbiology 8. Cambridge University Press. ISBN 978-0-511-54154-4. Arquivado dende o orixinal o 05 de marzo de 2016. Consultado o 18 de novembro de 2017.
