Solución tampón
En química, unha solución tampón[1], sistema amortecedor[2] ou tampón químico (máis precisamente, tampón de pH ou do ión hidróxeno e na literatura inglesa buffer) é unha solución acuosa consistente nunha mestura dun ácido débil e a súa base conxugada ou dunha base débil e o seu ácido conxugado. O pH destas solucións cambia moi pouco cando se lle engaden pequenas cantidades dun ácdo forte ou dunha base forte. As solucións tampón utilízanse para manter o pH a un valor case constante nunha ampla variedade de aplicacións químicas e industriais. Na natureza, hai moitos sistemas que usan estes amortecedores para a regulación do pH. Por exemplo, o sistema tampón bicarbonato utilízase para regular o pH do sangue, mentres que no interior da célula o principal é o tampón fosfato.
Cada sistema amortecedor deste tipo ten o seu propio intervalo efectivo de amortecemento dos cambios de pH, o cal dependerá da constante de equilibrio do ácido ou base empregado. Sistemas tampón típicos son o par amoníaco-catión amonio, ácido acético-anión acetato, anión carbonato-anión bicarbonato, ácido cítrico-anión citrato ou algún dos pares na disociación do ácido fosfórico.
Principios do tamponamento
[editar | editar a fonte]

As solucións amortecedoras ou tampón resisten os cambios de pH debido a que nelas se produce un equilibrio entre o ácido HA e a súa base conxugada A−.
- HA ⇌ H+ + A−
Cando se engade algún ácido forte a unha mestura en equilibrio entre un ácido débil e a súa base conxugada, o equilibrio desprázase á esquerda, de acordo co principio de Le Châtelier. Debido a isto, a concentración de ión hidróxeno increméntanse menos da cantidade agardada tendo en conta a cantidade de ácido forte engadido. Similarmente, se se engade un álcali forte á mestura a concentración e ión hidróxeno diminúe menos da cantidade esperada tendo en conta a acantidade de álcali engadido. O efecto ilústrase pola tritración simulada dun ácido débil cun pKa = 4,7. A concentración relativa de ácido non disociado móstrase en azul e a da súa base conxugada en vermello. O pH cambia de forma relativamente lenta na rexión tampón, pH = pKa ± 1, centrada no pH = 4,7, onde [HA] = [A−]. A concentración de ión hidróxeno diminúe menos do que se esperaría porque a maioría do ión hidróxido engadido se consome na reacción
- OH− + HA → H2O + A−
e só un pouco se consome na reacción de neutralización que é a que tería como resultado un incremento de pH.
- OH− + H+ → H2O
Unha vez que o ácido está desprotonado en máis dun 95%, o pH elévase rapidamente porque a maioría do álcali engadido se consome na reacción de neutralización.
Capacidade de tamponamento
[editar | editar a fonte]A capacidade de tamponamento ou amortecemento do pH, β, é unha medida cuantitativa da resistencia dunha solución tampón ao cambio de pH coa adición de ións hidróxido. Pode definirse así:
onde dn é unha cantidade infinitesimal de base engadida e d(p[H+]) é o cambio infinitesimal resultante no cologaritmo da concentración de ión hidróxeno. Con esta definición a capacidade de tamponamento dun ácido débil, cunha constante de disociación de ácido Ka, pode expresarse como

onde CA é a concentración analítica do ácido.[3][4] O pH defínese como o −log10[H+]. Esta ecuación mostra que hai tres rexións de aumento da capacidade de tamponamento.
- A p[H+] moi baixo o termo [H+] do denominador predomina e a capacidade de tamponamento elévase exponencialmente coa diminución do pH.
- A capacidade de tamponamento dun axente de tamponamento chega a un máximo local cando p[H+] = pKa. Cae ao 33% do valor máximo a p[H+] = pKa ± 1 e ao 10% a p[H+] = pKa ± 1.5. Por esta razón o intervalo útil é aproximadamente pKa ± 1. A capacidade de tamponamento é proporcional á concentración do axente amortecedor, CA, polo que as solucións diluídas teñen pouca capacidade de tamponamento.
- A p[H+] moi altos o segundo termo do denominador é na práctica constante e a capacidade de tamponamento elévase exponencialmente cun incremento de pH debido ao termo [H+] do numerador; [H+]=10−pH.
As propiedades 1 e 3 son independentes da presenza ou ausencia de axentes tamponantes engadidos. Son efectos da concentración e reflicten que o pH está relacionado co logaritmo da concentración de ión hidróxeno.
Aplicacións
[editar | editar a fonte]As solucións tampón son necesarias para manter o pH correcto para o funcionamento dos encimas en moitos organismos. Moitos encimas funcionan só en condicións moi precisas; se o pH se move fóra dun estreito intervalo, o encima funciona máis lentamente ou deixa de funcionar e pode desnaturalizarse. En moitos casos a desnaturalización pode eliminar permanentemente a actividade catalítica.[5]
Industrialmente, as solucións tampón son utilizadas nos procesos de fermentación e para establecer as condicións correctas para as tinturas usadas para tinguir tecidos. Tamén se usan en análises químicas[4] e na calibración de pH metros.
A maioría das mostras biolóxicas que se usan en investigación entán feitas en tampóns, especialmente o tampón fosfato salino (PBS, do inglés phosphate buffered saline) a pH 7,4.
No organismo no plasma sanguíneo hai un tampón de ácido carbónico (H
2 CO
3) e bicarbonato (HCO−
3), que mantén o pH entre 7,35 e 7,45. Dentro das células funciona o tampón fosfato.
Axentes tampón simples
[editar | editar a fonte]Axente tamponador pKa Intervalo de pH útil Ácido cítrico 3,13, 4,76, 6,40 2,1–7,4 Ácido acético 4,8 3,8–5,8 KH2PO4 7,2 6,2–8,2 CHES 9,3 8,3–10,3 Borato 9,24 8,25–10,25
Para tampóns nas rexións ácidas, o pH pode ser axustado a un valor desexado engadindo un ácido forte como o ácido clorhídrico a un axente tamponador. Para os tampóns alcalinos, pode engadirse unha base forte como o hidróxido sódico. Alternativamente, unha mestura tampón ou amortecedora pode facerse mesturando un ácido e a súa base conxugada. Por exemplo, un tampón acetato pode facerse pola mestura de ácido acético e acetato de sodio. Similarmente, un tampón alcalino pode facerse a partir dunha mestura dunha base e o seu ácido conxugado.
Mesturas tampón "universais"
[editar | editar a fonte]Combinando substancias con valores de pKa que difiren en só dous ou menos e axustando o pH, pode obterse unha ampla variedade de tampóns. O ácido cítrico é un compoñente útil dunha mestura porque ten tres valores de pKa, separados por menos de dous. O rango de tampón pode ser ampliado engadindo outros axentes tamponadores. As seguintes mesturas (solucións tampón McIlvaine) teñen un rango de tamponamento do pH 3 ao 8.[6]
0,2 M Na2HPO4 (mL) 0,1 M ácido cítrico (mL) pH 20,55 79,45 3,0 38,55 61,45 4,0 51,50 48,50 5,0 63,15 36,85 6,0 82,35 17,65 7,0 97,25 2,75 8,0
Pode facerse unha mestura que conteña ácido cítrico, fosfato de monopotasio, ácido bórico e ácido dietil barbitúrico para cubrir o intervalo de pH do 2,6 ao 12.[7]
Outros tampóns universais son o tampón Carmody[8] e o tampón Britton-Robinson, desenvolvido en 1931.
Compostos tampón comúns usados en bioloxía
[editar | editar a fonte]Para os rangos efectivos ver capacidade de tamponamento, arriba.
| Nome común | Estrutura | pKa a 25 °C |
Efecto da temperatura dpH/dT (K−1)[9] |
Peso molecular |
|---|---|---|---|---|
| TAPS | 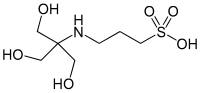 |
8,43 | −0,018 | 243,3 |
| Bicina |  |
8,35 | −0,018 | 163,2 |
| Tris |  |
8,06 | −0,028 | 121,14 |
| Tricina | 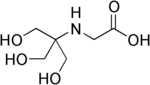 |
8,05 | −0,021 | 179,2 |
| TAPSO |  |
7,635 | 259,3 | |
| HEPES |  |
7,48 | −0,014 | 238,3 |
| TES | 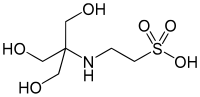 |
7,40 | −0,020 | 229,20 |
| MOPS |  |
7,20 | −0,015 | 209,3 |
| PIPES | 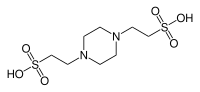 |
6,76 | −0,008 | 302,4 |
| Cacodilato | 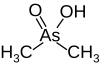 |
6,27 | 138,0 | |
| MES | 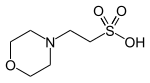 |
6,15 | −0,011 | 195,2 |
Cálculo do pH do tampón
[editar | editar a fonte]Ácidos monopróticos
[editar | editar a fonte]A expresión do equilibrio é
- HA ⇌ A− + H+
Isto mostra que cando o ácido se disocia prodúcense cantidades iguais de ión hidróxeno e do anión. As concentracións de equilibrio destes tres compoñentes poden calcularse nunha táboa ICE, siglas de "iniciais" (condicións), "cambio" e "equilibrio".
Táboa ICE para ácidos monopróticos [HA] [A−] [H+] I C0 0 y C −x x x E C0 − x x x + y
Na primeira fila, denominada I, indícanse as condicións iniciais: a concentración de ácido é C0, inicialmente non disociado, polo que a concentración de A− e H+ sería cero; y é a concentración inicial de ácido forte "engadido", como o ácido clorhídrico. Se se engade un álcali forte, como o hidróxido de sodio y terá un signo negativo porque o álcali retira ións hidróxeno da solución. A segunda fila, denominada C por cambio, especifica os cambios que ocorren cando o ácido se disocia. A concentración de ácido diminúe nunha cantidade de −x e as concentracións de A− e H+ increméntanse ambas nunha cantidade de +x. Isto derívase da expresión de equilibrio. A terceira fila, denominada E por concentracións de equilibrio, engádese conxuntamente as dúas primeiras filas e mostra as concentracións no equilibrio.
Para calcular x, úsase a fórmula para a constante de equilibrio en termos de concentracións:
Substitúense as concentracións cos valores atopados na última fila da táboa ICE:
Simplifícase a:
Con valores específicos para C0, Ka e y esta ecuación pode resolverse para x. Como o pH = −log10[H+], o pH pode calcularse como pH = −log10(x + y).
Ácidos polipróticos
[editar | editar a fonte]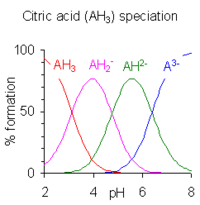
Os ácidos polipróticos son ácidos que poden peder máis dun protón. A constante de disociación do primeiro protón pode indicarse como Ka1 e as constantes de disociación dos sucesivos protóns como Ka2 etc. O ácido cítrico, H3A, é un exemplo de ácido poliprótico, xa que pode perder tres protóns.
Equilibrio valor do pKa H3A ⇌ H2A− + H+ pKa1 = 3,13 H2A− ⇌ HA2− + H+ pKa2 = 4,76 HA2− ⇌ A3− + H+ pKa3 = 6,40
Cando a diferenza entre sucesivos valores de pKa é menor de tres hai solapamento entre os rangos de pH de existencia das especies en equilibrio. Canto menor é a diferenza, maior é o solapamento. No caso do ácido cítrico, o solapamento é amplo e as solucións de ácido cítrico son tamponadas no seu rango completo do pH 2,5 ao 7,5.
O cálculo do pH cun ácido poliprótico require realizar uns cálculos de especiación. No caso do ácido cítrico, isto implica a solución das dúas ecuacións de equilibrio de masas seguintes
CA é a concentración analítica do ácido, CH é a concentración analítica dos ións hidróxeno engadidos, βq son as constantes de asociación acumulativas
Kw é a constante de autoionización da auga. Hai dúas ecuacións simultáneas non lineares en dúas cantidades descoñecidas [A3−] e [H+]. Disponse de moitos programas informáticos para facer este cálculo. O diagrama de especiación do ácido crítico obtívoe usando o programa HySS.[10]
Notas
[editar | editar a fonte]- ↑ BUSCatermos Solución tampón
- ↑ BUSCatermos sistema amortecedor. Diccionario galego de termos médicos. Santiago de Compostela, Xunta de Galicia, 2002
- ↑ Butler, J. N. (1964). Ionic Equilibrium: A Mathematical Approach. Addison-Wesley. p. 151.
- ↑ 4,0 4,1 Hulanicki, A. (1987). Reactions of acids and bases in analytical chemistry. Traducido por Masson, Mary R. Horwood. ISBN 0-85312-330-6.
- ↑ Scorpio, R. (2000). Fundamentals of Acids, Bases, Buffers & Their Application to Biochemical Systems. ISBN 0-7872-7374-0.
- ↑ McIlvaine, T. C. (1921). "A buffer solution for colorimetric comparaison" (PDF). J. Biol. Chem. 49 (1): 183–186.
- ↑ Mendham, J.; Denny, R. C.; Barnes, J. D.; Thomas, M. (2000). "Appendix 5". Vogel's textbook of quantitative chemical analysis (5th ed.). Harlow: Pearson Education. ISBN 0-582-22628-7.
- ↑ Carmody, Walter R. (1961). "Easily prepared wide range buffer series". J. Chem. Educ. 38 (11): 559–560. Bibcode:1961JChEd..38..559C. doi:10.1021/ed038p559.
- ↑ "Buffer Reference Center". Sigma-Aldrich. Consultado o 2009-04-17.
- ↑ Alderighi, L.; Gans, P.; Ienco, A.; Peters, D.; Sabatini, A.; Vacca, A. (1999). "Hyperquad simulation and speciation (HySS): a utility program for the investigation of equilibria involving soluble and partially soluble species". Coordination Chemistry Reviews 184 (1): 311–318. doi:10.1016/S0010-8545(98)00260-4.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- "Biological buffers". REACH Devices.
- Calculador on line do pH de tampóns
- Tampón fosfato Arquivado 23 de xaneiro de 2013 en Wayback Machine.

![{\displaystyle \beta ={\frac {dn}{d(\mathrm {p[H^{+}]} )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b6a0d9cf94cad0bf43f4458260f05388fab9a73)
![{\displaystyle {\frac {dn}{d(\mathrm {pH} )}}=2.303\left({\frac {C_{\mathrm {A} }K_{\mathrm {a} }[\mathrm {H^{+}} ]}{\left(K_{\mathrm {a} }+[\mathrm {H^{+}} ]\right)^{2}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/791d0525b0bccad3eed5bc0f7c3acff3d54c530c)
![{\displaystyle K_{\mathrm {a} }={\frac {[\mathrm {H^{+}} ][\mathrm {A^{-}} ]}{[\mathrm {HA} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4d45faa1d34eda090e28481c7a733292d0afface)


![{\displaystyle C_{\mathrm {A} }=[\mathrm {A^{3-}} ]+\beta _{1}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]+\beta _{2}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{2}+\beta _{3}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/453bf576ebd25ff5786b09befaeb5156931890c3)
![{\displaystyle C_{\mathrm {H} }=[\mathrm {H^{+}} ]+\beta _{1}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]+2\beta _{2}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{2}+3\beta _{3}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{3}-K_{\mathrm {w} }[\mathrm {H^{+}} ]^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/370946cab85c802fb49f8bc89440e432011bfbc9)
