Cadherina

As cadherinas[1] (nome que deriva de "adhesión dependente do calcio") son unha clase de proteínas transmembrana de tipo-1. Xogan un importante papel na adhesión celular, formando unións adherentes que unen as células entre si nos tecidos. Para funcionar son dependentes do ión calcio (Ca2+).
A superfamilia das cadherinas inclúe as cadherinas, protocadherinas, desmogleínas, e desmocolinas, e algunhas máis.[2][3] En canto á súa estrutura, todas comparten repeticións de cadherina, as cales son dominios de unión ao Ca2+ extracelular. Hai múltiples clases de moléculas de cadherina, cada unha designada cun prefixo (que, en xeral, designa un tipo de tecido ao cal están asociadas). Observouse que as células que conteñen un subtipo de cadherina específica tenden a agruparse xuntas excluíndo outros tipos, tanto en cultivos celulares coma durante o desenvolvemento embrionario.[4] Por exemplo, as células que conteñen N-cadherinas tenden a agruparse con outras células que tamén expresan N-cadherinas. Porén, detectouse que a velocidade de mestura nos experimentos en cultivos celulares pode ter un efecto na extensión da especificidade homotípica das cadherinas.[5] Ademais, varios grupos de investigación observaron unha afinidade polas unións heterotrópicas (entre tipos distintos de cadherina).[6][7] Un modelo actual propón que as células distinguen os subtipos de cadherina baseándose na súa especificidade cinética en vez de na súa especificidade termodinámica, xa que os diferentes tipos de enlaces homotípicos de cadherinas teñen diferentes duracións.[8]
Estrutura e función
[editar | editar a fonte]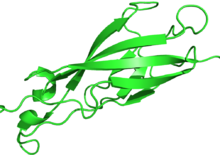
As cadherinas sintetízanse como polipéptidos e sofren moitas modificacións postraducionais para converterse nas proteínas que median a adhesión e recoñecemento de célula a célula.[10] Estes polipoéptidos teñen aproximadamente 720–750 aminoácidos. Cada cadherina ten un pequeno compoñente citoplasmático, un compoñente transmembrana, e a masa restante da proteína é extracelular. No ano 2000 xa se levaban identificado e secuenciado uns 80 tipos de cadherinas humanas.[11]
As cadherinas compórtanse como receptores e como ligandos. Durante o desenvolvemento embrionario, axudan a posicionar correctamente as células: son responsables da separación das diferentes capas de tecidos, e da migración celular.[12] Nos estadios iniciais do desenvolvemento, a E-cadherina (cadherina epitelial) é a que máis se expresa. Durante a seguinte fase do desenvolvemento, na que se forma a placa neural, exprésase a N-cadherina (cadherina neural) e hai unha diminución da E-cadherina. Finalmente, durante o desenvolvemento da notocorda e a condensación das somitas, increméntase a expresión das E- P- e N-cadherinas. Despois do desenvolvemento, as cadherinas xogan un papel no mantemento da estrutura da célula e dos tecidos, e no movemento celular.[11]
Tipos
[editar | editar a fonte]| Cadherin domain | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||||
| Símbolo | Cadherin | ||||||||||
| Pfam | PF00028 | ||||||||||
| InterPro | IPR002126 | ||||||||||
| SMART | CA | ||||||||||
| PROSITE | PDOC00205 | ||||||||||
| SCOPe | 1nci / SUPFAM | ||||||||||
| |||||||||||
As cadherinas poden clasificarse en catro grupos: clásicas, desmosómicas, protocadherinas, e non convencionais.[13]
Clásicas
[editar | editar a fonte]Diferentes membros da familia das cadherinas encóntranse en distintas localizacións.
- CDH1 - E-cadherina (epitelial): As E-cadherinas encóntranse no tecido epitelial.
- CDH2 - N-cadherina (neural): As N-cadherinas encóntranse nas neuronas.
- CDH12 - cadherina 12, tipo 2 (N-cadherina 2).
- CDH3 - P-cadherina (placentaria): As P-cadherinas encóntranse na placenta.
Desmosómicas
[editar | editar a fonte]- Desmogleína (DSG1, DSG2, DSG3, DSG4)
- Desmocolina (DSC1, DSC2, DSC3)
Protocadherinas
[editar | editar a fonte]PCDH15; PCDH17; PCDH18; PCDH19; PCDH20; PCDH7; PCDH8; PCDH9; PCDHA1; PCDHA10; PCDHA11; PCDHA12; PCDHA13; PCDHA2; PCDHA3; PCDHA4; PCDHA5; PCDHA6; PCDHA7; PCDHA8; PCDHA9; PCDHAC1; PCDHAC2; PCDHB1; PCDHB10; PCDHB11; PCDHB12; PCDHB13; PCDHB14; PCDHB15; PCDHB16; PCDHB17; PCDHB18; PCDHB2; PCDHB3; PCDHB4; PCDHB5; PCDHB6; PCDHB7; PCDHB8; PCDHB9; PCDHGA1; PCDHGA10; PCDHGA11; PCDHGA12; PCDHGA2; PCDHGA3; PCDHGA4; PCDHGA5; PCDHGA6; PCDHGA7; PCDHGA8; PCDHGA9; PCDHGB1; PCDHGB2; PCDHGB3; PCDHGB4; PCDHGB5; PCDHGB6; PCDHGB7; PCDHGC3; PCDHGC4; PCDHGC5
Non convencionais/non agrupadas
[editar | editar a fonte]- CDH9 - cadherina 9, tipo 2 (T1-cadherina)
- CDH10 - cadherina 10, tipo 2 (T2-cadherina)
- CDH4 - R-cadherina (retinal)
- CDH5 - VE-cadherina (vascular endotelial)
- CDH6 - K-cadherina (riles)
- CDH7 - cadherina 7, tipo 2
- CDH8 - cadherina 8, tipo 2
- CDH11 - OB-cadherina (osteoblasto)
- CDH13 - T-cadherina - H-cadherina (corazón, heart)
- CDH15 - M-cadherina (miotúbulo)
- CDH16 - KSP-cadherina
- CDH17 - LI cadherina (fígado-intestino, liver-intestine)
- CDH18 - cadherina 18, tipo 2
- CDH19 - cadherina 19, tipo 2
- CDH20 - cadherina 20, tipo 2
- CDH23 - cadherina 23, (epitelio neurosensorial)
- CDH10; CDH11; CDH13; CDH15; CDH16; CDH17;
CDH18; CDH19; CDH20; CDH22; CDH23; CDH24; CDH26; CDH28; CDH4; CDH5; CDH6; CDH7; CDH8; CDH9;
CELSR1; CELSR2; CELSR3; CLSTN1; CLSTN2; CLSTN3; DCHS1; DCHS2; LOC389118;
Notas
[editar | editar a fonte]- ↑ Coordinadores: Jaime Gómez Márquez, Ana Mª Viñas Díaz e Manuel González González. Redactores: David Villar Docampo e Luís Vale Ferreira. Revisores lingüísticos: Víctor Fresco e Mª Liliana Martínez Calvo. (2010). Dicionario de bioloxía galego-castelán-inglés. (PDF). Xunta de Galicia. p. 37. ISBN 978-84-453-4973-1.
- ↑ Hulpiau P, van Roy F (2009). "Molecular evolution of the cadherin superfamily". Int. J. Biochem. Cell Biol. 41 (2): 349–69. PMID 18848899. doi:10.1016/j.biocel.2008.09.027.
- ↑ Angst B, Marcozzi C, Magee A (2001). "The cadherin superfamily: diversity in form and function". J Cell Sci 114 (Pt 4): 629–41. PMID 11171368.
- ↑ Bello S.M., Millo H., Rajebhosale M., Price S.R. (2012) Catenin-dependent cadherin function drives divisional segregation of spinal chord motor neurons. J. Neuroscience 32(2):490-505
- ↑ Duguay, D.; A. Foty R., RA; S. Steinberg M., MS (2003). "Cadherin-mediated cell adhesion and tissue segregation: qualitative and quantitative determinants". Dev. Biol. 253 (2): 309–323. PMID 12645933. doi:10.1016/S0012-1606(02)00016-7.
- ↑ Niessen, Carien M.; Gumbiner, Barry M. (2002). "Cadherin-mediated cell sorting not determined by binding or adhesion specificity". The Journal of Cell Biology 156 (2): 389–399. PMC 2199232. PMID 11790800. doi:10.1083/jcb.200108040.
- ↑ Volk, T.; Cohen, O.; Geiger, B. (1987). "Formation of heterotypic adherens-type junctions between L-CAM containing liver cells and A-CAM containing lens cells". Cell 50 (6): 987–994. PMID 3621349. doi:10.1016/0092-8674(87)90525-3.
- ↑ Bayas, Marco V.; Leung, Andrew; Evans, Evan; Leckband, Deborah (2005). "Lifetime Measurements Reveal Kinetic Differences between Homophilic Cadherin Bonds". Biophysical Journal 90 (4): 1385–95. PMC 1367289. PMID 16326909. doi:10.1529/biophysj.105.069583.
- ↑ PDB 3Q2V; Harrison, O.J., Jin, X., Hong, S., Bahna, F., Ahlsen, G., Brasch, J., Wu, Y., Vendome, J., Felsovalyi, K., Hampton, C.M., Troyanovsky, R.B., Ben-Shaul, A., Frank, J., Troyanovsky, S.M., Shapiro, L., Honig, B. (2011). "The extracellular architecture of adherens junctions revealed by crystal structures of type I cadherins". Structure 19 (2): 244–56. PMC 3070544. PMID 21300292. doi:10.1016/j.str.2010.11.016.; reproducido con PyMOL
- ↑ Harris, Tony J.C., and Ulrich Tepass. "Adherins Junctions: From Molecules to Morphogenesis" Nature Reviews Molecular Cell Biology. 502-514. Xullo de 2010. doi:10.1038/nrm2927.
- ↑ 11,0 11,1 Tepass, Ulrich, et al. "Cadherins in Embryonic and Neural Morphogenisis" Nature Reviews Molecular Cell Biology. Novembro de 2000.
- ↑ Gumbiner, Barry M. "Regulation of Cadherin-Mediated Adhesion in Morphogenesis" Nature Reviews Molecular Cell Biology. 622-634. August 2005.
- ↑ Stefan Offermanns; Walter Rosenthal (2008). Encyclopedia of Molecular Pharmacology. Springer. pp. 306–. ISBN 978-3-540-38916-3. Consultado o 14 de decembro de 2010.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Beavon IR (2000). "The E-cadherin-catenin complex in tumour metastasis: structure, function and regulation". Eur. J. Cancer 36 (13 Spec No): 1607–20. PMID 10959047. doi:10.1016/S0959-8049(00)00158-1.
- Berx G, Becker KF, Höfler H, van Roy F (1998). "Mutations of the human E-cadherin (CDH1) gene". Hum. Mutat. 12 (4): 226–37. PMID 9744472. doi:10.1002/(SICI)1098-1004(1998)12:4<226::AID-HUMU2>3.0.CO;2-D.
- Bryant DM, Stow JL (2005). "The ins and outs of E-cadherin trafficking". Trends Cell Biol. 14 (8): 427–34. PMID 15308209. doi:10.1016/j.tcb.2004.07.007.
- Chun YS, Lindor NM, Smyrk TC; et al. (2001). "Germline E-cadherin gene mutations: is prophylactic total gastrectomy indicated?". Cancer 92 (1): 181–7. PMID 11443625. doi:10.1002/1097-0142(20010701)92:1<181::AID-CNCR1307>3.0.CO;2-J.
- Georgolios A, Batistatou A, Manolopoulos L, Charalabopoulos K (2006). "Role and expression patterns of E-cadherin in head and neck squamous cell carcinoma (HNSCC)". J. Exp. Clin. Cancer Res. 25 (1): 5–14. PMID 16761612.
- Hazan RB, Qiao R, Keren R; et al. (2004). "Cadherin switch in tumor progression". Ann. N. Y. Acad. Sci. 1014: 155–63. PMID 15153430. doi:10.1196/annals.1294.016.
- Moran CJ, Joyce M, McAnena OJ (2005). "CDH1 associated gastric cancer: a report of a family and review of the literature". Eur J Surg Oncol 31 (3): 259–64. PMID 15780560. doi:10.1016/j.ejso.2004.12.010.
- Reynolds AB, Carnahan RH (2005). "Regulation of cadherin stability and turnover by p120ctn: implications in disease and cancer". Semin. Cell Dev. Biol. 15 (6): 657–63. PMID 15561585. doi:10.1016/j.semcdb.2004.09.003.
- Wang HD, Ren J, Zhang L (2004). "CDH1 germline mutation in hereditary gastric carcinoma". World J. Gastroenterol. 10 (21): 3088–93. PMID 15457549.
- Wijnhoven BP, Dinjens WN, Pignatelli M (2000). "E-cadherin-catenin cell-cell adhesion complex and human cancer". The British journal of surgery 87 (8): 992–1005. PMID 10931041. doi:10.1046/j.1365-2168.2000.01513.x.
- Wilson PD (2001). "Polycystin: new aspects of structure, function, and regulation". J. Am. Soc. Nephrol. 12 (4): 834–45. PMID 11274246.
- Renaud-Young M, Gallin WJ (2002). "In the first extracellular domain of E-cadherin, heterophilic interactions, but not the conserved His-Ala-Val motif, are required for adhesion". Journal of Biological Chemistry 277 (42): 39609–39616. PMID 12154084. doi:10.1074/jbc.M201256200.
Ligazóns externas
[editar | editar a fonte]- Proteopedia - Cadherin - vista da estrutura da cadherina en 3D interactiv9
- Dominio de cadherina en PROSITE
- A familia da cadherina
- Alberts, Bruce. Molecular Biology of the Cell
- The Cadherin Resource Arquivado 25 de setembro de 2011 en Wayback Machine.
- InterPro - IPR002126 [1]
- Cadherin
- “Cadherin adhesome at a glance”. J Cell Sci 126, 373-378
