SARSr-CoV
- Este artigo trata dunha especie de coronavirus que comprende múltiples cepas. Para a cepa que causa a SARS, ver SARS-CoV. Para a cepa que causa a COVID-19, ver SARS-CoV-2.
| Coronavirus relacionado coa SARS[1] | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
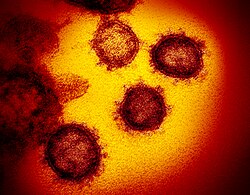 Micrografía electrónica de transmisión de virións de SARSr-CoV saíndo dunha célula hóspede cultivada en laboratorio. | |||||||||||||||
| Clasificación científica | |||||||||||||||
| |||||||||||||||
| Cepas | |||||||||||||||
|
SARS-CoV
| |||||||||||||||
O SARSr-CoV (do inglés Severe acute respiratory syndrome-related coronavirus ou coronavirus relacionado coa síndrome respiratoria aguda grave[nota 1] é unha especie de coronavirus que infecta os humanos, morcegos e algúns outros mamíferos.[2][3] É un virus con envoltura de ARN monocatenario de sentido positivo, que entra nas células hóspede uníndose ao receptor da superficie celular ACE2.[4] É un membro do xénero Betacoronavirus e do subxénero Sarbecoronavirus.[5][6]
Esta especie viral ten varias cepas. Dúas cepas deste virus causaron importantes gromos de enfermidades respiratorias graves en humanos: o SARS-CoV (ou SARS-CoV-1), que causou o gromo de 2002-2004 de síndrome respiratoria aguda grave (SARS), e o SARS-CoV-2, causante da pandemia por coronavirus de 2019–2021 da COVID-19.[7][8] Existen centos de cepas máis do SARSr-CoV, ningunha das cales infecta os humanos, senón outros mamíferos. Os morcegos son o seu principal reservorio, e varias cepas foron identificadas nas civetas Paradoxurus; ditas cepas probablemente son as antepasadas da cepa SARS-CoV.[7][9]
O coronavirus relacionado coa SARS foi un dos varios virus identificados pola Organización Mundial da Saúde (OMS) en 2016 como unha causa probable dunha epidemia futura nun novo plan desenvolvido despois da epidemia do virus Ébola para que se fixese unha investigación urxente e desenvolvementos sobre el antes e durante unha posible epidemia para conseguir tests de diagnóstico, vacinas e medicinas. A predición fíxose realidade co desencadeamento da pandemia por coronavirus de 2019–2021, que estendeu a COVID-19 por todo o mundo.[10][11]
Clasificación[editar | editar a fonte]
O coronavirus relaconado coa SARS é membro do xénero Betacoronavirus (grupo 2) e do subxénero Sarbecovirus (subgrupo B).[12] Os sarbecovirus, a diferenza dos embecovirus ou alfacoronavirus, só teñen unha proteinase de tipo papaína (PLpro) en vez de dúas no marco de lectura aberto ORF1.[13] Determinouse que o SARSr-CoV era unha ramificación temperá dos betacoronavirus baseándose nun conxunto conservado de dominios que comparte con este grupo.[14][15]
Os morcegos son o principal hóspede reservorio dos coronavirus relacionados coa SARS. O virus coevolucionou nos morcegos reservorios durante un longo período de tempo.[16] Non foi ata tempos recentes que evolcionaron as cepas de coronavirus relacionados coa SARS e fixeron o salto entre especies desde os morcegos aos humanos, como no caso das cepas SARS-CoV e SARS-CoV-2.[4][17] Ambas as cepas descenderon dun único antepasado, pero fixeron o paso entre especies ata os humanos separadamente. O SARS-CoV-2 non é un descendente directo do SARS-CoV.[7] O 17 de marzo de 2020, os científicos informaron que o novo virus SARS-CoV-2 se orixinou de forma natural, e non doutro modo.[18][19]
Xenoma[editar | editar a fonte]

O coronavirus relacionado coa SARS é un virus con envoltura de ARN monocatenario de sentido positivo. O seu xenoma é dunhas 30 kb, que é un dos maiores entre os virus de ARN. O virus ten 14 marcos de lectura abertos que se solapan nalgúns casos.[20] O xenoma ten unha caparuza 5′ metilada e unha cola 3′ poliadenilada.[21] Hai 265 nucleótidos na rexión non traducida 5' (5'UTR) e 342 nucleótidos na rexión non traducida 3' (3'UTR).[20]
A caparuza 5' metilada e a cola 3' poliadenilada permiten que o xenoma de ARN de sentido positivo sexa traducido directamente polos ribosomas da célula hóspede na entrada viral.[22] O SARSr-CoV é similar a outros coronavirus en canto ao comezo da expresión do seu xenoma, que se inicia coa tradución polos ribosomas da célula hóspede dos seus dous grandes marcos de lectura abertos iniciais (ORFs), 1a e 1b, que producen ambos poliproteínas.[20]
| Función das proteínas xenómicas (de orf1a a orf9b) do SARS-CoV | |
|---|---|
| Proteína | Función[23][24][25] |
| orf1a, orf1b |
Poliproteína replicase/transcriptase (pp1ab) (proteínas non estruturais) |
| orf2 | Proteína da espícula (S), adhesión e entrada do virus (proteína estrutural) |
| orf3a | Interacciona coas proteína estruturais S, E, M; Actividade de canle iónica; Regula á alza as citocinas e quimiocinas como a IL-8 e RANTES; Regula á alza o NF-κB e JNK; Induce a apoptose e parada do ciclo celular por medio das caspases 8 e 9, e por Bax, p53 e quinase MAP p38 |
| orf3b | Regula á alza citocinas e quimiocinas por medio de RUNX1b; Inhibe a produción de IFN de tipo I e sinalizando; Induce a apoptose e a parada do ciclo celular; |
| orf4 | Proteína da envoltura (E), ensamblaxe do virus e evaxinación (proteína estrutural) |
| orf5 | Proteína de membrana (M), ensamblaxe do virus e evaxinación (proteína estrutural) |
| orf6 | Potencia a síntese de ADN celular; Inhibesa produción e sinalización de IFN de tipo I |
| orf7a | Inhibe a síntese de proteínas celulares; Induce a resposta inflamatoria por NF-κB e promotor do IL-8; Regula á alza quimiocinas como o IL-8 e RANTES; Regula á alza a JNK e a quinase MAP p38; Induce a apoptose e a parada do ciclo celular |
| orf7b | Descoñecido |
| orf8a | Induce a apoptose pola vía mitocondrial |
| orf8b | Potencia a síntese de ADN celular |
| orf9a | Proteína da nucleocápside (N), empaquetamento do ARN viral (proteína estrutural) |
| orf9b | Induce a apoptose |
Coñécense as funcións de varias proteínas virais.[26] Os ORFs 1a e 1b codifican a poliproteína replicase/transcriptase, e os posteriores ORFs 2, 4, 5 e 9a codifican, respectivamente, as catro proteínas estruturais principais: espícula, envoltura, membrana e nucleocápside.[27] Os ORFs posteriores tamén codifican oito proteínas únicas (de orf3a a orf9b), coñecidas como proteínas accesorias, moitas sen ningún homólogo coñecido. As diferentes funcións das proteínas accesorias non se coñecen.[26]
Morfoloxía[editar | editar a fonte]

A morfoloxía do coronavirus relacionado coa SARS é a característica da familia dos coronavirus. Estes virus son grandes partículas esféricas pleomórficas con proxeccións superficiais bulbosas que forman unha especie de coroa arredor das partículas víricas nas micrografías electrónicas.[28] O tamaño das partículas víricas está entre 80–90 nm. A envoltura do virus en micrografías electrónicas aparece como un definido par de cubertas densas aos electróns.[29]
A envoltura viral consta dunha bicapa lipídica na que están ancoradas as proteínas da membrana (M), envoltura (E) e espícula (S).[30] As proteínas da espicula orixinan as proxeccións bulbosas da superficie do virus. A interacción das proteínas da espícula co seu receptor da célula hóspede correspondente é fundamental para determinar o tropismo de tecido, a infectividade e o rango de especies ás que infecta o virus.[31][32]
Dentro da envoltura hai unha nucleocápside, que está formada por múltiples copias da proteína da nucleocápside (N), que están unidas ao ARN xenómico monocatanario de sentido positivo (~30 kb) nunha formación continua de tipo rosario de doas.[33][34] A envoltura de bicapa lipídica, as proteínas de membrana e a nucleocápside protexen o virus cando está fóra do hópede.[35]
Ciclo vital[editar | editar a fonte]
O coronavirus relacionado coa SARS segue a estratexia de replicación típica dos coronavirus,[21][36][37][38][39] que se pode dividir nas seguintes fases:
Adhesión e entrada na célula[editar | editar a fonte]

A unión do coronavirus relacionado coa SARS coa célula hóspede faise coa mediación da proteína da espícula e o seu receptor da superficie celular.[40] O dominio de unión ao receptor da proteína da espícula (RBD) recoñece e únese ao receptor, que é o enzima convertedor da anxiotensina 2 (ACE2).[4] Despois da adhesión, o virus pode entrar na célula hóspede por dúas vías diferentes. A vía que o virus tome depende da dispoñibilidade dunha protease do hóspede, que é a que corta e activa a proteína da espícula unida ao receptor.[41]
A primeira vía que pode usar o coronavirus da SARS para entrar na célula hóspede é por endocitose, na que o virus é captado nun endosoma. A proteína da espícula unida ao receptor é despois activada pola cisteina protease catepsina L dependente de pH do hóspede. A activación da proteína da espícula unida ao receptor causa un cambio conformacional e a subseguinte fusión da envoltura viral coa membrana do endosoma.[41]
Alternativamente, o virus pode entrar na célula hóspede directamente por clivaxe proteolítica da proteína da espícula unida ao receptor polas serina proteasess TMPRSS2 ou TMPRSS11D do hóspede na superficie celular.[42][43] No coronavirus da SARS, a activación da parte C-terminal da proteína da espícula desencadea a fusión da envoltura viral coa membrana da célula hóspede ao inducir cambios conformacionais que non se comprenden totalmente.[44]
Tradución do xenoma[editar | editar a fonte]
| Función das proteínas non estruturais dos coronavirus (nsps)[45] | |
|---|---|
| Proteína | Función |
| nsp1 | Promove a degradación do ARNm do hóspede, bloquea a tradución do hóspede; bloquea a resposta inmunitaria innata |
| nsp2 | Únese ás proteínas prohibitinas; función descoñecida |
| nsp3 | Proteína transmembrana multidominio; interacciona coa proteína N; promove a expresión de citocinas; o dominio PLPro cliva a poliproteína pp1ab e bloque a resposta inmunitaria innata do hóspede; funcións descoñecidas doutos dominios |
| nsp4 | Proteína armazón transmembrana; permite adquirir a estrutura axeitada ás vesículas de dobre membrana (DMVs) |
| nsp5 | A 3CLPro cliva a poliproteína pp1ab |
| nsp6 | Proteína armazón transmembrana; función descoñecida |
| nsp7 | Forma complexos hexadecaméricos con nsp8; abrazadeira de procesividade para a RdRp (nsp12) |
| nsp8 | Forma un complexo hexadecamérico co nsp7; abrazadeira de procesividade para RdRp (nsp12); actúa como unha primase |
| nsp9 | Proteína de unión ao ARN (RBP) |
| nsp10 | Cofactores nsp16 e nsp14; forma un heterodímero con ambos; estimula a 2-O-MT (nsp16) e a actividade de ExoN (nsp14) |
| nsp11 | Función descoñecida |
| nsp12 | ARN polimerase ARN dependente (RdRp) |
| nsp13 | ARN helicase, 5′ trifosfatase |
| nsp14 | N7 Metltransferase, 3′-5′ exorribonuclease (ExoN); a N7 MTase engade a caparuza 5', ExoN fai a corrección de probas do xenoma |
| nsp15 | Endorribonuclease (NendoU) |
| nsp16 | 2′-O-Metiltransferase (2-O-MT); protexe o ARN viral de MDA5 |
Despois da fusión a nucleocápside pasa ao citoplasma, onde se libera o xenoma viral.[40] O xenoma actúa como un ARN mensaxeiro e os ribosomas da célula traducen dous terzos do xenoma, que se corresponden cos marcos de lectura abertos ORF1a e ORF1b, orixinando dúas grandes poliproteínas, chamadas pp1a e pp1ab.
A poliproteína máis grande pp1ab é o resultado dun cambio da pauta de lectura ribosómica -1 causado pola secuencia escorregante (UUUAAAC) e un pseudonó de ARN de augas abaixo no final do marco de lectura abero ORF1a.[46] O cambio de pauta de lectura ribosómica permite a tradución continua de ORF1a seguida da de ORF1b.[47]
As poliproteínas conteñen as súas propias proteases, PLpro e 3CLpro, que clivan as proteínas en sitios específicos diferentes. A clivaxe da poliproteína pp1ab orixina 16 proteínas non estruturais (de nsp1 a nsp16). As proteínas produto inclúen varias proteínas de replicación como unha ARN polimerase ARN dependente (RdRp), unha ARN helicase e unha exorribonuclease (ExoN).[38][47]
Replicación e transcrición[editar | editar a fonte]

Varias proteínas non estruturais coalescen para formar un complexo multiproteico replicase-transcriptase (RTC).[47] A principal proteína replicase-transcriptase é a ARN polimerase ARN dependente (RdRp). Está directamente implicada na replicación e transcrición do ARN a partir dunha febra molde de ARN. As outras proteínas non estruturais do complexo axudan no proceso de replicación e transcrición.[45]
A proteína nsp15 é unha 3'-5' exorribonuclease que proporciona fidelidade extra ao proceso de replicación. A exorribonuclease proporciona unha función de corrección de probas ao complexo, do cal carece a ARN polimerase ARN dependente. De xeito similar, as proteínas nsp7 e nsp8 forman unha abrazadeira deslizante hexadecamérica que forma parte do complexo, que incrementa grandemente a procesividade da ARN polimerase ARN dependente.[45] Os coronavirus necesitan o incremento da fidelidade e da procesividade durante a síntese de ARN debido ao seu tamaño de xenoma relativamente grande en comparación con outros virus de ARN.[48]
Unha das principais funcións do complexo replicase-transcriptase é transcribir/replicar o xenoma viral. A RdRp é mediadora directa da síntese de moléculas de ARN subxenómicas de sentido negativo a partir do ARN xenómico positivo. Isto vai seguido da transcrición destas moléculas de ARN subxenómico de sentido negativo aos seus correspondentes ARNm de sentido positivo.[49]
O ARN xenómico de sentido positivo replicado convértee no xenoma da proxenie de virus. Os diversos ARNm máis pequenos son transcritos a partir do último terzo do xenoma do virus, que está a continución dos marcos de lectura ORF1a e ORF1b. Estes ARNm son traducidos ás catro proteínas estruturais (S, E, M e N) que formarán parte das partículas de virus da proxenie e tamén outras oito proteínas accesorias (de orf3 a orf9b) que axudan o virus.[50]
Ensamblaxe e liberación[editar | editar a fonte]
A tradución do ARN ocorre denrro do retículo endoplasmático. As proteínas estruturais virais S, E e M móvense pola vía secretora no compartimento intermediario de Golgi. Alí, as proteínas M dirixen a maioría das interaccións proteína-proteína requirida para a ensamblaxe dos virus despois da súa unión á nucleocápside.[51]
Os virus da proxenie son liberados do hóspede por exocitose por medio de vesículas secretoras.[51]
Notas e referencias[editar | editar a fonte]
- Notas
- ↑ Os termos SARSr-CoV e SARS-CoV téñense ás veces usado indistintamente, especialmente antes do descubrimento do SARS-CoV-2.
- Referencias
- ↑ "ICTV Taxonomy history: Severe acute respiratory syndrome-related coronavirus" (html). International Committee on Taxonomy of Viruses (ICTV) (en inglés). Consultado o 27 January 2019.
- ↑ Branswell H (9 November 2015). "SARS-like virus in bats shows potential to infect humans, study finds". Stat News. Consultado o 20 February 2020.
- ↑ Wong AC, Li X, Lau SK, Woo PC (February 2019). "Global Epidemiology of Bat Coronaviruses". Viruses 11 (2): 174. PMC 6409556. PMID 30791586. doi:10.3390/v11020174.
É importante que os morcegos de ferradura son os reservorios dos CoVs de tipo SARS, mentres que as civetas das palmas [Paradoxurus] son consideradas hóspedes intermediarios dos SARS-CoVs.
- ↑ 4,0 4,1 4,2 Ge XY, Li JL, Yang XL, Chmura AA, Zhu G, Epstein JH, et al. (November 2013). "Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor". Nature 503 (7477): 535–8. Bibcode:2013Natur.503..535G. PMC 5389864. PMID 24172901. doi:10.1038/nature12711.
- ↑ "Virus Taxonomy: 2018 Release". International Committee on Taxonomy of Viruses (ICTV) (en inglés). October 2018. Consultado o 13 January 2019.
- ↑ Woo PC, Huang Y, Lau SK, Yuen KY (August 2010). "Coronavirus genomics and bioinformatics analysis". Viruses 2 (8): 1804–20. PMC 3185738. PMID 21994708. doi:10.3390/v2081803.
Figura 2. Análise filoxenética das ARN polimerases ARN dependentes (Pol) dos coronavirus coas secuencias completas dispoñibles. A árbore foi construída polo método de unión de veciños e enraizado usando a poliproteína do virus Breda.
- ↑ 7,0 7,1 7,2 Coronaviridae Study Group of the International Committee on Taxonomy of Viruses (March 2020). "The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2". Nature Microbiology 5 (4): 536–544. PMID 32123347. doi:10.1038/s41564-020-0695-z.
- ↑ Kohen, Jon; Kupferschmidth, Kai (28 February 2020). "Strategies shift as coronavirus pandemic looms". Science 367 (6481): 962–963. Bibcode:2020Sci...367..962C. PMID 32108093. doi:10.1126/science.367.6481.962.
- ↑ Lau SK, Li KS, Huang Y, Shek CT, Tse H, Wang M, et al. (March 2010). "Ecoepidemiology and complete genome comparison of different strains of severe acute respiratory syndrome-related Rhinolophus bat coronavirus in China reveal bats as a reservoir for acute, self-limiting infection that allows recombination events". Journal of Virology 84 (6): 2808–19. PMC 2826035. PMID 20071579. doi:10.1128/JVI.02219-09.
- ↑ Kieny M. "After Ebola, a Blueprint Emerges to Jump-Start R&D". Scientific American Blog Network. Arquivado dende o orixinal o 20 December 2016. Consultado o 13 December 2016.
- ↑ "LIST OF PATHOGENS". World Health Organization. Arquivado dende o orixinal o 20 de decembro de 2016. Consultado o 13 December 2016.
- ↑ Wong AC, Li X, Lau SK, Woo PC (February 2019). "Global Epidemiology of Bat Coronaviruses". Viruses 11 (2): 174. PMC 6409556. PMID 30791586. doi:10.3390/v11020174.
See Figure 1.
- ↑ Woo PC, Huang Y, Lau SK, Yuen KY (August 2010). "Coronavirus genomics and bioinformatics analysis". Viruses 2 (8): 1804–20. PMC 3185738. PMID 21994708. doi:10.3390/v2081803.
Ver Figura 1.
- ↑ Woo PC, Huang Y, Lau SK, Yuen KY (August 2010). "Coronavirus genomics and bioinformatics analysis". Viruses 2 (8): 1804–20. PMC 3185738. PMID 21994708. doi:10.3390/v2081803.
Ademais, coa análise filoxenética subseguinte feita utilizando unha secuencia xenómica completa e estratexias proteómicas, chegouse á conclusión de que o SARSr-CoV é probablemente unha ramificación temperá da liñaxd dos Betacoronavirus; Ver Figura 2.
- ↑ "Coronaviridae - Figures - Positive Sense RNA Viruses - Positive Sense RNA Viruses (2011)". International Committee on Taxonomy of Viruses (ICTV) (en inglés). Arquivado dende o orixinal o 16 de xaneiro de 2020. Consultado o 2020-03-06.
See Figure 2.
- ↑ Gouilh MA, Puechmaille SJ, Gonzalez JP, Teeling E, Kittayapong P, Manuguerra JC (October 2011). "SARS-Coronavirus ancestor's foot-prints in South-East Asian bat colonies and the refuge theory". Infection, Genetics and Evolution 11 (7): 1690–702. PMID 21763784. doi:10.1016/j.meegid.2011.06.021.
Os antepasados dos betacoronavirus-b, o que significa os antepasados dos SARSr-CoVs, puideron estar historicamante hospedados polo antepasado común dos Rhinolophidae e Hipposideridae e puideron ter evolucionado independentemente nas liñaxes que conducen cara aos betacoronavirus de Rhinolophidae e Hipposideridae.
- ↑ Cui J, Han N, Streicker D, Li G, Tang X, Shi Z, et al. (October 2007). "Evolutionary relationships between bat coronaviruses and their hosts". Emerging Infectious Diseases 13 (10): 1526–32. PMC 2851503. PMID 18258002. doi:10.3201/eid1310.070448.
- ↑ Scripps Research Institute (17 March 2020). "The COVID-19 coronavirus epidemic has a natural origin, scientists say - Scripps Research's analysis of public genome sequence data from SARS-CoV-2 and related viruses found no evidence that the virus was made in a laboratory or otherwise engineered". EurekAlert!. Consultado o 18 March 2020.
- ↑ Andersen, Kristian G.; et al. (17 March 2020). "The proximal origin of SARS-CoV-2". Nature Medicine: 1–3. doi:10.1038/s41591-020-0820-9. Consultado o 18 March 2020.
- ↑ 20,0 20,1 20,2 Snijder EJ, Bredenbeek PJ, Dobbe JC, Thiel V, Ziebuhr J, Poon LL, et al. (August 2003). "Unique and conserved features of genome and proteome of SARS-coronavirus, an early split-off from the coronavirus group 2 lineage". Journal of Molecular Biology 331 (5): 991–1004. PMID 12927536. doi:10.1016/S0022-2836(03)00865-9.
O xenoma do SARS-CoV é de ∼29.7 kb de longo e contén 14 marcos de lectura abertos (ORFs) flanqueados por rexións non traducidas 5′ e 3′ de 265 e 342 nucleótidos, respectivamente (Figura 1).
- ↑ 21,0 21,1 Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". En Maier HJ, Bickerton E, Britton P. Coronaviruses. Methods in Molecular Biology 1282. Springer. pp. 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
- ↑ Fehr AR, Perlman S (2015). Maier HJ, Bickerton E, Britton P, eds. "An Overview of Their Replication and Pathogenesis; Section 2 Genomic Organization". Methods in Molecular Biology (Springer) 1282: 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
- ↑ McBride R, Fielding BC (November 2012). "The role of severe acute respiratory syndrome (SARS)-coronavirus accessory proteins in virus pathogenesis". Viruses 4 (11): 2902–23. PMC 3509677. PMID 23202509. doi:10.3390/v4112902.
See Table 1.
- ↑ Tang X, Li G, Vasilakis N, Zhang Y, Shi Z, Zhong Y, Wang LF, Zhang S (March 2009). "Differential stepwise evolution of SARS coronavirus functional proteins in different host species". BMC Evolutionary Biology 9: 52. PMC 2676248. PMID 19261195. doi:10.1186/1471-2148-9-52.
- ↑ Narayanan, Krishna; Huang, Cheng; Makino, Shinji (April 2008). "SARS coronavirus Accessory Proteins". Virus Research 133 (1): 113–121. ISSN 0168-1702. PMC 2720074. PMID 18045721. doi:10.1016/j.virusres.2007.10.009.
See Table 1.
- ↑ 26,0 26,1 McBride R, Fielding BC (November 2012). "The role of severe acute respiratory syndrome (SARS)-coronavirus accessory proteins in virus pathogenesis". Viruses 4 (11): 2902–23. PMC 3509677. PMID 23202509. doi:10.3390/v4112902.
- ↑ Snijder EJ, Bredenbeek PJ, Dobbe JC, Thiel V, Ziebuhr J, Poon LL, et al. (August 2003). "Unique and conserved features of genome and proteome of SARS-coronavirus, an early split-off from the coronavirus group 2 lineage". Journal of Molecular Biology 331 (5): 991–1004. PMID 12927536. doi:10.1016/S0022-2836(03)00865-9.
See Figure 1.
- ↑ Goldsmith CS, Tatti KM, Ksiazek TG, Rollin PE, Comer JA, Lee WW, et al. (February 2004). "Ultrastructural characterization of SARS coronavirus". Emerging Infectious Diseases 10 (2): 320–6. PMC 3322934. PMID 15030705. doi:10.3201/eid1002.030913.
Os virións adquiriron unha envoltura ao evaxinarse nas cisternas e formaron partículas principalmente esféricas, ás veces pleomórficas que como media son de 78 nm de diámetro (Figura 1A).
- ↑ Neuman BW, Adair BD, Yoshioka C, Quispe JD, Orca G, Kuhn P, et al. (August 2006). "Supramolecular architecture of severe acute respiratory syndrome coronavirus revealed by electron cryomicroscopy". Journal of Virology 80 (16): 7918–28. PMC 1563832. PMID 16873249. doi:10.1128/JVI.00645-06.
Os diámetros das partículas van de 50 a 150 nm, excluíndo as espículas, con diámetros medios das partículas de 82 a 94 nm; Ver tamén a Figura 1 para a dobre cuberta.
- ↑ Lai MM, Cavanagh D (1997). "The molecular biology of coronaviruses". Advances in Virus Research 48: 1–100. ISBN 9780120398485. PMID 9233431. doi:10.1016/S0065-3527(08)60286-9.
- ↑ Masters PS (2006-01-01). The molecular biology of coronaviruses. Advances in Virus Research 66. Academic Press. pp. 193–292. ISBN 9780120398690. PMID 16877062. doi:10.1016/S0065-3527(06)66005-3.
Non obstante, a interacción entre a proteína S e o receptor segue sendo o principal, se non o único, determinante do rango de especies hóspedes do coronavirus e tropismo de tecidos.
- ↑ Cui J, Li F, Shi ZL (March 2019). "Origin and evolution of pathogenic coronaviruses". Nature Reviews. Microbiology 17 (3): 181–192. PMC 7097006. PMID 30531947. doi:10.1038/s41579-018-0118-9.
Diferentes cepas do SARS-CoV illadas de varios hóspedes varían nas súas afinidades de unión ao ACE2 humano e en consecuencia na súa infectividade das células humanas (Fig. 6b)
- ↑ Fehr AR, Perlman S (2015). Maier HJ, Bickerton E, Britton P, eds. "An Overview of Their Replication and Pathogenesis; Section 2 Genomic Organization". Methods in Molecular Biology (Springer) 1282: 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
See section: Virion Structure.
- ↑ Chang CK, Hou MH, Chang CF, Hsiao CD, Huang TH (March 2014). "The SARS coronavirus nucleocapsid protein--forms and functions". Antiviral Research 103: 39–50. PMID 24418573. doi:10.1016/j.antiviral.2013.12.009.
Ver Figura 4c.
- ↑ Neuman BW, Kiss G, Kunding AH, Bhella D, Baksh MF, Connelly S, et al. (April 2011). "A structural analysis of M protein in coronavirus assembly and morphology". Journal of Structural Biology 174 (1): 11–22. PMC 4486061. PMID 21130884. doi:10.1016/j.jsb.2010.11.021.
Ver Figura 10.
- ↑ Tok TT, Tatar G. "Structures and Functions of Coronavirus Proteins: Molecular Modeling of Viral Nucleoprotein." (PDF). Arquivado dende o orixinal (PDF) o 18 de febreiro de 2020. Consultado o 04 de abril de 2020.
- ↑ Lal SK, ed. (2010). Molecular Biology of the SARS-Coronavirus. ISBN 978-3-642-03682-8. doi:10.1007/978-3-642-03683-5.
- ↑ 38,0 38,1 Cui H, Gao Z, Liu M, Lu S, Mkandawire W, Mo S, Narykov O, Srinivasan S, Korkin D (January 2020). "Structural genomics and interactomics of 2019 Wuhan novel coronavirus, 2019-nCoV, indicate evolutionary conserved functional regions of viral proteins.". bioRxiv. doi:10.1101/2020.02.10.942136.
- ↑ Wu F, Zhao S, Yu B, Chen YM, Wang W, Hu Y, et al. (January 2020). "Complete genome characterisation of a novel coronavirus associated with severe human respiratory disease in Wuhan, China.". bioRxiv. doi:10.1101/2020.01.24.919183.
- ↑ 40,0 40,1 Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". En Maier HJ, Bickerton E, Britton P. Coronaviruses. Methods in Molecular Biology 1282. Springer. pp. 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
Ver acción: Ciclo vital do coronavirus – Adhesión e entrada
- ↑ 41,0 41,1 Simmons G, Zmora P, Gierer S, Heurich A, Pöhlmann S (December 2013). "Proteolytic activation of the SARS-coronavirus spike protein: cutting enzymes at the cutting edge of antiviral research". Antiviral Research 100 (3): 605–14. PMC 3889862. PMID 24121034. doi:10.1016/j.antiviral.2013.09.028.
Ver Figura 2.
- ↑ Heurich A, Hofmann-Winkler H, Gierer S, Liepold T, Jahn O, Pöhlmann S (January 2014). "TMPRSS2 and ADAM17 cleave ACE2 differentially and only proteolysis by TMPRSS2 augments entry driven by the severe acute respiratory syndrome coronavirus spike protein". Journal of Virology 88 (2): 1293–307. PMC 3911672. PMID 24227843. doi:10.1128/JVI.02202-13.
O SARS-CoV pode secuestrar dous sistemas proteolíticos celulares para asegurarse dun axeitado procesamento da súa proteína S. A clivaxe de SARS-S pode ser facilitado pola catepsina L, unha protease dependente de pH endo-/lisosómica da célula hóspede, despois da captación de virións nos endosomas celulares diana. Alternativamente, as serina proteases transmembrana de tipo II (TTSPs) TMPRSS2 e HAT poden activar SARS-S, presumiblemente por clivaxe da SARS-S en ou preto da superficie celular, e a activación da SARS-S por TMPRSS2 permite unha entrada na célula independente da catepsina L.
- ↑ Zumla A, Chan JF, Azhar EI, Hui DS, Yuen KY (May 2016). "Coronaviruses - drug discovery and therapeutic options". Nature Reviews. Drug Discovery 15 (5): 327–47. PMC 7097181. PMID 26868298. doi:10.1038/nrd.2015.37.
S é inactivada e clivada dando as subunidades S1 e S2 por outras proteases, como as proteases transmembrana serina 2 (TMPRSS2) e TMPRSS11D, que permiten unha entrada do virus non endosómica pola superficie celular na membrana plasmática.
- ↑ Li Z, Tomlinson AC, Wong AH, Zhou D, Desforges M, Talbot PJ, et al. (October 2019). "The human coronavirus HCoV-229E S-protein structure and receptor binding". eLife 8. PMC 6970540. PMID 31650956. doi:10.7554/eLife.51230.
- ↑ 45,0 45,1 45,2 Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". En Maier HJ, Bickerton E, Britton P. Coronaviruses. Methods in Molecular Biology 1282. Springer. pp. 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
See Table 2.
- ↑ Masters PS (2006-01-01). "The molecular biology of coronaviruses". Advances in Virus Research (Academic Press) 66: 193–292. ISBN 9780120398690. PMID 16877062. doi:10.1016/S0065-3527(06)66005-3.
Ver Figura 8.
- ↑ 47,0 47,1 47,2 Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". En Maier HJ, Bickerton E, Britton P. Coronaviruses. Methods in Molecular Biology 1282. Springer. pp. 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
See section: Replicase Protein Expression
- ↑ Sexton NR, Smith EC, Blanc H, Vignuzzi M, Peersen OB, Denison MR (August 2016). "Homology-Based Identification of a Mutation in the Coronavirus RNA-Dependent RNA Polymerase That Confers Resistance to Multiple Mutagens". Journal of Virology 90 (16): 7415–28. PMC 4984655. PMID 27279608. doi:10.1128/JVI.00080-16.
Finalmente, estes resultados, combinados cos dos traballos previos, suxiren que os CoVs codifican polo menos tres proteínas implicadas na fidelidade (nsp12-RdRp, nsp14-ExoN e nsp10), que soportan a ensamblaxe dun complexo multiproteico replicase-fidelidade, como se describiu previamente.
- ↑ Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". En Maier HJ, Bickerton E, Britton P. Coronaviruses. Methods in Molecular Biology 1282. Springer. pp. 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
See section: Corona Life Cycle – Replication and Transcription
- ↑ Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". En Maier HJ, Bickerton E, Britton P. Coronaviruses. Methods in Molecular Biology 1282. Springer. pp. 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
Ver Figura 1.
- ↑ 51,0 51,1 Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". En Maier HJ, Bickerton E, Britton P. Coronaviruses. Methods in Molecular Biology 1282. Springer. pp. 1–23. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
Ver sección: Ciclo de vida dos coronavirus – Ensamblaxe e liberación
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: SARSr-CoV |
| Wikispecies posúe unha páxina sobre: SARSr-CoV |
Bibliografía[editar | editar a fonte]
- Peiris JS, Lai ST, Poon LL, Guan Y, Yam LY, Lim W, et al. (April 2003). "Coronavirus as a possible cause of severe acute respiratory syndrome". Lancet 361 (9366): 1319–25. PMID 12711465. doi:10.1016/s0140-6736(03)13077-2.
- Rota PA, Oberste MS, Monroe SS, Nix WA, Campagnoli R, Icenogle JP, et al. (May 2003). "Characterization of a novel coronavirus associated with severe acute respiratory syndrome". Science 300 (5624): 1394–9. Bibcode:2003Sci...300.1394R. PMID 12730500. doi:10.1126/science.1085952.
- Marra MA, Jones SJ, Astell CR, Holt RA, Brooks-Wilson A, Butterfield YS, et al. (May 2003). "The Genome sequence of the SARS-associated coronavirus". Science 300 (5624): 1399–404. Bibcode:2003Sci...300.1399M. PMID 12730501. doi:10.1126/science.1085953.
- Snijder EJ, Bredenbeek PJ, Dobbe JC, Thiel V, Ziebuhr J, Poon LL, et al. (August 2003). "Unique and conserved features of genome and proteome of SARS-coronavirus, an early split-off from the coronavirus group 2 lineage". Journal of Molecular Biology 331 (5): 991–1004. PMID 12927536. doi:10.1016/S0022-2836(03)00865-9.
- Yount B, Roberts RS, Lindesmith L, Baric RS (August 2006). "Rewiring the severe acute respiratory syndrome coronavirus (SARS-CoV) transcription circuit: engineering a recombination-resistant genome". Proceedings of the National Academy of Sciences of the United States of America 103 (33): 12546–51. Bibcode:2006PNAS..10312546Y. PMC 1531645. PMID 16891412. doi:10.1073/pnas.0605438103.
- Thiel V, ed. (2007). Coronaviruses: Molecular and Cellular Biology (1st ed.). Caister Academic Press. ISBN 978-1-904455-16-5.
- Enjuanes L, Sola I, Zúñiga S, Almazán F (2008). "Coronavirus Replication and Interaction with Host". En Mettenleiter TC, Sobrino F. Animal Viruses: Molecular Biology. Caister Academic Press. ISBN 978-1-904455-22-6.
Outros artigos[editar | editar a fonte]
- SARS-CoV
- SARS-CoV-2
- SL-CoV-WIV1, un coronavius tipo SARS dos morcegos
- Orthocoronavirinae, a subfamilia dos coronavirus
Ligazóns externas[editar | editar a fonte]
- Nota de prensa da OMS na que identifica e nomea o virus da SARS
- Mapa xenéticodo virus da SARS Arquivado 18 de agosto de 2006 en Wayback Machine.
- Rspecial da revista Science sobre o virus da SARS
- McGill University SARS Resources en Wayback Machine (archived 1 de marzo de 2005)
- Páxina sobre a SRS dos Centros para a Prevención e Control de Enfermidades de EUA
- Alerta da OMS
