Quitridiomicose

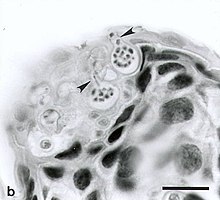
A quitridiomicose é unha enfermidade infecciosa dos anfibios causada polos fungos quitridios Batrachochytrium dendrobatidis e Batrachochytrium salamandrivorans, uns fungos zoospóricos non formadores de hifas. A quitridiomicose foi ligada co drástico declive nas poboacións de anfibios en moitas partes do mundo ou a extinción de especies de anfibios no oeste de Norteamérica, Centroamérica, Suramérica, leste de Australia, leste de África (Tanzania),[1] e a illas caribeñas de Dominica e Montserrat. Unha gran parte do Novo Mundo ten un alto risco de espallamento desta doenza nos próximos anos.[2] Este fungo pode causar mortes esporádicas nalgunhas poboacións de anfibios e un 100% de mortalidade noutras. Non secoñecen medios efectivos para o control da doenza nas poboacións silvestres. Hai varias opcións posibles para controlar o fungo causante da doenza, mais ningunha demostrou ter unha aplicación factible a grande escala. Sinalouse que a doenza é un dos factores que contribúe ao declive global das poboacións de anfibios que aparentemente afecta a un 30% das especies de anfibios do mundo.[3]
Historia[editar | editar a fonte]
A doenza, na súa forma epizoótica, foi descuberta en 1993 en ras mortas ou moribundas en Queensland, Australia. Estivera presente no país desde polo menos 1978 e está estendida por toda Australia. Tamén se encontra en África, as Américas, Europa, Nova Zelandia e Oceanía. En Australia, Panamá e Nova Zelandia, o fungo semella que 'apareceu' de repente e expandíu a súa área xeográfica ao mesmo tempo que declinou a cantidade de ras. Nas Américas orixinouse en Venezuela en 1987, onde varreu o continente ata o límite con Centroamérica. Atopouse outro gromo no sur de Centroamérica en 1987, que se espallou ata unirse co que subía desde Suramérica.[4] Porén, pode ser que simplemente o fungo se dea de forma natural e que só se identificase recentemente, porque se fixo máis virulento ou prevalente no medio ambiente, ou porque as poboacións hóspedes se fixesen menos resistentes á doenza. O fungo detectouse en catro áreas de Australia: costa leste, Adelaida, sueste de Australia Occidental e o Kimberley, e está probablemente presente noutras partes.[5]
A aparición máis antiga documentada de Batrachochytrium é a detectada nunha píntega xigante xaponesa (Andrias japonicus) recollida en 1902, aínda que esta cepa do fungo pertence a unha liñaxe endémica que non foi implicada en episodios de mortes masivas.[6] O seguinte caso coñecido dun anfibio infectado por este fungo foi un exemplar de Xenopus laevis recollido en 1938, aínda que esta especie parece ser que basicamente non é afectada por esta doenza, o que a fai axeitada como vector que serve para espallar a enfermidade.[7] O primeiro método ben documentado de proba do embarazo humana utilizaba esta especie, e como resultado houbo un tráfico internacional a grande escala destas ras, que empezou hai máis de 60 anos.[7] Se Batrachochytrium se orixinou en África, crese que X. laevis foi o vector do seu espallamento inicial polo continente.[7] O primeiro caso documentado de quitridiomicose en América foi nunha Rana catesbeiana (hoxe chamada Lithobates catesbeianus) recollida en 1978.[7] Non está claro, se é un patóxeno novo emerxente ou se é un patóxeno que experimentou un incremento da virulencia recente.
Distribución[editar | editar a fonte]
A área xeográfica da quitridiomicose é difícil de trazar. Se se dá un gromo, este só se produce onde está presente a especie B. dendrobatidis. Porén, a doenza non sempre se produce onde o fungo está presente. As razóns para o declive dos anfibios califícanse ás veces de ‘enigmáticas’ porque a causa se descoñece. Non se sabe por que algunhas áreas son afectadas pola enfermidade do fungo mentres que outras non. Factores oscilantes como o clima, a adecuación do hábitat e a densidade de poboación poden causar que o fungo infecte os anfibios dunha área determinada. Por tanto, cando se considera a área xeográfica da quitridiomicose, debe considerarse sempre a área de distribución de B. dendrobatidis.[4] Recentemente fixéronse mapas da área xeográfica de B. dendrobatidis e abrangue a maior parte do mundo. B. dendrobatidis foi detectado en 56 dos 82 países examinados e en 516 de 1240 (42%) especies usando un conxunto de datos de máis de 36 000 individuos. Está amplamente espallado nas Américas e detectouse esporadicamente en África, Asia e Europa.[2] En Asia, por exemplo, presenta só un 2,35% de prevalencia.[8]
A área adecuada para B. dendrobatidis no Novo Mundo é vasta. As rexións máis axeitadas para el son os hábitats que conteñen a fauna de anfibios máis diversa do mundo. Áreas en risco son o bosque occidental de piñeiro e carballo de Sierra Madre, os bosques secos de Sonora e Sinaloa, o bosue húmido de Veracruz, América Central ao leste do istmo de Tehuantepec, as illas do Caribe, o bosque temperado de Chile e oeste da Arxentina ao sur dos 30°S, os Andes por riba dos 1000 m sobre o nivel do mar en Venezuela, Colombia e Ecuador, as ladeiras leste dos Andes no Perú e Bolivia, o bosque atlántico brasileiro, Uruguai, Paraguai e o noroeste da Arxentina, así como o suroeste das selvas da Amazonia do Madeira-Tapajós.[9]
Actualemnte, os efectos da quitridiomicose obsérvanse máis facilmente en América Central, leste de Australia, América do Sur, e oeste de América do Norte.[2]
Cambio climático[editar | editar a fonte]
Un estudo suxeriu que o cambio na temperatura global pode ser o responsable do incremento da proliferación da quitridiomicose. A elevación das temperaturas aumentou a evaporación en certos ambientes boscosos, o cal como resultado promoveu a formación de nubes.[10] Os expertos propoñen que o incremento da cuberta de nubes podería en realidade estar facendo descender a temperatura diúrna ao bloquear o sol, mentres que de noite a cuberta nubosa serve como illante que fai subir a temperatura nocturna por riba dos seus valores normais. A combinación de diminución da temperatur diúrna e o incremento da nocturna pode proporcionar unhas condicións óptimas para o crecemento e reprodución dos fungos quitridios, que prefiren un intervalo de temperaturas entre os 17° e os 25 °C.[11] O fungo morre a temperaturas iguais ou superiores a 30 °C, ás cales sen a cuberta nubosa causada polo incremento de evaporación se chega máis doadamente no medio ambiente e pode, por tanto, manter poboación do fungo en xaque.[10]
Axentes causantes[editar | editar a fonte]
A quitridiomicose causada polo fungo B. dendrobatidis afecta predominantemente as capas máis externas da pel que conteñen queratina.[4] Cando a maioría das especies chegan a un valor limiar de 10 000 zoósporas de B. dendrobatidis, non poden respirar, hidratarse ou osmorregularse nin termoregularse correctamente. Isto pode probarse con mostras de sangue que indican a falta de certos electrólitos, como o sodio, magnesio e potasio. B. dendrobatidis pasa por dous estadios vitais. O primeiro é o estadio zoosporanxial asexual.[12] Cando un hóspede contrae inicialmente a doenza, as esporas penetran na pel e adhírense usando unha raíces de microtúbulos.[13] O segundo estadio ten lugar cando os zoosporanxios asexuais iniciais producen esporas móbiles.[12] Para dispersar e infectar células epidérmicas, necesítase unha superficie húmida .[12] En 2013 descubriuse unha segunda especie de Batrachochytrium, B. salamandrivorans, que tamén causa quitridiomicose en píntegas.[14]
Transmisión e progresión da doenza[editar | editar a fonte]
B. dendrobatidis é un patóxeno que transporta o aire, que dispersa as súas zoósporas no medio ambiente.[15] As zoósporas usan un flaxelo para a locomoción polos sistemas de auga ata que alcanzan un novo hóspede e entran na súa pel.[13] o ciclo de vida de B. dendrobatidis’ continúa ata que se producen novas zoósporas no zoosporanxio e saen ao ambiente ou reinfectan o mesmo hóspede.[13] Unha vez que se infecta o hóspede por B. dendrobatidis, potencialmente podería desenvolver a quitridiomicose, mais non todos os hóspedes infectados a desenvolven.[13] Outras formas de transmisión son actualmente descoñecidas; porén, postúlase que a quitridiomicose se transmite por contactod irecto dos hóspedes ou por medio dun hóspede intermedio.[13]
Descoñécese moito sobre como se transmite B. dendrobatidis con éxito dun hóspede ao seguinte.[16] Unha vez liberadas no medio acuático, as zoósporas viaxan menos de 2 cm en 24 horas antes de enquistarse.[17] Este limitado raio de desprazamento das zoósporas de B. dendrobatidis suxire que existe algún mecanismo descoñecido polo cal se transmite dun hóspede ao seguinte,[17] o cal pode implicar o comercio de mascotas e especialmente o da ra touro americana (Lithobates catesbeianus).[18] Factores abióticos como a temperatura, pH e niveis de nutrientes afectan o éxito das zoósporas de B. dendrobatidis.[17] Estas zoósporas poden sobrevivir nun intervalo de temperaturas entre 4 e 25 °C e de pH entre 6 e 7.[17]
A quitridiomicose crese que segue este curso: as zoósporas encóntranse primeiramente coa pel dun anfibio e rapidamente dan lugar a esporanxios, que producen novas zoósporas.[19] A doenza despois progresa a medida que as novas zoósporas reinfectan o hóspede. Entre os cambios morfolóxicos nos anfibios infectados co fungo están que a pel ventral se pon vermella, convulsións con extensión das extremidades posteriores, acumulacións de pel desprendida sobre o corpo, exfoliación da epiderme superficial dos pés e outras áreas, lixeiro aumento da rugosidade da superficie con diminutas adherencias de pel, e ocasionalmente pequenas úlceras ou hemorraxias na pel. Entre os cambios de comportamento están o letargo, non buscar refuxio, non escapar, perder o reflexo postural e posturas anormais (por exemplo, sentar coas patas traseiras separadas do corpo).[20]
Signos clínicos[editar | editar a fonte]
Os anfibios infectados por B. dendrobatidis mostran moitos signos clínicos. Quizais o signo inicial da infección é a anorexia, que aparece rapidamente oito días despois de ser infectado.[16] Os individuos infectados encóntranse tamén con frecuencia en estado letárxico, caracterizado por realizar o animal movementos lentos e non querer moverse cando é estimulado. Obsérvase un excesivo desprendemento da pel na maioría das especies de ras afectadas por B. dendrobatidis.[4] Estes cachos de pel desprendida descríbense como opacos, brancos cincentos e pardos.[4] Algúns destes anacos de pel encóntranse tamén adheridos á pel.[4] Estes signos de infección obsérvanse a miúdo entre 12 e 15 días despois da exposición.[16] O síntoma máis típico da quitridiomicose é o engrosamento da pel, que rapidamente leva á morte dos individuos infectados porque eses individuos non poden tomar os nutrientes apropiados, liberar toxinas ou nalgúns casos respirar pola pel.[4] Outros signos comúns son a cor colorada que toma a pel, convulsións e perda de reflexos posturais .[16] Nos cágados, B. dendrobatidis afecta as pezas bucais que teñen queratina, o que orixina comportamentos de alimentación anormais ou decoloración da boca.[4]
Investigación e impacto[editar | editar a fonte]
O fungo quitridio dos anibios parece crecer mellor entre os 17 e os 25 °C,[17] e a exposición de ras infectadas a temperturas altas pode curalas.[21] Na natureza, canto máis tempo se manteña un exemplar de ra a temperturas por riba de 25 °C, menos probable é ue sexan infectados polo quitridio dos anfibios.[22] Isto pode explicar por que o declive dos anfibios inducido pola quitridiomicose ocorreu principalmente en zonas de altura elevada e durante os meses fríos.[23] Os péptidos curáneos producidos naturalmente polas ras poden inhibir o crecemento de B. dendrobatidis cando os anfibios infectados están a termperaturas próximas a 10&nbp;°C, o que permite a especies como Lithobates pipiens eliminar a infección nun 15% dos caos.[24]
Aínda que se culpou de moitos dos declives ao fungo B. dendrobatidis, algunhas especies resisten a infección e algunhas poboacións poden sobrevivir cun baixo nivel de persistencia da doenza.[25] Ademais, algunhas especies que parecen resistir a infección poden en realidade albergar unha forma non patóxena de B. dendrobatidis.
Algúns investigadores argumentan que poñer o foco na quitridiomicose fixo que os esforzos de conservación dos anfibios sexan perigosamente miopes. Unha revisión dos datos da Lista Vermella da IUCN encontrou que se asumía a ameaza desta doenza na maioría dos casos, pero non se sinalaban as probas.[26] Os esforzos de conservación en Nova Zelandia seguen centrándose en curar da quitridiomicose a especie nativa en perigo crítico Leiopelma archeyi, aínda que as investigacións mostraron claramente que son inmunes á infección por B. dendrobatidis e están morrendo na natureza por causa doutras doenzas aínda sen identificar.[27] In Guatemala, several thousand tadpoles perished from an unidentified pathogen distinct from B. dendrobatidis.[28]
Unha artigo de "revisión" de 2019 na revista Science estimaba que a quitridiomicose fora un factor no declive de polo menos 501 especies de anfibios durante os últimos 50 anos, das cales 90 especies se confirmou ou se presumía que xa se extinguiran na natureza e outras 124 declinaran en cantidade en máis do 90%.[29] Neste artigo calificábase a cifra de baixas oficial como "a maior perda rexistrada de biodiversidade atribuíble a unha doenza".[30][31]
Inmunidade[editar | editar a fonte]
Debido ao enorme impacto do fungo nas poboacións de anfibios, realizouse unha considerable investigación para idear métodos para combater a súa proliferación na natureza. Entre os descubrimentos máis prometedores está que as colonias de anfibios que sobreviven ao paso da epidemia de quitridios adoitan portar elevados niveis da bacteria Janthinobacterium lividum.[32] Esta bacteria produce compostos antifúnxicos, como o indol-3-carboxaldehido e a violaceína, que inhiben o crecemento de B. dendrobatidis mesmo a baixas concentracións.[33] De xeito similar, a bacteia Lysobacter gummosus que se encontrou na píntega Plethodon cinereus, produce o composto 2,4-diacetilfloroglucinol, que tamén inhibe o crecemento de B. dendrobatidis.[34]
Comprender as interaccións das comunidades microbianas presentes na pel dos anfibios con especies fúnxicas do medio ambiente pode revelar por que certos anfibios, como Rana muscosa, son susceptibles aos efectos mortais de B. dendrobatidis, mentres que outros, como a píntega Hemidactylium scutatum, poden coexistir co fungo. Como se indicou anteriormente, a especie bacteriana con actividade antifúnxica Janthinobacterium lividum, que se encontrou en varias especies de anfibios, pode previr os efectos do patóxeno incluso cando esta bacteria se engade a outro anfibio que carece de forma natural desta bacteria.[35] As interaccións entre a microbiota cutánea e B. dendrobatidis poden alterarse para favorecer a resistencia á doenza.[33][36] Aínda que a concentración exacta de violaceína necesaria para inhibir os efectos de B. dendrobatidis non está establecida completamente, esta concentración pode determinar se o anfibio presentará ou non morbilidade (ou mortalidade) causada por B. dendrobatidis. A ra Rana muscosa, por exemplo, ten concentracións moi baixas de violaceína na súa pel, polo que non pode proporcionar unha maior taxa de supervivencia á ra; ademais, J. lividum non está presente na pel de R. muscosa.[35][37] As especies como a píntega H. scutatum, que teñen esta bacteria na pel, producen suficiente violaceína e están protexidas.
Un estudo postulou que a pulga de auga Daphnia magna come as esporas do fungo.[38]
Interaccións con pesticidas[editar | editar a fonte]
A hipótese de que o uso de pesticidas contribuíu ao declive das poboacións de anfibios tense suxerido varias veces na literatura.[39][40][41] En 2007 examináronse as interaccións entre pesticidas e a quitridiomicose e a exposición subletal ao pesticida carbaryl (un inhibidor da colinesterase) incrementa a susceptibilidade en Rana boylii á quitridiomicose. En concreto, as defensas peptídicas da pel estaban significativamente reducidas despois da exposición ao carbaryl, o que indica que os pesticidas poden inhibir esta defensa inmunitaria innata e causar un aumento da susceptibilidade á doenza.[42]
Evolución[editar | editar a fonte]
Informouse nun estudo ecolóxico de indicios de resistencia evolutiva emerxente nunha poboación que se estaba recuperando dunha especie de ra autraliana subtropical que se reproduce en regatos, Mixophyes fleayi, que fora infectada epizooticamente,[43] A recuperación tamén observada de especies de ras en Panamá despois do declive non estaba asociada coa atenuación do patóxeno,[44][45] senón máis ben con algún factor non identificado do hóspede, como a evolución dunha resistencia xenética á infección polo fungo ou algún carácter adquirido (como unha hipotética colonización microbiana protectora).
Opcións de tratamento[editar | editar a fonte]
O uso de antifúnxicos e terapia indicuda por calor foi suxerido como tratamento contra o B. dendrobatidis. Porén, algúns destes antifúnxicos poden causar efectos adversos na pel en certas especies de ras e, aínda que se usan par tratar especies infectadas con quitridiomicose, a infección é difícil de erradicar. Un estudo feito por Rollins-Smith e colegas suxire que para tratar a quitridiomicose por Batrachochytrium (Bd) o antifúnxico de elección é o itraconazole.[46] Este produto é o preferido en comparación coa anfotericina B e o cloranfenicol debido á toxicidade destes; especificamente o cloranfenicol está correlacionado coa leucemia en sapos. Isto converteuse nunha difícil situación porque sen tratamento, as ras presentan deformidades nas extremidades e mesmo morren, pero poden tamén padecer deformidades na pel se as someten ao tratamento. "O tratamento non sempre ten un éxito do 100% e non todos os anfibios toleran o tratamento moi ben; por tanto, a quitridiomicose debería sempre ser tratada seguindo o consello dun veterinario."[47]
Os individuos infectados por B. dendrobatidis son bañados en solucións de intraconazole e en poucas semanas dan negativo nos tests para B. dendrobatidis usando ensaios de PCR.[12][48][49] A terapia por calor é tamén utilizada para neutralizar B. dendrobatidis en individuos infectados.[50][51] Utilízanse experimentos de laboratorio coa temperatura controlada para incrementar a temperatura dun individuo superando o intervalo de temperatura óptimo de B. dendrobatidis.[51] Os experimentos nos que se incrementa a temperatura alén do límite superior do intervalo óptimo de B. dendrobatidis de 25 a 30 °C, mostran que a súa presenza vai desaparecendo en poucas semanas e os individuos infectados retornan á normalidade.[51] Tamén se ten usado o formol/verde malaquita para tratar con éxito individuos con quitridiomicose.[12] Unha Leiopelma archeyi foi curada da quitridiomicose ao aplicarlle cloranfenicol topicamente.[52] Pero os riscos potenciais de usar antifúnxicos son altos.[50]
Notas[editar | editar a fonte]
- ↑ "Nectophrynoides asperginis". Lista Vermella de especies ameazadas. Versión 2011.2 (en inglés). Unión Internacional para a Conservación da Natureza. 2009. Consultado o 8 de xaneiro de 2012.
- ↑ 2,0 2,1 2,2 Olson, Deanna H.; Aanensen, David M.; Ronnenberg, Kathryn L.; Powell, Christopher I.; Walker, Susan F.; Bielby, Jon; Garner, Trenton W. J.; Weaver, George; Fisher, Matthew C.; Stajich, Jason E. (2013). Stajich, Jason E, ed. "Mapping the Global Emergence of Batrachochytrium dendrobatidis, the Amphibian Chytrid Fungus". PLoS ONE 8 (2): e56802. PMC 3584086. PMID 23463502. doi:10.1371/journal.pone.0056802.
- ↑ Stuart S. N.; Chanson J. S.; et al. (2004). "Status and trends of amphibian declines and extinctions worldwide". Science 306 (5702): 1783–1786. PMID 15486254. doi:10.1126/science.1103538.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 Whittaker, Kellie; Vredenburg, Vance. "An Overview of Chytridiomycosis". Amphibiaweb. Consultado o 29 de setembro de 2016.
- ↑ "Chytridiomycosis (Amphibian Chytrid Fungus Disease)" (PDF). Australian Government Department of Sustainability, Environment, Water, Population and Communities. Arquivado dende o orixinal (PDF) o 11 de setembro de 2007. Consultado o 14 de outubro de 2013.
- ↑ Goka, Koichi; Yokoyama, Jun; Une, Yumi; Kuroki, Toshiro; Suzuki, Kazutaka; Nakahara, Miri; Kobayashi, Arei; Inaba, Shigeki; Mizutani, Tomoo; Hyatt, Alex D. (2009). "Amphibian chytridiomycosis in Japan: distribution, haplotypes and possible route of entry into Japan". Molecular Ecology 18 (23): 4757–4774. PMID 19840263. doi:10.1111/j.1365-294x.2009.04384.x.
- ↑ 7,0 7,1 7,2 7,3 Weldon; du Preez; Hyatt; Muller; and Speare (2004). Origin of the Amphibian Chytrid Fungus. Emerging Infectious Diseases 10(12).
- ↑ Swei, A.; Rowley, J.J. L.; Rödder, D.; Diesmos, M. L. L.; Diesmos, A. C.; Briggs, C. J.; Brown, R.; et al. (2011). Arlettaz, Raphaël, ed. "Is Chytridiomycosis an Emerging Infectious Disease in Asia?". PLoS ONE 6 (8): e23179. PMC 3156717. PMID 21887238. doi:10.1371/journal.pone.0023179.
- ↑ Ron, Santiago R. (xuño de 2005). "Predicting the Distribution of the Amphibian Pathogen Batrachochytrium dendrobatidis in the New World". Biotropica 37 (2): 209–221. doi:10.1111/j.1744-7429.2005.00028.x.
- ↑ 10,0 10,1 Pounds, Alan (12 de xaneiro de 2006). "Widespread Amphibian Extinctions from Epidemic Disease Driven by Global Warming". Nature 439 (7073): 161–167. PMID 16407945. doi:10.1038/nature04246.
- ↑ Handwerk, Brian. "Frog Extinctions Linked to Global Warming". National Geographic News. National Geographic. Consultado o 27 de maio de 2016.
- ↑ 12,0 12,1 12,2 12,3 12,4 Parker JM, Mikaelian I, Hahn N, Diggs HE (2002). "Clinical diagnosis and treatment of epidermal chytridiomycosis in African clawed frogs (Xenopus tropicalis)". Comp. Med. 52 (3): 265–8. PMID 12102573.
- ↑ 13,0 13,1 13,2 13,3 13,4 Longcore J. E.; Pessier A. P.; Nichols D. K. (1999). "Batrachochytrium dendrobatidis gen. et sp. nov., a chytrid pathogenic to amphibians". Mycologia 91 (2): 219–227. JSTOR 3761366. doi:10.2307/3761366.
- ↑ Martel, A.; Spitzen-van der Sluijs, A.; Blooi, M.; Bert, W.; Ducatelle, R.; Fisher, M. C.; Woeltjes, A.; Bosman, W.; Chiers, K.; Bossuyt, F.; Pasmans, F. (2013). "Batrachochytrium salamandrivorans sp. nov. causes lethal chytridiomycosis in amphibians". Proceedings of the National Academy of Sciences of the United States of America 110 (38): 15325–15329. PMC 3780879. PMID 24003137. doi:10.1073/pnas.1307356110.
- ↑ Morgan J. A. T.; Vredenburg V. T.; Rachowicz L. J.; Knapp R. A.; Stice M. J.; Tunstall T.; Bingham R. E.; Parker J. M.; Longcore J. E.; et al. (2007). "Population genetics of the frog-killing fungus Batrachochytrium dendrobatidis". Proceedings of the National Academy of Sciences of the United States of America 104 (34): 13845–13850. PMC 1945010. PMID 17693553. doi:10.1073/pnas.0701838104.
- ↑ 16,0 16,1 16,2 16,3 Nichols D. K.; Lamirande E. W.; Pessier A. P.; Longcore J. E. (2001). "Experimental transmission of cutaneous chytridiomycosis in dendrobatid frogs". Journal of Wildlife Diseases 37 (1): 1–11. PMID 11272482. doi:10.7589/0090-3558-37.1.1.
- ↑ 17,0 17,1 17,2 17,3 17,4 Piotrowski J. S.; Annis S. L.; Longcore J. E. (2004). "Physiology of Batrachochytrium dendrobatidis, a chytrid pathogen of amphibians". Mycologia 96 (1): 9–15. JSTOR 3761981. PMID 21148822. doi:10.2307/3761981.
- ↑ Borzée, Amaël; Kosch, Tiffany A.; Kim, Miyeon; Jang, Yikweon (31 de maio de 2017). "Introduced bullfrogs are associated with increased Batrachochytrium dendrobatidis prevalence and reduced occurrence of Korean treefrogs". PLoS One 12 (5): e0177860. PMC 5451047. PMID 28562628. doi:10.1371/journal.pone.0177860.
- ↑ Berger L, Hyatt AD, Speare R, Longcore JE (2005). "Life cycle stages of the amphibian chytrid Batrachochytrium dendrobatis". Diseases of Aquatic Organisms 68: 51–63. doi:10.3354/dao068051.
- ↑ Padgett-Flohr, G.E. (2007). "Amphibian Chytridiomycosis: An Informational Brochure" (PDF). California Center for Amphibian Disease Control. Arquivado dende o orixinal (PDF) o 13 de agosto de 2011. Consultado o 14 de outubro de 2013.
- ↑ Woodhams, D. C., R. A. Alford, et al. (2003). "Emerging disease of amphibians cured by elevated body temperature." Diseases of aquatic organisms 55: 65–67.
- ↑ Rowley J.J.L., Alford R.A. (2013). "Hot bodies protect amphibians against chytrid infection in nature". Scientific Reports 3: 1515. PMC 3604863. PMID 23519020. doi:10.1038/srep01515.
- ↑ Woodhams D. C.; Alford R. A. (2005). "The ecology of chytridiomycosis in rainforest stream frog assemblages of tropical Queensland". Conserv. Biol. 19 (5): 1449–1459. doi:10.1111/j.1523-1739.2005.004403.x.
- ↑ Voordouw MJ, Adama D, Houston B, Govindarajulu P, Robinson J (2010). "Prevalence of the pathogenic chytrid fungus, Batrachochytrium dendrobatidis, in an endangered population of northern leopard frogs, Rana pipiens". BMC Ecol. 10: 6. PMC 2846871. PMID 20202208. doi:10.1186/1472-6785-10-6.
- ↑ Retallick R. W. R.; McCallum H.; et al. (2004). "Endemic Infection of the Amphibian Chytrid Fungus in a Frog Community Post-Decline". PLoS Biology 2 (11): e351. PMC 521176. PMID 15502873. doi:10.1371/journal.pbio.0020351.
- ↑ Heard M, Smith KF, Ripp K (2011). "Examining the Evidence for Chytridiomycosis in Threatened Amphibian Species". PLoS ONE 6 (8): e23150. PMC 3149636. PMID 21826233. doi:10.1371/journal.pone.0023150.
- ↑ Waldman B (2011) Brief encounters with Archey's Frog. FrogLog 99:39–41.
- ↑ Di Rosa, Ines; Simoncelli, Francesca; Fagotti, Anna; Pascolini, Rita (2007). "Ecology: The proximate cause of frog declines?". Nature 447 (7144): E4–E5. PMID 17538572. doi:10.1038/nature05941.
- ↑ "Amphibian 'apocalypse' caused by most destructive pathogen ever". Animals. 2019-03-28. Consultado o 2019-04-06.
- ↑ Briggs, Helen (29 de marzo de 2019). "Killer frog disease extinction toll revealed". Consultado o 29 de marzo de 2019.
- ↑ Scheele, Ben C.; Pasmans, Frank; Skerratt, Lee F.; et al. (28 de marzo de 2019). "Amphibian fungal panzootic causes catastrophic and ongoing loss of biodiversity". Science 363 (6434): 1459–1463. doi:10.1126/science.aav0379.
- ↑ Richard Black (6 de xuño de 2008). "Bacteria could stop frog killer". BBC News. Consultado o 7 de xuño de 2008.
- ↑ 33,0 33,1 Brucker RM, Harris RN, Schwantes CR, Gallaher TN, Flaherty DC, Lam BA, Minbiole KP (novembro de 2008). "Amphibian chemical defense: antifungal metabolites of the microsymbiont Janthinobacterium lividum on the salamander Plethodon cinereus". Journal of Chemical Ecology 34 (11): 1422–9. PMID 18949519. doi:10.1007/s10886-008-9555-7.
- ↑ Brucker RM, Baylor CM, Walters RL, Lauer A, Harris RN, Minbiole KP (xaneiro de 2008). "The identification of 2,4-diacetylphloroglucinol as an antifungal metabolite produced by cutaneous bacteria of the salamander Plethodon cinereus". Journal of Chemical Ecology 34 (1): 39–43. PMID 18058176. doi:10.1007/s10886-007-9352-8.
- ↑ 35,0 35,1 Harris R.; Brucker R.; Minbiole K.; Walke J.; Becker M.; Schwantes C.; et al. (2009). "Skin microbes on frogs prevent morbidity and mortality caused by a lethal skin fungus". ISME Journal 3 (7): 818–824. PMID 19322245. doi:10.1038/ismej.2009.27.
- ↑ Becker M.; Brucker R.; Schwantes C.; Harris R.; Minbiole K. (2009). "The bacterially-produced metabolite violacein is associated with survival in amphibians infected with a lethal disease". Applied and Environmental Microbiology 75 (21): 6635–6638. PMC 2772424. PMID 19717627. doi:10.1128/AEM.01294-09.
- ↑ Lam B.; Walke J.; Vredenburg V.; Harris R. (2009). "Proportion of individuals with anti-Batrachochytrium dendrobatidis skin bacteria is associated with population persistence in the frog Rana muscosa". Biological Conservation 143 (2): 529–531. doi:10.1016/j.biocon.2009.11.015.
- ↑ Buck, Julia; Truong, Lisa; Blaustein, Andrew (2011). "Predation by zooplankton on Batrachochytrium dendrobatidis: biological control of the deadly amphibian chytrid fungus?". Biodiversity and Conservation 20 (14): 3549–3553. doi:10.1007/s10531-011-0147-4.
- ↑ Stebbins, Robert C, Cohen, Nathan W. (1995). A Natural History of Amphibians. Princeton, N.J: Princeton University Press. ISBN 978-0-691-10251-1.
- ↑ Daividson C, Shaffer HB, Jennings MR (2001). "Declines of the California red-legged frog: climate, UV-B, habitat, and pesticides hypotheses". Ecological Applications 11 (2): 464–479. doi:10.1890/1051-0761(2001)011[0464:DOTCRL]2.0.CO;2.
- ↑ Hayes TB, Case P, Chui S, Chung D, Haeffele C, Haston K, Lee M, Mai VP, Marjuoa Y, Parker J, Tsui M (abril de 2006). "Pesticide mixtures, endocrine disruption, and amphibian declines: are we underestimating the impact?". Environ. Health Perspect. 114 (Suppl 1): 40–50. PMC 1874187. PMID 16818245. doi:10.1289/ehp.8051. Arquivado dende o orixinal o 18 de xaneiro de 2009. Consultado o 08 de maio de 2019.
- ↑ Davidson C, Benard MF, Shaffer HB, Parker JM, O'Leary C, Conlon JM, Rollins-Smith LA (marzo de 2007). "Effects of chytrid and carbaryl exposure on survival, growth and skin peptide defenses in foothill yellow-legged frogs". Environ. Sci. Technol. 41 (5): 1771–6. PMID 17396672. doi:10.1021/es0611947.
- ↑ David Alan Newell, Ross Lindsay Goldingay, and Lyndon Owen Brooks. Population Recovery following Decline in an Endangered Stream-Breeding Frog (Mixophyes fleayi) from Subtropical Australia. PLoS One. 2013; 8(3): e58559. Published online 2013 Mar 13. doi: 10.1371/journal.pone.0058559. PMCID: PMC3596276. PMID 23516509 . [1]
- ↑ http://science.sciencemag.org/content/359/6383/1517
- ↑ http://science.sciencemag.org/content/359/6383/1458
- ↑ Holden, Whitney M.; Ebert, Alexander R.; Canning, Peter F.; Rollins-Smith, Louise A.; Brakhage, A. A. (2014). "Evaluation of Amphotericin B and Chloramphenicol as Alternative Drugs for Treatment of Chytridiomycosis and Their Impacts on Innate Skin Defenses". Applied and Environmental Microbiology 80 (13): 4034–4041. ISSN 0099-2240. PMC 4054225. PMID 24771024. doi:10.1128/AEM.04171-13.
- ↑ "Chytrid Fungus - causing global amphibian mass extinction". Amphibian Ark (en inglés). Arquivado dende o orixinal o 12 de xuño de 2019. Consultado o 2017-05-15.
- ↑ Une Y.; Matsui K.; Tamukai K.; Goka K. (2012). "Eradication of the chytrid fungus Batrachochytrium dendrobatidis in the Japanese giant salamander Andrias japonicus". Diseases of Aquatic Organisms 98 (3): 243–247. PMID 22535874. doi:10.3354/dao02442.
- ↑ Jones M. E. B.; Paddock D.; Bender L.; Allen J. L.; Schrenzel M. D.; Pessier A. P. (2012). "Treatment of chytridiomycosis with reduced-dose itraconazole". Diseases of Aquatic Organisms 99 (3): 243–249. PMID 22832723. doi:10.3354/dao02475.
- ↑ 50,0 50,1 Woodhams D. C.; Geiger C. C.; Reinert L. K.; Rollins-Smith L. A.; Lam B.; Harris R. N.; Briggs C. J.; Vredenburg V. T.; Voyles J. (2012). "Treatment of amphibians infected with chytrid fungus: learning from failed trials with itraconazole, antimicrobial peptides, bacteria, and heat therapy". Diseases of Aquatic Organisms 98 (1): 11–25. PMID 22422126. doi:10.3354/dao02429.
- ↑ 51,0 51,1 51,2 Chatfield M. W. H., Richards-Zawacki C. L. (2011). "Elevated temperature as a treatment for Barachochytrium dendrobatidis infection in captive frogs". Diseases of Aquatic Organisms 94 (3): 235–238. PMID 21790070. doi:10.3354/dao02337.
- ↑ Bishop, PJ; Speare, R; Poulter, R; Butler, M; Speare, BJ; Hyatt, A; Olsen, V; Haigh, A (9 de marzo de 2009). "Elimination of the amphibian chytrid fungus Batrachochytrium dendrobatidis by Archey's frog Leiopelma archeyi" (PDF). Diseases of Aquatic Organisms 84 (1): 9–15. PMID 19419002. doi:10.3354/dao02028.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Artigo en National Geographic Magazine, abril de 2009 Arquivado 28 de outubro de 2017 en Wayback Machine.
- Wildlife Trade and Global Disease Emergence
- Main preventative management strategies for the Chytrid fungus Arquivado 03 de marzo de 2016 en Wayback Machine.
- Quitridiomicose en anfibios ent Amphibian Diseases Home Page
- 'Amphibian Ark' trata de salvar as ras dos fungo Arquivado 10 de maio de 2008 en Wayback Machine.
