ADN polimerase I
| ADN polimerase I | |
|---|---|
| |
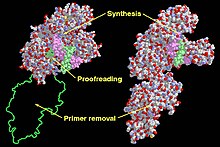
| Dominios funcionais do fragmento de Klenow (esquerda) e da ADN polimerase I (dereita) de Escherichia coli | |
| Identificadores | |
| Organismo | |
| Símbolo | polA |
| Entrez | 948356 |
| PDB | 1DPI |
| RefSeq (Prot) | NP_418300.1 |
| UniProt | P00582 |
| Outros datos | |
| Número EC | 2.7.7.7 |
| Cromosoma | xenoma: 4.04 - 4.05 Mb |
A ADN polimerase I ou DNA polimerase I (abreviada como ADN pol I ou Pol I, aínda que este nome tamén se lle dá á ARN pol I) é un encima procariótico que participa no proceso da replicación do ADN no que elimina o ARN dos fragmentos de Okazaki substituíndoo por ADN, entre outras actividades. Foi descuberta por Arthur Kornberg en 1956,[1] e foi a primeira ADN polimerase que se descubriu (e a tamén a primeira de todas as polimerases). Caracterizouse inicialmente na bacteria E. coli, pero é común nos procariotas. En E. coli e moitas outras bacterias, o xene que codifica a ADN pol I denomínase polA. A forma do encima que aparece en E. coli está composta por 928 aminoácidos nunha soa cadea polipeptídica.
A ADN pol I posúe catro actividades encimáticas:
- Actividade de ADN polimerase ADN dependente 5' → 3' (cara a adiante), que require un sitio cebador 3' e unha cadea molde.
- Actividade exonuclease 3' → 5' (en dirección inversa) que media a chamada corrección de probas
- Actividade exonuclease 5' → 3' (cara a adiante) que media a chamada nick translation (traslado da amosega) durante a reparación do ADN.
- Actividade de ADN polimerase ARN dependente 5' → 3' (cara a adiante). A ADN pol I opera sobre os moldes de ARN cunha eficiencia considerablemente inferior (0,1–0,4%) que sobre os moldes de ADN, e esta actividade é probablemente o único paso limitante da velocidade de importancia biolóxica do encima.[2]
No proceso de replicación fórmanse uns curtos fragmentos de ARN chamados fragmentos de Okazaki, que funcionan como cebadores ou primers, que despois serán eliminados (ver replicación do ADN). A ADN polimerase I é a que se encarga de eliminar ese cebador de ARN (creado polo encima primase) na cadea descontinua ou retardada do ADN en replicación, e enche o espazo cos nucleótidos necesarios entre os fragmentos de Okazaki en dirección 5' → 3', facendo a corrección de probas para eliminar os posibles erros a medida que avanza. É un encima dependente de molde, xa que só engade os nucleótidos que establecen os apareamentos de bases correctos coa cadea existente de ADN que actúa como molde. Os fragmentos de Okazaki son unidos despois pola ADN ligase, orixinando unha cadea continua.
Malia que foi a primeira polimerase que foi caracterizada, axiña quedou claro que a ADN polimerase I non era o encima responsable da maioría da síntese do ADN. A replicación do ADN en E. coli avanza a aproximadamente 1.000 nucleótidos por segundo, mentres que a taxa de síntese de pares de bases da ADN polimerase I como media é de só de 10 a 20 nucleótidos por segundo. Ademais, a súa abundancia na célula é de aproximadamente 400 moléculas por célula, o que non se correlaciona co feito de que só hai dúas forquitas de replicación en E. coli. Ademais, non é un encima suficientemente procesivo para copiar todo o xenoma, xa que se desprende do ADN despois de ter incorporado só 25-50 nucleótidos. O seu papel concreto na replicación probouse en 1969, cando John Cairns illou un mutante viable da ADN polimerase I que carecía de actividade de polimerase.[3] A axudante de laboratorio de Cairns Paula De Lucia preparou miles de extractos libres de células de colonias de E. coli e probou a súa actividade de ADN polimerase. O clon 3.478 contiña o mutante polA, que foi nomeado por Cairns en honor de "Paula" [De Lucia].[4] Cando se descubriu a ADN polimerase III sóubose que era ese o principal encima replicativo do ADN.
Aplicacións en investigación[editar | editar a fonte]
A ADN polimerase I de E. coli utilízase moito en investigación na bioloxía molecular. Porén, a súa actividade exonuclease 5' → 3' fai que non sexa axeitada para moitas aplicacións. Afortunadamente esta actividade encimática non desexada pode ser eliminada do holoencima de modo que quede só unha molécula útil máis pequena chamada fragmento de Klenow, moi usada en bioloxía molecular. Este fragmento obtense expoñendo a ADN polimerase I á acción da protease subtilisina; esta cliva a molécula orixinando un fragmento máis pequeno (de Klenow), que mantén só as actividades de ADN polimerase e de corrección de probas.
Notas[editar | editar a fonte]
- ↑ Lehman IR, Bessman MJ, Simms ES, Kornberg A (1958). "Enzymatic synthesis of deoxyribonucleic acid. I. Preparation of substrates and partial purification of an enzyme from Escherichia coli". J. Biol. Chem. 233 (1): 163–70. PMID 13563462.
- ↑ Ricchetti M, Buc H (1993). "E. coli DNA polymerase I as a reverse transcriptase". EMBO J. 12 (2): 387–96. PMC 413221. PMID 7679988.
- ↑ De Lucia P, Cairns J (1969). "Isolation of an E. coli strain with a mutation affecting DNA polymerase". Nature 224 (5225): 1164–6. PMID 4902142. doi:10.1038/2241164a0.
- ↑ Friedberg EC (2006). "The eureka enzyme: the discovery of DNA polymerase". Nat. Rev. Mol. Cell Biol. 7 (2): 143–7. PMID 16493419. doi:10.1038/nrm1787.
