Inositol
| mio-Inositol[1] | |
|---|---|
 | |
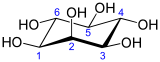 | |
(1R,2R,3S,4S,5R,6S)-ciclohexano-1,2,3,4,5,6-hexol | |
Outros nomes cis-1,2,3,5-trans-4,6-Ciclohexanohexol , Ciclohexanohexol, | |
| Identificadores | |
| Número CAS | 87-89-8 |
| PubChem | 892 |
| ChemSpider | 10239179 |
| UNII | 4L6452S749 |
| KEGG | D08079 |
| ChEBI | CHEBI:17268 |
| ChEMBL | CHEMBL1222251 |
| Código ATC | A11 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6H12O6 |
| Masa molar | 180,16 g mol−1 |
| Densidade | 1,752 g/cm³ |
| Punto de fusión | 225–227 °C |
| Perigosidade | |
| NFPA 704 | |
| Punto de inflamabilidade | 143 °C |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O inositol é un polialcohol cíclico coa fórmula C6H12O6 ou (-CHOH-)6, que consiste nun ciclohexano con seis funcións alcohol (-OH). Existen 9 estereoisómeros do inositol, dos cales a forma máis importante e moi estendida na natureza é o cis-1,2,3,5-trans-4,6-ciclohexanohexol, ou mio-inositol (antes chamado meso-inositol).[2][3] Case non ten sabor, pero é lixeiramente doce.
O mio-inositol xoga un importante papel como base estrutural de varios segundos mensaxeiros nas células eucariotas, como son os inositol fosfatos, o fosfatidilinositol (PI) e o fosfatidilinositol fosfato (PIP, un fosfoinosítido). O inositol ou os seus fosfatos e lípidos asociados atópanse en moitos alimentos, en particular na froita, especialmente na laranxa.[4] Nas plantas atopamos o inositol hexafosfato ou ácido fítico e os seus sales, os fitatos. O ácido fítico está presente tamén nos cereais con alto contido de fibra e tamén en noces e feixóns, pero o inositol como fitato non é directamente biodispoñible nos humanos na dieta, xa que non é dixestible [5] (algunhas técnicas de preparación degradan parcialmente os fitatos para evitar isto). Polo contrario, o inositol que aparece en certas substancias derivadas de plantas, como as lecitinas é ben absorbido e relativamente biodispoñible.
O mio-inositol era antes considerado unha vitamina do grupo B, pero xa non se considera como tal, xa que hoxe sabemos que pode ser sintetizado no corpo humano en cantidades suficientes a partir dun produto sinxelo tan común como a glicosa, e non se coñecen síndromes por déficit de inositol en humanos.[6]
Isómeros e estrutura[editar | editar a fonte]
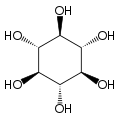
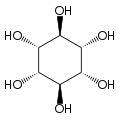
O isómero mio-inositol é un composto meso que posúe na súa molécula un plano de simetría opticamente activo, e meso-inositol é un nome xa obsoleto que recibía antes. Ademais do mio-inositol, os outros estereoisómeros que aparecen na natureza (aínda que en mínimas cantidades) son o scilo-, muco-, D-quiro-, e neo-inositol. Os outros posibles isómeros son L-quiro-, alo-, epi-, e cis-inositol. Como os seus nomes indican, os dous quiro inositois son o único par de enantiómeros do inositol, pero son enantiómeros un do outro, non do mio-inositol.
 |
 |
 |
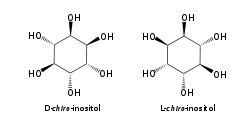 |
| mio- | scilo- | muco- | quiro- |
 |
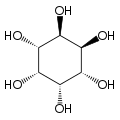 |
 |
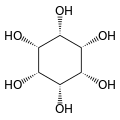 |
| neo- | alo- | epi- | cis- |
Na súa xeometría conformacional estable, o isómero mio-inositol adopta a conformación en cadeira, que pon o máximo número de hidroxilos en posición ecuatorial, na que están o máis afastados posible uns dos outros. Nesta conformación o isómero natural mio ten unha estrutura na cal cinco dos seis hidroxilos (o 1º, 3º, 4º, 5º, e 6º) son ecuatoriais, e o 2º grupo hidroxilo é axial.[7]
Síntese[editar | editar a fonte]
O mio-inositol sintetízase a partir da glicosa-6-fosfato (G-6-P) en dúas reaccións. Primeiro, a glicosa-6-fosfato é isomerizada polo encima inositol-3-fosfato sintase (chamado ISYNA1) a mio-inositol-1-fosfato, o cal é despois desfosforilado polo encima inositol monofosfatase (chamado IMPase 1) dando mio-inositol libre. Nos humanos a maioría do inositol sintetízase nos riles [8], que tamén é o principal órgano onde se degrada o inositol.
Funcións[editar | editar a fonte]
O inositol e varios dos seus mono e polifosfatos funcionan como a base estrutural para diversas moléculas sinalizadoras e segundos mensaxeiros. Están implicados en varios procesos biolóxicos como:
- Transdución de sinais da insulina[9]
- Ensamblaxe do citoesqueleto
- Guía dos nervios (epsina)
- Control da concentración intracelular do calcio (Ca2+) [10]
- Mantemento do potencial de membrana celular [11]
- Modulación da actividade da serotonina
- Degradación das graxas e redución do colesterol sanguíneo [12]
- Expresión xénica[13][14]
O ácido fítico en plantas[editar | editar a fonte]
O ácido fítico ou inositol hexaquisfosfato (IP6) (un inositol hexafosfato), tamén chamado fitato cando está en forma de sal, é a principal forma de almacenamento do fósforo en moito tecidos vexetais, especialmente na fibra vexetal e sementes.[15] Nin o inositol nin o fosfato do ácido fítico das plantas é biodispoñible para os humanos, nin para os animais non ruminantes, xa que non pode ser degradado no seu organismo, pero si poden facelo as bacterias. Ademais, o ácido fítico forma quelatos con importantes minerais como o calcio, magnesio, ferro, e cinc, facendo que estes sexan inabsorbibles, e contribuíndo á creación de deficiencias minerais na xente que toma dietas con moita fibra e sementes, como é frecuente que ocorra en países en vías de desenvolvemento.[16][17]
Tamén se denominan "fitatos" os inositol penta- (IP5), tetra- (IP4), e trifosfato (IP3).
Potencial explosivo[editar | editar a fonte]
O inositol nitrato utilízase hoxe para xelatinizar a nitrocelulosa, polo que pode encontrarse en moitos explosivos modernos e propelentes de foguetes sólidos.[18] O uso do inositol en explosivos foi proposto en 1936 polo profesor Edward Bartow da Universidade de Iowa, que presentou un modo de extraelo rendiblemente de restos de millo e suxeriu que o inositol nitrato sería un explosivo máis estable ca a nitroglicerina [19].
Importancia clínica[editar | editar a fonte]
Cadros psiquiátricos[editar | editar a fonte]
Algúns resultados preliminares de estudos sobre a administracción de suplementos con altas doses de inositol mostraron prometedores resultados na mellora de trastornos como a bulimia, trastorno de pánico, trastorno obsesivo-compulsivo, agorafobia, e depresión (unipolar e bipolar).[20][20][20][21][21][21][22][22][23][23][24] Porén, unha metanálise de probas aleatorias con inositol para o tratamento da depresión non puido determinar se o inositol tiña efecto beneficioso.[25]
Antigas investigacións suxiren que a medicación con litio funcionaba principalmente facendo decrecer as concentracións de mio-inositol nos pacientes bipolares; pero estas conclusións non estaban ben fundamentadas e foron cuestionadas.[26][27] Outros estudos suxiren que o tratamento con litio pode ademais inhibir o encima inositol monofosfatase, causando altos niveis de inositol trifosfato intracelular,[28] un efecto que era amplificado ademais pola administración dun inhibidor da recaptación do inositol trifosfato.
Outras patoloxías[editar | editar a fonte]
Algúns estudos indican que o inositol pode ser beneficioso en casos de síndrome de ovario poliquístico,[9][29][30][31] síndrome metabólica en mulleres posmenopáusicas [32]. Outros estudos indican unha redución en animais da síndrome de desmielinización osmótica (non foi estudado en humanos).[33] Tamén se está a estudar o seu efecto sobre diversos tipos de cánceres [34].
Uso na adulteración de drogas[editar | editar a fonte]
O inositol utilízase con frecuencia como adulterante para "cortar" drogas ilegais, como a cocaína, metaanfetamina, e outras. Probablemente este uso débese a que é soluble e case non ten sabor.
Notas[editar | editar a fonte]
- ↑ Merck Index, 11th Edition, 4883.
- ↑ Synonyms in PubChem
- ↑ Synonyms in Commonchemistry.org
- ↑ Clements RS Jr, Darnell B (1980). "Myo-inositol content of common foods: development of a high-myo-inositol diet" (PDF). American Journal of Clinical Nutrition 33 (9): 1954–1967. PMID 7416064.
- ↑ Clements, Rex; Betty Darnell (1980). "Myo-inositol content of common foods: development of a high-myo-inositol diet" (PDF). American Journal of Clinical Nutrition 33 (9): 1954–1967. PMID 7416064. Consultado o 2009-05-18.
- ↑ Reynolds James E. F. (January 1, 1993). Rittenhouse Book Distributors, ed. Martindale: The Extra Pharmacopoeia 30. Pennsylvania. p. 1379. ISBN 0853693005.
An isomer of glucose that has traditionally been considered to be a B vitamin although it has an uncertain status as a vitamin and a deficiency syndrome has not been identified in man
- ↑ S. M. N. Furse (2006). Imperial College London, ed. The Chemical and Bio-physical properties of Phosphatidylinositol phosphates, Thesis for M.Res.
- ↑ Troyer D.A. et al. Inositol phospholipid metabolism in the kidney. PubMed
- ↑ 9,0 9,1 Larner J (2002). "D-chiro-inositol--its functional role in insulin action and its deficit in insulin resistance". Int J Exp Diabetes Res 3 (1): 47–60. PMC 2478565. PMID 11900279. doi:10.1080/15604280212528.
- ↑ Gerasimenko, Julia V; et al; “Bile Acids Induce Ca2+ Release from Both the Endoplasmic Reticulum and Acidic Intracellular Calcium Stores through Activation of Inositol Trisphosphate Receptors and Ryanodine Receptors”; Journal of Biological Chemistry; December 29, 2006; Volume 281: Pp 40154-40163.
- ↑ Kukuljan M, Vergara L, Stojilkovic SS (1997). "Modulation of the kinetics of inositol 1,4,5-trisphosphate-induced [Ca2+]i oscillations by calcium entry in pituitary gonadotrophs". Biophysical Journal 72 (2 Pt 1): 698–707. Bibcode:1997BpJ....72..698K. PMC 1185595. PMID 9017197. doi:10.1016/S0006-3495(97)78706-X.
- ↑ Rapiejko PJ, Northup JK, Evans T, Brown JE, Malbon CC (1986). "G-proteins of fat-cells. Role in hormonal regulation of intracellular inositol 1,4,5-trisphosphate". The Biochemical Journal 240 (1): 35–40. PMC 1147372. PMID 3103610.
- ↑ Shen, X.; Xiao, H; Ranallo, R; Wu, WH; Wu, C (2003). "Modulation of ATP-dependent chromatin-remodeling complexes by inositol polyphosphates". Science 299 (5603): 112–4. PMID 12434013. doi:10.1126/science.1078068.
- ↑ Steger, D. J.; Haswell, ES; Miller, AL; Wente, SR; O'Shea, EK (2003). "Regulation of chromatin remodelling by inositol polyphosphates". Science 299 (5603): 114–6. PMC 1458531. PMID 12434012. doi:10.1126/science.1078062.
- ↑ Phytic acid
- ↑ Hurrell RF (2003). "Influence of vegetable protein sources on trace element and mineral bioavailability". The Journal of Nutrition 133 (9): 2973S–7S. PMID 12949395.
- ↑ Committee on Food Protection, Food and Nutrition Board, National Research Council (1973). "Phytates". En National Academy of Sciences. Toxicants Occurring Naturally in Foods. pp. 363–371. ISBN 9780309021173.
- ↑ Ledgard, Jared. The Preparatory Manual of Explosives, 2007. p. 366.
- ↑ Laurence, William L. "Corn by-product yields explosive", The New York Times. April 17, 1936. Page 7.
- ↑ 20,0 20,1 20,2 Nick, Gina L. (2004). "Inositol as a treatment for psychiatric disorders: a scientific evaluation of its clinical effectiveness". (indirect through findarticles.com) Townsend Letter for Doctors and Patients (October). Arquivado dende o orixinal o 26 de outubro de 2011. Consultado o 2008-05-24.
- ↑ 21,0 21,1 21,2 Nick, Gina L. (2004). "Inositol as a treatment for psychiatric disorders". (direct) Townsend Letter; the Examiner of Alternative Medicine (October).
- ↑ 22,0 22,1 Palatnik A, Frolov K, Fux M, Benjamin J (2001). "Double-blind, controlled, crossover trial of inositol versus fluvoxamine for the treatment of panic disorder". Journal of Clinical Psychopharmacology 21 (3): 335–339. PMID 11386498. doi:10.1097/00004714-200106000-00014.
- ↑ 23,0 23,1 Levine J, Barak Y, Gonzalves M, Szor H, Elizur A, Kofman O, Belmaker RH. (1995). "Double-blind, controlled trial of inositol treatment of depression". American Journal of Psychiatry 152 (5): 792–794. PMID 7726322.
- ↑ Fux M, Levine J, Aviv A, Belmaker RH (1996). "Inositol treatment of obsessive-compulsive disorder". American Journal of Psychiatry 153 (9): 1219–21. PMID 8780431.
- ↑ Taylor MJ, Wilder H, Bhagwagar Z, Geddes J (2004). Taylor, Matthew J, ed. "Inositol for depressive disorders". Cochrane Database Syst Rev (2): CD004049. PMID 15106232. doi:10.1002/14651858.CD004049.pub2.
- ↑ Silverstone, P. H.; McGrath, B. M.; Kim, H. (2005). "Bipolar disorder and myo-inositol: A review of the magnetic resonance spectroscopy findings". Bipolar Disorders 7 (1): 1–10. doi:10.1111/j.1399-5618.2004.00174.x. PMID 15654927.
- ↑ Harwood, AJ (2005). "Lithium and bipolar mood disorder: the inositol-depletion hypothesis revisited". Molecular Psychiatry 10: 117–126. doi:10.1038/sj.mp.4001618.
- ↑ Einat H, Kofman O, Itkin O, Lewitan RJ, Belmaker RH (1998). "Augmentation of lithium's behavioral effect by inositol uptake inhibitors". J Neural Transm 105 (1): 31–8. PMID 9588758. doi:10.1007/s007020050035. Arquivado dende o orixinal o 30 de marzo de 2001. Consultado o 15 de novembro de 2011.
- ↑ Nestler J E, Jakubowicz D J, Reamer P, Gunn R D, Allan G (1999). "Ovulatory and metabolic effects of D-chiro-inositol in the polycystic ovary syndrome". N Engl J Med 340 (17): 1314–1320. PMID 10219066. doi:10.1056/NEJM199904293401703.
- ↑ Iuorno M J, Jakubowicz D J, Baillargeon J P, Dillon P, Gunn R D, Allan G, Nestler J E (2002). "Effects of d-chiro-inositol in lean women with the polycystic ovary syndrome". Endocr Pract 8 (6): 417–423. PMID 15251831.
- ↑ Nestler J E, Jakubowicz D J, Iuorno M J (2000). "Role of inositolphosphoglycan mediators of insulin action in the polycystic ovary syndrome". J Pediatr Endocrinol Metab. 13 Suppl 5: 1295–1298. PMID 11117673.
- ↑ Giordano D, Corrado F, Santamaria A, Quattrone S, Pintaudi B, DiBenedetto A, D’Anna R (2011). "Effects of myo-inositol supplementation in postmenopausal women with metabolic syndrome: a perspective, randomized, placebo-controlled study". Menopause: The Journal of The North American Menopause Society 18 (1): 102–104. doi:10.1097/gme.0b013e3181e8e1b1.
- ↑ Silver SM, Schroeder BM, Sterns RH, Rojiani AM (2006). "Myoinositol administration improves survival and reduces myelinolysis after rapid correction of chronic hyponatremia in rats". J Neuropathol Exp Neurol 65 (1): 37–44. PMID 16410747. doi:10.1097/01.jnen.0000195938.02292.39.
- ↑ Vucenik, I; Shamsuddin, AM (2003). "Cancer inhibition by inositol hexaphosphate (IP6) and inositol: from laboratory to clinic.". The Journal of nutrition 133 (11 Suppl 1): 3778S–3784S. PMID 14608114.

