Metabolismo do ferro humano

O metabolismo do ferro humano é o conxunto de reaccións químicas do noso corpo que manteñen a homeostase do ferro. O control desta substancia, imprescindible pero potencialmente tóxica, é unha parte importante do mantemento da saúde ou de enfermidades humanas. Na hematoloxía sempre houbo moito interese no metabolismo do ferro. Este é esencial para os glóbulos vermellos do sangue, os que conteñen a maior parte do ferro do corpo. A comprensión deste sistema é tamén importante para entender as enfermidades de sobrecarga de ferro, como a hemocromatose, e as deficiencias de ferro, como a anemia ferropénica.
Importancia da regulación do ferro[editar | editar a fonte]

O ferro é imprescindible para a maioría das formas de vida, porque as plantas, os animais e os microorganismos usan ferro na súa cadea respiratoria e noutras funcións. Pode encontrarse nunha ampla variedade de fontes de alimentos.
É esencial para a vida debido á súa infrecuente flexibilidade para servir tanto como doante de electróns coma de aceptor.
Porén, o ferro pode ser potencialmente tóxico. A súa capacidade de doar e aceptar electróns significa que se o ferro está libre dentro das células, pode catalizar a conversión do peróxido de hidróxeno en radicais libres. Estes poden danar moitas estruturas celulares e acabar matando a célula.
Para previr estes danos, todas as formas de vida úsano en forma de átomos de ferro unidos a proteínas. Isto permítelle ás células utilizar os beneficios do ferro, pero tamén limita a súa capacidade de causar danos.[1][2]
O grupo de proteínas que se unen ao ferro máis importantes son as que conteñen grupos hemo, os cales teñen ferro no seu centro. Os seres humanos e a maioría das bacterias utilizan variantes destas proteínas para levar a cabo as reaccións redox e os procesos de transporte electrónico. Estas reaccións e procesos son necesarios para que, como consecuencia deles, poida ter lugar a fosforilación oxidativa. Nela, a célula produce a maior parte da súa enerxía en forma de ATP, e sen ela a maioría das células non poderían vivir.
As proteínas de ferro-xofre son outro importante grupo de proteínas que conteñen ferro. Algunhas destas proteínas son tamén esenciais na cadea respiratoria, que permite a fosforilación oxidativa.
Os seres humanos tamén utilizan o ferro na proteína hemoglobina dos seus glóbulos vermellos para transportar o oxíxeno. Captan o o oxíxeno do aire nos pulmóns e consómeno nos tecidos e transportan gran parte do dióxido de carbono que estes liberan, levándoo de volta aos pulmóns. O ferro é tamén un compoñente esencial da mioglobina para almacenar e difundir o oxíxeno nas células musculares.
O corpo humano necesita ferro para transportar o oxíxeno que todas as células necesitan para sobrevivir. O corpo humano regula moi estreitamente a súa absorción dixestiva e a reciclaxe. É un elemento tan esencial para a vida humana que o corpo non ten un mecanismo fisiolóxico regulatorio específico para excretalo.
Os seres humanos normalmente impiden a sobrecarga de ferro no organismo regulando só a súa absorción. Quen non pode regular ben a absorción padece trastornos de sobrecarga de ferro. Nestas doenzas, a toxicidade do ferro empeza ao sobrepasarse a capacidade do corpo de almacenalo.[3]
Protección bacteriana[editar | editar a fonte]

En resposta a unha infección bacteriana, o sistema inmunitario inicia o proceso de retención do ferro. O ferro libre do plasma sanguíneo únese á proteína transferrina, o que fai máis difícil que as bacterias o poidan obter. Porén, as células do corpo poden conseguir facilmente ferro da transferrina.[4] Se as bacterias queren sobrevivir, entón deben obter ferro do seu medio. As bacterias que causan enfermidades fano de diversos xeitos. Liberan moléculas que se unen ao ferro chamadas sideróforos, que despois reabsorben para recoller o ferro, ou tómano da hemoglobina e transferrina.
Canto máis traballo lles dá obter o ferro, maior é o prezo metabólico. Iso significa que as bacterias privadas de ferro se reproducen máis lentamente. O control dos niveis de ferro parece ser unha importante defensa contra as infeccións bacterianas. As persoas cun incremento na súa cantidade de ferro, como as que padecen hemocromatose, son máis susceptibles ás infeccións bacterianas.[5]
Aínda que este mecanismo é unha resposta ás infeccións bacterianas a curto prazo, pode tamén causar problemas cando a inflamación é máis duradeira. Como o fígado produce hepcidina en resposta ás citocinas inflamatorias, os niveis de hepcidina poden incrementarse por inflamacións de orixe non bacteriana, como as infeccións virais, o cancro, as enfermidades autoinmunes ou outras enfermidades crónicas. Cando isto ocorre, o secuestro do ferro parece ser a principal causa da síndrome de anemia de enfermidade crónica, na cal non hai ferro dispoñible dabondo para producir a hemoglobina dos glóbulos vermellos.[1]
Almacéns de ferro no corpo[editar | editar a fonte]
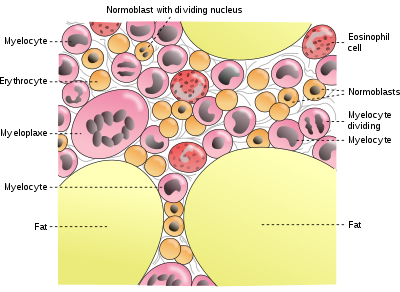
A maioría das persoas ben nutridas nos países industrializados teñen de 4 a 5 g de ferro no corpo. Deste, uns 2,5 g está contido na hemoglobina, necesaria para transportar oxíxeno a todo o corpo. Do resto, a maioría (uns 2 g nun home adulto e algo menos nas mulleres en idade fértil) está contido nos complexos de ferritina de todas as células, principalmente na medula ósea, o fígado e o bazo.
Os almacéns do fígado de ferritina son a fonte fisiolóxica principal da reserva de ferro corporal. As reservas de ferro en persoas adultas nos países industrializados tenden a ser menores en mulleres en idade fértil (e na idade infantil). As mulleres deben usar os seus almacéns de ferro para compensar as perdas debidas á menstruación, ao embarazo ou á lactación. Teñen reservas de ferro non hemoglobínico menores, de só 500 mg ou menos.
Do contido total do corpo, uns 400 mg débense ás proteínas celulares que usan o ferro para importantes procesos celulares, como o almacenamento de oxíxeno (mioglobina), ou para realizar as reaccións redox que servirán para producir enerxía (citocromos). Unha cantidade relativamente pequena (3–4 mg) circula polo plasma sanguíneo unido á transferrina.[6] Debido á súa toxicidade, o ferro libre soluble, os ións ferrosos solubles Fe(II), mantense no corpo en concentracións baixas.
A deficiencia de ferro afecta primeiro ás reservas de ferro do corpo. A diminución destas reservas crese que é relativamente non sintomática, aínda que se asociaron a ela algúns síntomas vagos e non específicos. Como cómpre tanto ferro para a hemoglobina, a anemia ferropénica é a principal manifestación da deficiencia de ferro. As persoas con esta deficiencia sufrirán ou morrerán por danos orgánicos antes de que as células esgoten o ferro necesario para procesos intracelulares como o transporte de electróns.
Os macrófagos do sistema reticuloendotelial almacenan ferro no seu proceso de degradación e procesamento da hemoglobina dos glóbulos vermellos que fagocitan.
O ferro almacénase tamén como un pigmento chamado hemosiderina nun proceso aparentemente patolóxico. Esta molécula parece ser principalmente o resultado de danos celulares. Encóntrase a miúdo dentro de macrófagos que a fagocitaron cando estaban limpando as rexións danadas. Pode encontrarse tamén na xente con sobrecarga de ferro debido á frecuente destrución de células sanguíneas e transfusións.
Captación de ferro polo corpo[editar | editar a fonte]
A maioría do ferro do corpo é acumulado e reciclado no sistema reticuloendotelial, que destrúe os glóbulos vermellos vellos. Porén, as persoas perden unha cantidade de ferro pequena pero constante, por perda de sangue gastrointestinal, suoración e pola descamación das células da pel e do recubrimento da mucosa gastrointestinal. A cantidade total da perda de ferro nunha persoa sa no mundo desenvolvido estímase nunha media de 1 mg por día nos homes e 1,5-2 mg nas mulleres con menstruacións regulares. As persoas con infeccións parasitarias gastrointestinais adoitan perder máis.[2] Esta perda constante significa que as persoas deben seguir absorbendo ferro. Fano mediante un proceso moi regulado que en circunstancias normais as protexe dunha sobrecarga de ferro.
Absorción do ferro da dieta[editar | editar a fonte]
A absorción do ferro da dieta é un proceso dinámico e variable. A cantidade de ferro absorbida comparada coa inxerida, normalmente baixa, pode estar entre o 5 e o 35% dependendo das circunstancias e do tipo da fonte de ferro.
A eficiencia coa cal se absorbe o ferro varía segundo a fonte. Xeralmente as formas que mellor se absorben son as de procedencia animal. A absorción do ferro da dieta en forma de sales, como as da maioría dos suplementos de ferro, varía segundo as necesidades corporais, xeralmente entre o 10 e o 20% do ferro inxerido. A absorción de ferro de produtos animais, e dalgúns produtos vexetais, faise en forma de ferro hémico. É máis eficiente, xa que permite unha absorción de entre o 15 e o 35% do ferro inxerido. O ferro hémico nos animais procede do sangue e de proteínas que conteñen o grupo hemo da carne ou das mitocondrias celulares. Nas plantas, o ferro hémico está presente nas mitocondrias de todas as células que fan respiración aerobia.
Igual que a maioría dos nutrientes minerais, a maior parte do ferro procedente da comida dixerida ou de suplementos absórbese no duodeno polos enterocitos do revestimento duodenal. Estas células teñen moléculas especiais que lles permiten pasar o ferro ao interior do corpo.
O ferro da dieta debe ser absorbido como parte dunha proteína, como as hemoproteínas, ou debe estar en forma ferrosa Fe2+. O encima redutase férrica Dcytb do bordo en cepillo de microvilosidades dos enterocitos reduce o ferro férrico Fe3+ a ferro ferroso Fe2+[7] Unha proteína chamada transportador de metal divalente 1 (DMT1), que transporta toda clase de metais divalentes ao interior do corpo, transporta despois o ferro a través da membrana plasmática do enterocito ao interior da célula.
Estas células do revestimento intestinal poden despois almacenar o ferro como ferritina, o cal se realiza pola unión do Fe3+ á apoferritina. Nese caso, o ferro acabará por saír do corpo coas feces cando a célula morra e se desprenda. A célula tamén pode pasalo ao interior do corpo mediante unha proteína de membrana chamada ferroportina.
O corpo regula os niveis de ferro con cada un destes pasos. Por exemplo, as células producen máis Dcytb, DMT1 e ferroportina en resposta á anemia ferropénica.[8]
A taxa de absorción de ferro no corpo humano parece responder a varios factores interdependentes: as reservas totais de ferro, a cantidade de novos glóbulos vermellos que está a producir a medula ósea, a concentración de hemoglobina no sangue e o nivel de oxíxeno no sangue. O corpo tamén absorbe menos ferro cando hai unha inflamación. Descubrimentos recentes indican que a regulación pola hepcidina da ferroportina é responsable da síndrome da anemia de enfermidade crónica.
Aínda que Dcytb é un encima exclusivo para o transporte de ferro a través do duodeno, a ferroportina distribúese por todo o corpo en todas as células que almacenan ferro. Así, a regulación da ferroportina é o principal modo do corpo para regular a cantidade de ferro en circulación.
A hefaestina, unha ferroxidase que pode oxidar Fe2+ a Fe3+ e se atopa maiormente no intestino delgado, colabora coa transferencia de ferro feita pola ferroportina a través da membrana basolateral das células intestinais.
A absorción de ferro da dieta mellora coa presenza de vitamina C e diminúe co exceso de calcio, cinc ou magnesio.[9]
Razóns da deficiencia de ferro[editar | editar a fonte]
A deficiencia de ferro real ou funcional pode ser resultado de varias causas, que se poden agrupar en varias categorías:
- Incremento da demanda de ferro que a dieta non pode suplir.
- Incremento da perda de ferro (xeralmente por perda de sangue).
- Deficiencia nutricional. Pode deberse á falta de ferro na dieta ou ao consumo de alimentos que inhiben a absorción deste, incluídos o calcio, os fitatos e os taninos.
- Incapacidade de absorber o ferro por danos no revestimento intestinal. Exemplos deste tipo de danos son os producidos por cirurxía do duodeno ou por doenzas como a enfermidade de Crohn ou a enfermidade celíaca, que reducen moito a área da superficie de absorción dispoñible.
- Inflamación que produce unha restrición inducida pola hepcidina da liberación de ferro nos enterocitos.
Sobrecarga de ferro[editar | editar a fonte]
O corpo pode reducir substancialmente a cantidade de ferro que absorbe a través da mucosa intestinal. Non parece que poida cortar por completo o proceso de transporte de ferro. Amais, en situacións en que o exceso de ferro dana o recubrimento intestinal (por exemplo, cando os nenos comen unha gran cantidade de tabletas de ferro para persoas adultas), mesmo pode entrar máis ferro na corrente sanguínea e causar unha síndrome potencialmente mortal de sobrecarga de ferro. Grandes cantidades de ferro libre na circulación causan danos a células fundamentais do fígado, corazón e outros órganos metabolicamente activos.
Prodúcese toxicidade do ferro cando a cantidade de ferro circulante excede a cantidade de transferrina dispoñible á que se pode unir. Porén, o corpo pode regular vigorosamente a súa captación de ferro. Así, a toxicidade do ferro derivada da inxestión é normalmente o resultado de circunstancias extraordinarias como o sobreconsumo de tabletas de suplementos de ferro [10] máis que de variacións na dieta. O tipo de toxicidade aguda debida á inxestión de ferro causa danos na mucosa gastrointestinal graves, entre outros problemas.
A toxicidade do ferro crónica é xeralmente resultado de síndromes de sobrecarga de ferro máis crónicas asociadas con enfermidades xenéricas, transfusións repetidas ou outras causas. En tales casos as reservas de ferro dos adultos poden chegar a 50 g, 10 veces o ferro total normal do corpo, ou máis. Entre os exemplos clásicos de sobrecarga de ferro xenética están a hemocromatose hereditaria (HH) e a hemocromatose xuvenil (JH), causada por mutacións no xene HFE2 (do regulador RGMc ou hemoxuvelina)[11], ou do xene HAMP, que codifica o péptido regulador do ferro hepcidina.
Captación do ferro polas células[editar | editar a fonte]
- Artigo principal: Proteína de unión ao elemento de resposta ao ferro.

Polo menos o 60% do ferro do corpo está localizado nas moléculas de hemoglobina dos glóbulos vermellos. A maior parte está almacenado na ferritina, principalmente no fígado, mais esta cantidade varía moito dunha persoa a outra.
Cando os glóbulos vermellos chegan a certa idade, son degradados e fagocitados por macrófagos limpadores especializados. Estas células internalizan a hemoglobina que contén o ferro e degrádana. O ferro únese ás moléculas de transferrina, que exportan os complexos de transferrina-ferro de novo ao sangue. A maioría do ferro utilizado para a produción de células sanguíneas procede deste ciclo de reciclaxe da hemoglobina.
Todas as células utilizan algo de ferro, o cal obteñen do sangue circulante. Como o ferro está fortemente unido á transferrina, as células de todo o corpo teñen na súa superficie receptores para os complexos ferro-transferrina. Estes receptores fagocitan e internalizan a proteína co ferro que leva unido por medio de endocitose mediada por receptor. Unha vez dentro, a célula transfire o ferro á ferritina, presente en todas as células, que serve de almacén intracelular de ferro.
Na deficiencia de ferro, increméntase a produción do receptor da transferrina e a produción de ferritina decrece.[12]
Regulación a nivel corporal e celular[editar | editar a fonte]
A regulación dos niveis de ferro é unha tarefa de todo o corpo, e de cada célula.[13]
Cando os niveis corporais de ferro están demasiado baixos, descende a hepcidina no plasma. Isto permite un incremento na actividade da ferroportina, estimulando a captación de ferro no aparato dixestivo. Cando hai un superávit de ferro, o fígado libera máis hepcidina, bloqueando así unha actividade adicional da ferroportina, o que como resultado produce unha menor captación de ferro.
Nas células, unha deficiencia de ferro causa a unión da proteína de unión ao elemento de resposta ao ferro (IRE-BP) aos elementos de resposta ao ferro (IRE) do ARNm dos receptores da transferrina, o que ten como resultado un incremento na produción de receptores de transferrina. Estes receptores incrementan a unión de transferrina ás células, e, por tanto, estimulan a captación de ferro. Cando hai pouco ferro, as IRE-BP actúan sobre o ARNm da ferritina, detendo a produción de máis ferritina; cando hai moito ferro o resultado é o contrario: prodúcese ferritina para que almacene o ferro. Como se ve, a acción das IRE-BP sobre os ARNm da ferritina e do receptor da transferrina ten efectos contrarios sobre a tradución dos seus respectivos ARNms.
Enfermidades da regulación do ferro[editar | editar a fonte]
- Artigo principal: Trastornos do metabolismo do ferro.
Non se coñecen os mecanismos exactos da maioría das formas de hemocromatose nos adultos, que supoñen a maioría dos trastornos xenéticos de sobrecarga de ferro. Identificáronse as mutacións xenéticas que causan varias das variantes adultas de hemocromatose, pero agora débense determinar as funcións normais deses xenes mutados.
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 Andrews NC (1999). "Disorders of iron metabolism". N. Engl. J. Med. 341 (26): 1986–95. PMID 10607817. doi:10.1056/NEJM199912233412607.
- ↑ 2,0 2,1 Conrad ME, Umbreit JN (2000). "Disorders of iron metabolism". N. Engl. J. Med. 342 (17): 1293–4. PMID 10787338. doi:10.1056/NEJM200004273421716.
- ↑ Schrier SL, Bacon BR (2011-11-07). "Iron overload syndromes other than hereditary hemochromatosis". UpToDate. Consultado o 2012-03-11.
- ↑ Berlim MT, Abeche AM (2001). "Evolutionary approach to medicine". South. Med. J. 94 (1): 26–32. PMID 11213938.
- ↑ Ganz T (2003). "Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation". Blood 102 (3): 783–8. PMID 12663437. doi:10.1182/blood-2003-03-0672.
- ↑ Camaschella C, Schrier SL (2011-11-07). "Regulation of iron balance". UpToDate. Consultado o 2012-03-11.
- ↑ McKie AT, Barrow D, Latunde-Dada GO; et al. (2001). "An iron-regulated ferric reductase associated with the absorption of dietary iron". Science 291 (5509): 1755–9. doi:10.1126/science.1057206. PMID 11230685.
- ↑ Fleming RE, Bacon BR (2005). "Orchestration of iron homeostasis". N. Engl. J. Med. 352 (17): 1741–4. PMID 15858181. doi:10.1056/NEJMp048363.
- ↑ "Iron". Ohio State University Extension Fact Sheet. Ohio State University. Arquivado dende o orixinal o 16 de xuño de 2012. Consultado o 25 de xuño de 2012.
- ↑ Rudolph CD (2003). Rudolph's pediatrics. New York: McGraw-Hill, Medical Pub. Division. ISBN 0-07-112457-8.
- ↑ Severyn CJ, Shinde U, Rotwein P (2009). "Molecular biology, genetics and biochemistry of the repulsive guidance molecule family". Biochem. J. 422 (3): 393–403. PMID 19698085. doi:10.1042/BJ20090978.
- ↑ Stryer L, Berg JM, Tymoczko JL (2002). Biochemistry. San Francisco: W.H. Freeman. ISBN 0-7167-4684-0.
- ↑ Regulation of cellular iron metabolism,Biochem J. 15 de marzo de 2011; 434(Pt 3): 365–381. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3048577/
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Andrews, Simon; Norton, Ian; Salunkhe, Arvindkumar S.; Goodluck, Helen; Aly, Wafaa S.M.; Mourad-Agha, Hanna; Cornelis, Pierre (2013). "Chapter 7, Control of Iron Metabolism in Bacteria". En Banci, Lucia (Ed.). Metallomics and the Cell. Metal Ions in Life Sciences 12. Springer. ISBN 978-94-007-5560-4. doi:10.1007/978-94-007-5561-1_7.
- Andrews NC (2004). "Anemia of inflammation: the cytokine-hepcidin link". J. Clin. Invest. 113 (9): 1251–3. PMC 398435. PMID 15124013. doi:10.1172/JCI21441.
- Camaschella C (2005). "Understanding iron homeostasis through genetic analysis of hemochromatosis and related disorders". Blood 106 (12): 3710–7. PMID 16030190. doi:10.1182/blood-2005-05-1857.
- Frazer DM, Anderson GJ (2005). "Iron imports. I. Intestinal iron absorption and its regulation". Am. J. Physiol. Gastrointest. Liver Physiol. 289 (4): G631–5. PMID 16160078. doi:10.1152/ajpgi.00220.2005.
- Insel P, Ross D, McMahon K, Bernstein M (2011). "Iron". Nutrition (4th ed.). Sudbury, Massachusetts: Jones and Bartlett Publishers. pp. 510–514. ISBN 978-0-7637-7663-3. Consultado o 25 de xuño de 2012. See esp. pp. 513-514
- Lammi-Keef CJ, Couch SC, Philipson EH, ed. (2008). "Dietary diversification and modification of iron". Handbook of Nutrition and Pregnancy. Nutrition & Health. Totowa, New Jersey: Humana Press. pp. 350–351. ISBN 978-1-59745-112-3. doi:10.1007/978-1-59745-112-3. Consultado o 35 de xuño de 2012.
- Panel on Micronutrients; Subcommittees on Upper Reference Levels of Nutrients and of Interpretation and Uses of Dietary Reference Intakes; the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes (2001). "Iron". Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, D.C: Food and Nutrition Board, Institute of Medicine. pp. 290–393. ISBN 978-0-309-07279-3. Consultado o 25 de xuño de 2012.
- Reilly C (2004). "Iron". The Nutritional Trace Metals. Oxford, UK & Ames, Iowa: Blackwell Publishing. pp. 35–81. ISBN 1-4051-1040-6. Consultado o 25 de xuño de 2012.
