Glicosilación química
- Ver tamén glicosilación e glicación.
Unha reacción de glicosilación química implica o acoplamento dun doante de glicosilo a un aceptor de glicosilo formando un glicósido.[1][2][3] Se tanto o doante coma o aceptor son azucres, entón o produto é un oligosacárido. A reacción require a activación cun reactivo activador axeitado. As reaccións adoitan resultar nunha mestura de produtos debido á creación dun novo centro estereoxénico na posición anomérica do doante de glicosilo. A formación dun enlace glicosídico permite a síntese de polisacáridos complexos, os cales poden desempeñar importantes papeis en procesos biolóxicos e na patoxénese e, por tanto, ter análogos sintéticos destas moléculas posibilita facer maiores estudos sobre a súa importancia biolóxica.
Terminoloxía[editar | editar a fonte]
A reacción de glicosilación implica o acoplamento dun doante de glicosilo e un aceptor de glicosilo por medio dunha iniciación que usa un activador baixo condicións de reacción axeitadas.
- Un doante de glicosilo é un azucre cun adecuado grupo saínte na posición anomérica. Este grupo, baixo as condicións de reacción, é activado e por medio da formación dun oxocarbenio é eliminado deixando un carbono anomérico electrofílico.
- Un aceptor de glicosilo é un azucre cun grupo hidroxilo nucleófilo non protexido, o cal pode atacar o carbono do ión oxocarbenio formado durante a reacción e permite a formación do enlace glicosídico.
Un activador é comunmente un ácido de Lewis, que permite que o grupo saínte nunha posición anomérica sae e resulta na formación do ión oxocarbenio.
Estereoquímica[editar | editar a fonte]
O establecemento do enlace glicosídico ten como resultado a formación dun novo centro estereoxénico e, por tanto, pode esperarse que se orixine unha mestura de produtos. O enlace formado pode ser axial ou ecuatorial (α ou β con respecto á glicosa). Para comprender mellor isto, debe considerarse como é o mecanismo dunha reacción de glicosilación.

Participación do grupo veciño[editar | editar a fonte]
O resultado estereoquímico dunha reacción de glicosilación pode en certos casos ser afectada polo tipo de grupo protexido empregado na posición 2 do doante glicosilo. Un grupo participante, tipicamente un que teña un grupo carboxilo, orixinará predominantemente un β-glicósido. Mentres que un grupo non participante, que xeralmente non ten un grupo carboxilo, a miúdo resultará nun α-glicósido.
Na ilustración seguinte pode verse que ter un grupo protector acetilo na posición 2 permite a formación dun ión acetoxonio intermediario que bloquea o ataque na cara inferior do anel, o que permite a formación predominante do β-glicósido.
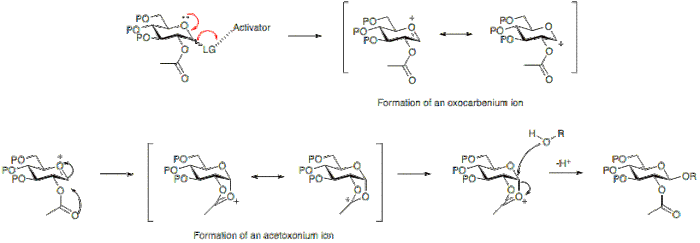
Alternativamente, a ausencia dun grupo participante na posición 2, permite o ataque desde a cara inferior ou a superior. Como o produto α-glicósido será favorecido polo efecto anomérico, predomina o α-glicósido.

Grupos protectores[editar | editar a fonte]
Diferentes grupos protectores do doante glicosilo ou do aceptor glicosilo pode afectar á reactividade e rendemento da reacción de glicosilación. Tipicamente, os grupos que retiran electróns, como os grupos acetilo e benzoilo diminúen a reactividade do doante/aceptor e son, por tanto, denominados grupos "desarmantes". Os grupos doantes de electróns como o grupo benzoilo, incrementan a reactividade do doante/aceptor e son, por tanto, denominados grupos "armantes".
Métodos actuais de síntese de glicósidos[editar | editar a fonte]
Glicosil ioduros[editar | editar a fonte]
Os glicosil ioduros foron introducidos por primeira vez nas reaccións de glicosilación en 1901 por Koenigs e Knorr,[4][5] aínda que adoitaban considerarse demasiado reactivos para o uso sintético. Recentemente varios grupos de investigación mostraron que estes doantes teñen propiedades reactivas únicas e pode diferir doutros glicosil cloruros ou bromuros con respecto ao tempo de reacción, eficiencia, e estereoquímica.[6][7][8][9] Os glicosil ioduros poden ser producidos en diversas condicións; un método notable é a reacción dun 1-O-acetilpiranósido cun TMSI.[10]

Os doantes de ioduro poden tipicamente ser activados en condicións básicas para dar β-glicósidos con boa selectividade. O uso de sales de ioduro de tetraalquilamonio, como o ioduro de tetrabutilamonio (TBAI) permite a anomerización in situ do α-glicosil haluro ao β-glicosil haluro e proporciona o α-glicósido con boa selectividade.[11][12][13][14]

Tioglicósidos[editar | editar a fonte]
O primeiro que inflormou dos tioglicósidos foi Hermann Emil Fischer en 1909[15] e desde entón foron explorados constantemente, desenvolvéndose numerosos protocolos para a súa preparación. A vantaxe de usar tioglicósidos é a súa estabilidade baixo unha ampla gama de condicións de reacción, o que permite as maniplacións de grupos protectores. Ademais, os tioglicósidos actúan como grupos protectores temporais na posición anomérica, que permiten que os tioglicósidos sexan útiles como doantes ou como aceptores de glicosilos.[11] Os tioglicósidos prepáranse usualmente facendo reaccionar azucres per-acetilados con BF3•OEt2 e o tiol apropiado.[16][17][18]
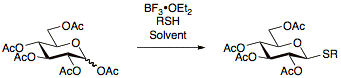
Os tioglicósidos usados en reaccións de glicosilación como doantes poden ser activados baixo un amplo rango de condicións, moi notablemente usando NIS/AgOTf.[19]

Tricloroacetimidatos[editar | editar a fonte]
Os tricloroacetimidatos foron introducidos e explorados primeiramente por Schmidt en 1980[20][21] e desde entón fixéronse moi populares para a síntese de glicósidos. O uso de tricloroacetimidatos proporciona moitas vantaxes incluíndo unha fácil formación, reactividade e resultado estereoquímico.[11] Os O-glicosil tricloroacetimidatos son preparados por adición de tricloroacetonitrilo (Cl3CCN) baixo condicións básicas a un grupo hidroxilo anomérico libre.

Os grupos activadores típicos para as reaccións de glicosilación que usan tricloroacetimidatos son BF3•OEt2 ou TMSOTf.[22]

Produtos sintéticos notables[editar | editar a fonte]
Velaquí algúns exemplos dalgunhas dianas notables obtidas por medio dunha serie de reaccións de glicosilación.


Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Marco Brito-Arias, Síntesis and Characterization of Glycosides, second edition, Editorial Springer 2016.
Notas[editar | editar a fonte]
- ↑ Boons, Geert-Jan; Karl J. Hale (2000). Organic synthesis with carbohydrates. Blackwell Publishing. ISBN 978-1-85075-913-3.
- ↑ Crich, D.; Lim, L. Org. React. 2004, 64, 115. doi 10.1002/0471264180.or064.02
- ↑ Bufali, S.; Seeberger, P. Org. React. 2006, 68, 303. doi 10.1002/0471264180.or064.02
- ↑ Wilhelm Koenigs e Edward Knorr (1901). "Ueber einige Derivate des Traubenzuckers und der Galactose (p )". Berichte der deutschen chemischen Gesellschaft 34 (1): 957–981. doi:10.1002/cber.190103401162.
- ↑ Fischer, E. Ber. Dtsch. Chem. Ges. 1893, 26, 2400–2412
- ↑ Gervay, J., Hadd, M. J., J. Org. Chem. 1997, 62, 6961 – 6967.
- ↑ Hadd, M. J., Gervay, J. Carbohydr. Res. 1999, 320, 61 – 69.
- ↑ Miquel, N., Vignando, S., Russo, G., Lay, L. Synlett 2004, 2, 341 – 343.
- ↑ van Well, R. M., Kartha, K. P. R., Field, R. A. J. Carbohydr. Chem. 2005, 24, 463 – 474.
- ↑ Gervay, J., Nguyen, T. N., Hadd, M. J. Carbohydr. Res. 1997, 300, 119 – 125.
- ↑ 11,0 11,1 11,2 Zhu, X. M., Schmidt, R. R. Angew. Chem. Int. Ed. 2009, 48, 1900 - 1934.
- ↑ Lam, S. N., Gervay-Hague, J. Org. Lett. 2003, 5, 4219 – 4222.
- ↑ Du, W., Gervay-Hague, J. Org. Lett. 2005, 7, 2063–2065.
- ↑ Du, W., Kulkarni, S. S., Gervay-Hague, J. Chem. Commun. 2007, 2336–2338.
- ↑ Fischer, E., Delbrück, K. Ber. Dtsch. Chem. Ges. 1909, 42, 1476–1482.
- ↑ Tai, C. A., Kulkarni, S. S., Hung, S. C. J. Org.Chem. 2003, 68, 8719 – 8722
- ↑ Agnihotri, G., Tiwari, P., Misra, A. K. Carbohydr. Res. 2005, 340, 1393–1396
- ↑ Hase-gawa, J. Y., Hamada, M., Miyamoto, T., Nishide, K., Kajimoto, T., Uenishi, J. I., Node, M. Carbohydr. Res. 2005, 340, 2360–2368.
- ↑ Veeneman, G. H., van Leeuwen, S. H., van Boom, J. H. Tetrahedron Lett. 1990, 31, 1331–1334.
- ↑ Schmidt, R. R., Michel, J. Angew. Chem. 1980, 92, 763 – 764.
- ↑ Schmidt, R. R., Michel, J. Angew. Chem. Int. Ed. Engl. 1980, 19, 731 – 732.
- ↑ Kale, R. R., McGannon, C. M., Fuller-Schaefer, C., Hatch, D. M., Flagler, M. J., Gamage, S. D., Weiss, A. A., Iyer, S. S. Angew. Chem. Int. Ed. 2008, 47, 1265 - 1268.
- ↑ Joe, M., Bai, Y., Nacario, R. C., Lowary, T. L. J. Am. Chem. Soc. 2007, 129, 9885 - 9901.
- ↑ Wu, X. Y., Bundle, D. R. J. Org. Chem. 2005, 70, 7381 - 7388.
