Anticorpo de dominio simple

O bucle CDR3 estendido está coloreado de laranxa.
Un anticorpo de dominio simple, (abreviado sdAb, do inglés single-domain antibody), tamén chamado polo seu desenvolvedor Ablynx co nome Nanobody (nanocorpo),[1] é un fragmento de anticorpo que consta dun só dominio de anticorpo variable monomérico. Igual que os anticorpos completos, poden unirse selectivamente a un antíxeno específico. Teñen un peso molecular de só 12–15 kDa, polo que son moito máis pequenos que os anticorpos comúns (que pesan 150–160 kDa), e están compostos por dúas cadeas pesadas de inmunoglobulinas e dúas cadeas lixeiras, e incluso son máis pequenos que os fragmentos Fab (~50 kDa, unha cadea lixeira e media cadea pesada) e que os fragmentos variables de cadea simple (~25 kDa, dous dominios variables, un da cadea lixeira e outro da variable).[2]
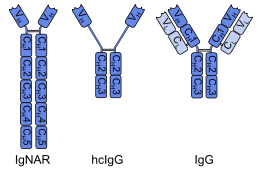
Os anticorpos de dominio simple foron producidos por enxeñaría a partir de anticorpos de cadea pesada encontrados en camélidos; estes anticorpos de dominio simple denomínanse fragmentos VHH. Os peixes cartilaxinosos tamén teñen anticorpos de cadea pesada (os IgNAR, inmunoglobulinas con novo receptor de antíxeno), a partir dos cales poden obterse anticorpos de cadea simple chamados fragmentos VNAR. Unha estratexia alternativa é dividir os dominios variables diméricos de inmunoglobulina G (IgG) común de humanos e ratos formando monómeros. Aínda que a maioría das investigacións en anticorpos de dominio simple están actualmente baseadas nos dominios variables de cadea pesada, tamén se observou que os nanocorpos derivados de cadeas lixeiras se unen especificamente aos epítopos diana.[3]
Os anticorpos de dominio simple de camélidos son tan específicos coma os anticorpos comúns e nalgúns casos son máis robustos. Ademais, son doadamente illables usando o mesmo procedemento de cribado de fagos (phage panning) utilizado para os anticorpos tradicionais, que permite cultivalos in vitro en grandes concentracións. O tamaño menor e o seu único dominio fan que estes anticorpos sexan máis fáciles de transformar en células bacterianas para a súa produción en masa, polo que son ideais para propósitos de investigación.[4]
Os anticorpos de cadea simple están sendo investigados para utilizalos en múltiples aplicacións farmacéuticas e teñen un uso potencial no tratamento da síndrome coronaria aguda, cancro e enfermidade de Alzheimer.[5][6]
Propiedades[editar | editar a fonte]
Un anticorpo de dominio simple é unha cadea peptídica duns 110 aminoácidos de longo, que consta dun dominio variable (VH) de cadea pesada de anticorpo, ou dunha IgG común. Estes péptidos teñen unha afinidade similar a antíxenos que a dos anticorpos completos, pero son máis resistentes á calor e estables ante os deterxentes e altas concentracións de urea. Os que derivan de anticorpos de camélidos e peixes son menos lipófilos e máis hidrosolubles, debido ás súas rexións determinantes de complementariedade 3 (CDR3), que forman un bucle estendido (coloreado en laranxa no diagrama de fitas de arriba) que cobre o sitio lipófilo que normalmente se une a unha cadea lixeira.[7][8] Nun estudo feito en 1999, a diferenza dos anticorpos comúns, dous de cada seis anticorpos de dominio simple sobreviviron á temperatura de 90 °C sen perderen a súa capacidade de unirse a antíxenos.[9] A estabilidade ante o ácido gástrico e as proteases depende da súa secuencia de aminoácidos. Algunhas especies están activas no intestino despois da aplicación oral,[10][11] pero a súa baixa absorción no intestino impide o desenvolvemento de anticorpos de dominio simple administrados oralmente e sistemicamente activos.
A masa molecular comparativamente baixa fai que teñan unha mellor permeabilidade nos tecidos, e unha curta vida media no plasma, xa que son eliminados nos riles.[2] A diferenza dos anticorpos completos, non orixinan citotoxicidade desencadeada polo sistema do complemento porque carecen de rexión Fc. Os sdAbs derivados de camélidos e peixes poden unirse a antíxenos ocultos que non son accesibles para os anticorpos completos, por exemplo os sitios activos de encimas. Esta propiedade depende do seu bucle CDR3 estendido, que pode penetrar neses sitios.[8][12]
Produción[editar | editar a fonte]
A partir de anticorpos de cadea pesada[editar | editar a fonte]
Un anticorpo de dominio simple pode obterse por inmunización de dromedarios, camelos, llamas, alpacas ou tiburóns co antíxeno desexado e posterior illamento do ARNm que codifica os anticorpos de cadea pesada. Por medio de transcrición inversa e reacción en cadea da polimerase, pode xerarse unha biblioteca de anticorpos de dominio simple que conteña varios millóns de clons. As técnicas de exame como o phage display e ribosome display axudan a identificar os clons que se unen ao antíxeno.[13]
Un método diferente usa bibliotecas de xenes procedentes de animais que non foron previamente inmunizados. Tales bibliotecas conteñen xeralmente só anticorpos con baixa afinidade polo antíxeno desexado, o que fai innecesario aplicar a maduración de afinidade por mutaxénese aleatoria como paso adicional.[14]
Cando se identifican os clons máis potentes, a súa secuencia de ADN é optimizada, por exemplo para mellorar a súa estabilidade ante os encimas. Outro obxectivo é a humanización para impedir as reaccións inmunolóxicas do organismo humano contra o anticorpo. A humanización non é problemática debido á homoloxía entre os fragmentos VHH de camélidos e humanos.[14] O paso final é a tradución do anticorpo de dominio simple optimizado en E. coli, Saccharomyces cerevisiae ou outros organismos axeitados.
A partir de anticorpos convencionais[editar | editar a fonte]
Alternativamente, os anticorpos de dominio simple poden producirse a partir de IgG comúns murinas ou humanas de catro cadeas.[15] O proceso é similar, e comprende a creación de bibliotecas de xenes a partir de doantes inmunizados ou virxes e técnicas de display para a identificación dos antíxenos máis específricos. Un problema con esta estratexia é que a rexión de unión das IgG comúns consta de dous dominios (VH e VL), que tenden a dimerizarse ou agregarse debido á súa lipofilia. A monomerización realízase xeralmente substituíndo aminoácidos lipófilos por hidrófilos, pero con frecuencia isto ten como resultado a perda de afinidade do antíxeno.[16] Se se pode reter a afinidade, os anticorpos de dominio simple poden igualmente producirse en E. coli, S. cerevisiae ou outros organismos.
A partir de anticorpos de dominio simple humanos formados por enxeñaría[editar | editar a fonte]
Os dominios VH simples humanos poden illarse a partir de bibliotecas de dominios de anticorpos producidas por enxeñaría por phage display. Os anticorpos de dominio simple humanos que se une a mesotelina[17], GPC2[18] e GPC3[19][20] foron desenvolvidos e comprobados nos formatos de inmunotoxinas e células T de receptor de antíxeno quimérico (CAR).
Aplicacións potenciais[editar | editar a fonte]
Os anticorpos de dominio simple teñen unha ampla gama de aplicacións en biotecnoloxía e terapéuticas debido ao seu pequeno tamaño, produción simple e alta afinidade.[21]
Biotecnolóxicas e diagnósticas[editar | editar a fonte]
A fusión dunha proteína fluorescente a un nanocorpo xera o denominado cromocorpo. Os cromocorpos poden utilizarse para recoñecer e trazar dianas en diferentes compartimentos de células vivas. Poden, por tanto, incrementarse as posibilidades da microscopia de células vivas e de facer novos estudos funcionais.[22] O acoplamento dun nanocorpo anti-GFP a unha matriz monovalente, chamado nanotrampa-GFP, permite o illamento de proteínas de fusión-GFP e as moléculas que interaccionan con ela para ulteriores análises bioquímicas.[23] A localización dunha soa molécula con técnicas de imaxe de super-resolución require a entrega específica de fluoróforos en estreita proximidade a unha proteína diana. Debido aos seus grandes tamaños, o uso de anticorpos normais acoplados a tinguiduras orgánicas poden a miúdo orixinar un sinal confuso debido á distancia entre o fluoróforo e a proteína diana. A fusión de tinguiduras orgánicas a nanocorpos anti-GFP que teñen como diana proteínas etiquetadas con GFP permite conseguir unha resolución espacial nanométrica e un erro mínimo de ligamento debido ao pequeno tamaño e alta afinidade.[24] Para incrementar a probabilidade de cristalización dunha molécula diana, os nanocorpos poden ser utilizados como chaperonas de cristalización. Como proteínas auxiliares, poden reducir a heteroxeneidade conformacional ao unirse e estabilizarse nun subconxunto de determinados estados conformacionais. Tamén poden enmascarar superficies interferindo coa cristalización cando as rexións estendidas que forman o cristal toman contacto.[25]
En aplicacións de biosensores para o diagnóstico os nanocorpos poden utilizarse prospectivamente como ferramenta. Dado o seu pequeno tamaño, poden ser acoplados máis densamente na superficie do biosensor. Ademais das súas vantaxes para unirse a epítopos menos accesibles, a súa estabilidade conformacional tamén causa unha maior resistencia ás condicións de rexeneración de superficies. Despois de inmobilizar os anticorpos de dominio simple sobre as superficies sensoras que detectan o antíxeno prostático específico humano (hPSA), a presenza deste pode ser comprobada. Os nanocorpos son superiores aos anticorpos clásicos na detección de concentracións clinicamente significativas de hPSA.[26]
Terapéuticas[editar | editar a fonte]
Os anticorpos de dominio simple foron probados como unha posible nova ferramenta terapéutica contra múltiples dianas. En ratos infectados polo virus da gripe A subtipo H5N1, os nanocorpos dirixidos contra a hemaglutinina suprimían a replicación do virus H5N1 in vivo e reducían a morbilidade e mortalidade.[27] Os nanocorpos que se dirixen contra o dominio de unión ao receptor celular dos factores de virulencia toxina A e toxina B de Clostridium difficile neutralizan os efectos citopáticos en fibroblastos in vitro.[28]

Desenvolvéronse anticorpos de cadea simple dispoñibles por vía oral contra E. coli, que inducen diarrea en bacoriños e foron comprobados exitosamente.[11] Outras doenzas do tracto gastrointestinal, como a enfermidade inflamatoria intestinal e o cancro de colon, son tamén posibles dianas para os anticorpos de dominio simple oralmente dispoñibles.[29]
As especies estables aos deterxentes que teñen como diana a proteína de superficie do fungo Malassezia furfur foron producidas por enxeñaría para o seu uso en xampús contra a caspa.[7]
No marco dunha estratexia para a terapia fototérmica os nanocorpos que se unen ao antíxeno HER2, que se sobreexpresan nas células de cancro de mama e de ovario, foron conxugados a nanopartículas de ouro (ver figura). As células tumorais foron destruídas fototermicamente usando un láser no decurso dun experimento.[30]
ALX-0081 é un anticorpo de dominio simple que ten como diana o factor de von Willebrand, que está en ensaios clínicos para a prevención da trombose en pacientes de síndrome coronaria aguda.[31] Un estudo en fase II que examinaba o ALX-0081 en intervencións coronarias percutáneas de alto risco comezou en setembro de 2009.[32]
Ablynx espera que os seus nanocorpos poidan cruzar a barreira hematoencefálica e permear grandes tumores sólidos máis doadamente que os anticorpos completos, o cal permitiría o desenvolvemento de novos fármacos contra os cancros de cerebro.[29]
Notas[editar | editar a fonte]
- ↑ Gibbs, W. Wayt (August 2005). "Nanobodies". Scientific American. Arquivado dende o orixinal o 10 de outubro de 2007. Consultado o 04 de abril de 2018.
- ↑ 2,0 2,1 Harmsen MM, De Haard HJ (November 2007). "Properties, production, and applications of camelid single-domain antibody fragments". Applied Microbiology and Biotechnology 77 (1): 13–22. PMC 2039825. PMID 17704915. doi:10.1007/s00253-007-1142-2.
- ↑ Möller A, Pion E, Narayan V, Ball KL (December 2010). "Intracellular activation of interferon regulatory factor-1 by nanobodies to the multifunctional (Mf1) domain". The Journal of Biological Chemistry 285 (49): 38348–61. PMC 2992268. PMID 20817723. doi:10.1074/jbc.M110.149476.
- ↑ Ghannam A, Kumari S, Muyldermans S, Abbady AQ (2015). "Camelid nanobodies with high affinity for broad bean mottle virus: a possible promising tool to immunomodulate plant resistance against viruses". Plant Molecular Biology 87 (4-5): 355–69. PMID 25648551. doi:10.1007/s11103-015-0282-5.
- ↑ "Nanobodies herald a new era in cancer therapy". The Medical News. 12 May 2004.
- ↑ "Pipeline". Ablynx. Arquivado dende o orixinal o 04 de xaneiro de 2010. Consultado o 20 January 2010.
- ↑ 7,0 7,1 Dolk E, van der Vaart M, Lutje Hulsik D, Vriend G, de Haard H, Spinelli S, Cambillau C, Frenken L, Verrips T (January 2005). "Isolation of llama antibody fragments for prevention of dandruff by phage display in shampoo". Applied and Environmental Microbiology 71 (1): 442–50. PMC 544197. PMID 15640220. doi:10.1128/AEM.71.1.442-450.2005.
- ↑ 8,0 8,1 Stanfield RL, Dooley H, Flajnik MF, Wilson IA (September 2004). "Crystal structure of a shark single-domain antibody V region in complex with lysozyme". Science 305 (5691): 1770–3. Bibcode:2004Sci...305.1770S. PMID 15319492. doi:10.1126/science.1101148.
- ↑ van der Linden RH, Frenken LG, de Geus B, Harmsen MM, Ruuls RC, Stok W, de Ron L, Wilson S, Davis P, Verrips CT (April 1999). "Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonal antibodies". Biochimica et Biophysica Acta 1431 (1): 37–46. PMID 10209277. doi:10.1016/S0167-4838(99)00030-8.
- ↑ Harmsen MM, van Solt CB, Hoogendoorn A, van Zijderveld FG, Niewold TA, van der Meulen J (November 2005). "Escherichia coli F4 fimbriae specific llama single-domain antibody fragments effectively inhibit bacterial adhesion in vitro but poorly protect against diarrhoea". Veterinary Microbiology 111 (1–2): 89–98. PMID 16221532. doi:10.1016/j.vetmic.2005.09.005.
- ↑ 11,0 11,1 Harmsen MM, van Solt CB, van Zijderveld-van Bemmel AM, Niewold TA, van Zijderveld FG (September 2006). "Selection and optimization of proteolytically stable llama single-domain antibody fragments for oral immunotherapy". Applied Microbiology and Biotechnology 72 (3): 544–51. PMID 16450109. doi:10.1007/s00253-005-0300-7.
- ↑ Desmyter A, Transue TR, Ghahroudi MA, Thi MH, Poortmans F, Hamers R, Muyldermans S, Wyns L (September 1996). "Crystal structure of a camel single-domain VH antibody fragment in complex with lysozyme". Nature Structural Biology 3 (9): 803–11. PMID 8784355. doi:10.1038/nsb0996-803.
- ↑ Arbabi Ghahroudi M, Desmyter A, Wyns L, Hamers R, Muyldermans S (September 1997). "Selection and identification of single domain antibody fragments from camel heavy-chain antibodies". FEBS Letters 414 (3): 521–6. PMID 9323027. doi:10.1016/S0014-5793(97)01062-4.
- ↑ 14,0 14,1 Saerens D, Ghassabeh GH, Muyldermans S (October 2008). "Single-domain antibodies as building blocks for novel therapeutics". Current Opinion in Pharmacology 8 (5): 600–8. PMID 18691671. doi:10.1016/j.coph.2008.07.006.
- ↑ Holt LJ, Herring C, Jespers LS, Woolven BP, Tomlinson IM (November 2003). "Domain antibodies: proteins for therapy". Trends in Biotechnology 21 (11): 484–90. PMID 14573361. doi:10.1016/j.tibtech.2003.08.007.
- ↑ Borrebaeck CA, Ohlin M (December 2002). "Antibody evolution beyond Nature". Nature Biotechnology 20 (12): 1189–90. PMID 12454662. doi:10.1038/nbt1202-1189.
- ↑ Tang Z, Feng M, Gao W, Phung Y, Chen W, Chaudhary A, St Croix B, Qian M, Dimitrov DS, Ho M (April 2013). "A human single-domain antibody elicits potent antitumor activity by targeting an epitope in mesothelin close to the cancer cell surface". Molecular Cancer Therapeutics 12 (4): 416–26. PMC 3624043. PMID 23371858. doi:10.1158/1535-7163.MCT-12-0731.
- ↑ Li N, Fu H, Hewitt SM, Dimitrov DS, Ho M (August 2017). "Therapeutically targeting glypican-2 via single-domain antibody-based chimeric antigen receptors and immunotoxins in neuroblastoma". Proceedings of the National Academy of Sciences of the United States of America 114 (32): E6623–E6631. PMC 5559039. PMID 28739923. doi:10.1073/pnas.1706055114.
- ↑ Feng M, Gao W, Wang R, Chen W, Man YG, Figg WD, Wang XW, Dimitrov DS, Ho M (March 2013). "Therapeutically targeting glypican-3 via a conformation-specific single-domain antibody in hepatocellular carcinoma". Proceedings of the National Academy of Sciences of the United States of America 110 (12): E1083–91. PMC 3607002. PMID 23471984. doi:10.1073/pnas.1217868110.
- ↑ Gao W, Tang Z, Zhang YF, Feng M, Qian M, Dimitrov DS, Ho M (March 2015). "Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis". Nature Communications 6: 6536. PMC 4357278. PMID 25758784. doi:10.1038/ncomms7536.
- ↑ Muyldermans S (2013). "Nanobodies: natural single-domain antibodies". Annual Review of Biochemistry 82: 775–97. PMID 23495938. doi:10.1146/annurev-biochem-063011-092449.
- ↑ Rothbauer U, Zolghadr K, Tillib S, Nowak D, Schermelleh L, Gahl A, Backmann N, Conrath K, Muyldermans S, Cardoso MC, Leonhardt H (November 2006). "Targeting and tracing antigens in live cells with fluorescent nanobodies". Nature Methods 3 (11): 887–9. PMID 17060912. doi:10.1038/nmeth953.
- ↑ Rothbauer U, Zolghadr K, Muyldermans S, Schepers A, Cardoso MC, Leonhardt H (February 2008). "A versatile nanotrap for biochemical and functional studies with fluorescent fusion proteins". Molecular & Cellular Proteomics 7 (2): 282–9. PMID 17951627. doi:10.1074/mcp.M700342-MCP200.
- ↑ Ries J, Kaplan C, Platonova E, Eghlidi H, Ewers H (June 2012). "A simple, versatile method for GFP-based super-resolution microscopy via nanobodies". Nature Methods 9 (6): 582–4. PMID 22543348. doi:10.1038/nmeth.1991.
- ↑ Koide S (August 2009). "Engineering of recombinant crystallization chaperones". Current Opinion in Structural Biology 19 (4): 449–57. PMC 2736338. PMID 19477632. doi:10.1016/j.sbi.2009.04.008.
- ↑ Saerens D, Frederix F, Reekmans G, Conrath K, Jans K, Brys L, Huang L, Bosmans E, Maes G, Borghs G, Muyldermans S (December 2005). "Engineering camel single-domain antibodies and immobilization chemistry for human prostate-specific antigen sensing". Analytical Chemistry 77 (23): 7547–55. PMID 16316161. doi:10.1021/ac051092j.
- ↑ Ibañez LI, De Filette M, Hultberg A, Verrips T, Temperton N, Weiss RA, Vandevelde W, Schepens B, Vanlandschoot P, Saelens X (April 2011). "Nanobodies with in vitro neutralizing activity protect mice against H5N1 influenza virus infection". The Journal of Infectious Diseases 203 (8): 1063–72. PMID 21450996. doi:10.1093/infdis/jiq168.
- ↑ Hussack G, Arbabi-Ghahroudi M, van Faassen H, Songer JG, Ng KK, MacKenzie R, Tanha J (March 2011). "Neutralization of Clostridium difficile toxin A with single-domain antibodies targeting the cell receptor binding domain". The Journal of Biological Chemistry 286 (11): 8961–76. PMC 3058971. PMID 21216961. doi:10.1074/jbc.M110.198754.
- ↑ 29,0 29,1 "Nanobodies". Nanobody.org. 2006.
- ↑ Van de Broek B, Devoogdt N, D'Hollander A, Gijs HL, Jans K, Lagae L, Muyldermans S, Maes G, Borghs G (June 2011). "Specific cell targeting with nanobody conjugated branched gold nanoparticles for photothermal therapy". ACS Nano 5 (6): 4319–28. PMID 21609027. doi:10.1021/nn1023363.
- ↑ "Ablynx Announces Interim Results of First Nanobody Phase I Study of,ALX-0081 (ANTI-VWF)". Bio-Medicine.org. 2 July 2007. Arquivado dende o orixinal o 16 de febreiro de 2021. Consultado o 04 de abril de 2018.
- ↑ Clinical trial number NCT01020383 for "Comparative Study of ALX-0081 Versus GPIIb/IIIa Inhibitor in High Risk Percutaneous Coronary Intervention (PCI) Patients" at ClinicalTrials.gov
