Factor XIII

| |
| PDB: 1EVU | |
| Identificadores | |
| Símbolo | F13A1 |
| Símbolos alt. | F13A |
| Entrez | 2162 |
| HUGO | 3531 |
| OMIM | |
| RefSeq | NM_000129 |
| UniProt | P00488 |
| Outros datos | |
| Locus | Cr. 6 p24.2-p23 |
Factor XIII
| |
| Identificadores | |
| Símbolo | F13B |
| Entrez | 2165 |
| HUGO | 3534 |
| OMIM | |
| RefSeq | NM_001994 |
| UniProt | P05160 |
| Outros datos | |
| Locus | Cr. 1 q31-q32.1 |
O factor XIII (FXIII) de coagulación ou factor estabilizante da fibrina é un encima (EC 2.3.2.13) do sistema de coagulación do sangue que establece enlaces cruzados coa fibrina. A deficiencia deste factor afecta á estabilidade dos coágulos. A deficiencia de factor XIII, xeralmente é rara, pero en Irán dáse a maior incidencia do mundo, e na cidade de Khash a maior incidencia dentro do país, cunha alta proporción de matrimonios consanguíneos.[1]
Función[editar | editar a fonte]
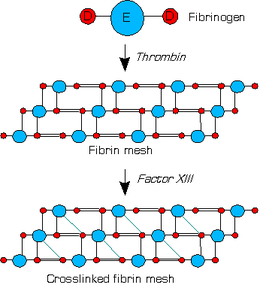
O factor XIII é unha transglutaminase que circula no plasma como un heterotetrámero con dúas subunidades catalíticas A e dúas subunidades transportadoras B. Cando a trombina converteu o fibrinóxeno en fibrina, esta última forma unha rede proteinácea na que as unidades E están enlazadas a só unha unidade D.
O factor XIII é activado pola trombina dando o factor XIIIa; esta activación require calcio como cofactor. A súa clivaxe feita pola trombina entre os residuos Arg37 e Gly38 no N-terminal da subunidade A, causa a liberación do péptido de activación (de 4 000 Da). En presenza de calcio as subunidades transportadoras disócianse das sbunidades catalíticas, orixinando un cambio na conformación tridimensional do factor XIII e a exposición do residuo de cisteína catalítica.
Despois da activación pola trombina, o factor XIIIa actúa sobre a fibrina para formar enlaces cruzados γ-glutamil-Є-lisil amida entre as moléculas de fibrina para formar un coágulo insoluble.[2][3]
Descubrimento[editar | editar a fonte]
O factor XIII tamén se denomina factor de Laki–Lorand, por Kalman Laki e Laszlo Lorand, os científicos que primeiro propuxeron a súa existencia en 1948.[4] Unha conferencia de 2005 recomendou a estandarización da nomenclatura.[5]
Xenética[editar | editar a fonte]
O cimóxeno factor XIII é unha glicoproteína tetrámera de 320 kDa que consta de dous dímeros formados cada un por dúas subunidades (2 A e 2 B),[5] cuxos xenes se encontran en distintos cromosomas:
- A subunidade A (6p25-p24) é a parte transglutaminase que engade un grupo alquilo ao nitróxeno dun residuo de glutamina, que á súa vez se une coa lisina sobre a outra cadea. O peso molecular da cadea A é de aproximadamente 83 kDa.
- A subunidade B (1q31-q32.1) non ten unha actividade encimática clara, e pode servir como un transportador para a subunidade A. O peso molecular da cadea B é de aproximadamente 76,5 kDa.
Estrutura[editar | editar a fonte]
O factor XIII ten dúas formas: unha forma plasmática que se encontra libre no plasma sanguíneo, e unha forma celular transportada dentro dos gránulos alfa das plaquetas.
A forma celular é un dímero de dúas subunidades idénticas, FXIII-A, cada unha das cales consta dun péptido de activación que é clivado despois da activación, un dominio en sándwich β, un dominio transglutaminase catalítico e dous dominios de barril β.
A forma plasmática inclúe dúas subunidades idénticas adicionais, FXIII-B, que son liberadas de maneira dependente do calcio despois da clivaxe do péptido de activación. Cada unha das FXIII-B pode ser tanto inhibidora coma servir como transportador plasmático, e consta de dez dominios sushi repetitivos unidos por dúas pontes disulfuro internas en cada unha. Durante a circulación, esta subunidade únese ao fibrinóxeno. [6]
Fisioloxía[editar | editar a fonte]
As concentracións típicas de FXIII no plasma son de 10 μg/mL (heterodímero 2A2B), mentres que as concentracións da cadea B libre son de 22 μg/mL. O FXIII ten unha longa vida media, de entre 5 e 9 días. Está presente no plasma, plaquetas e monocitos, así como macrófagos e os precursores da medula ósea deses tipos celulares.[5]
Un coágulo que non foi estabilizado por FXIIIa é soluble en 5 mol/L de urea, mentres que un coágulo estabilizado é resistente a isto.[4]
Uso diagnóstico[editar | editar a fonte]
Os niveis de factor XIII non se miden rutineiramente, pero isto pode ser considerado en pacientes cunha tendencia hemorráxica non explicada. Como o encima é bastante específico de monocitos e macrófagos, a determinación da presenza do factor XIII pode utilizarse para identificar e clasificar enfermidades malignas nas que estean implicadas esas células.[5]
Notas[editar | editar a fonte]
- ↑ Dorgalaleh A, Naderi M, Hosseini MS, Alizadeh S, Hosseini S, Tabibian S, et al. (2015). "Factor XIII Deficiency in Iran: A Comprehensive Review of the Literature. Seminars in thrombosis and hemostasis;" 41 (3 (41)): 323–329.
- ↑ Natalia Reglińska-Matveyev. The roles of cofactors protein S and factor V in the TFPI anticoagulant pathway. Páxina 22.[1]
- ↑ Dahlbäck B. Blood coagulation. Lancet. 2000 May 6;355(9215):1627-32. PMID 10821379. DOI 10.1016/S0140-6736(00)02225-X
- ↑ 4,0 4,1 Laki K, Lóránd L (September 1948). "On the Solubility of Fibrin Clots". Science 108 (2802): 280. PMID 17842715. doi:10.1126/science.108.2802.280.
- ↑ 5,0 5,1 5,2 5,3 Muszbek L, Ariëns RA, Ichinose A (January 2007). "Factor XIII: recommended terms and abbreviations". J. Thromb. Haemost. 5 (1): 181–83. PMID 16938124. doi:10.1111/j.1538-7836.2006.02182.x.
- ↑ Komáromi I, Bagoly Z, Muszbek L (Jan 2011). "Factor XIII: novel structural and functional aspects". Journal of Thrombosis and Haemostasis 9 (1): 9–20. PMID 20880254. doi:10.1111/j.1538-7836.2010.04070.x.
