Transaminación
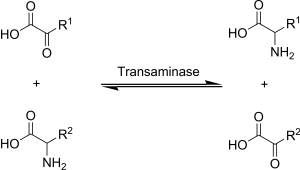
A transaminación é unha reacción química na que se trransfire un grupo amino a un cetoácido para formar novos aminoácidos. Esta ruta é tamén responsable da desaminación de moitos aminoácidos. Por esta ruta os aminoácidos esenciais transfórmanse en non esenciais.
A transaminación en bioquímica é realizada por encimas chamados transaminases ou aminotransferases. O α-cetoglutarato actúa como o aceptor predominante de grupos amino e produce glutamato como novo aminoácido.
- Aminoácido + α-cetoglutarato ↔ α-cetoácido + Glutamato
O grupo amino do glutamato, á súa vez, é transferida ao oxaloacetato nunha segunda reacción de transaminación que rende aspartato.
Mecanismo de acción[editar | editar a fonte]
- Artigo principal: Aminotransferase.
A transaminación catalizada por aminotransferases ocorre en dúas fases. Na primeira fase, o grupo α-amino dun aminoácido é transferido ao encima, producindo o correspondente α-cetoácido e o encima aminado. Durante a segunda fase, o grupo amino é transferido ao cetoácido aceptor, formando o produto aminoácido e rexenerando o encima. A quiralidade dun aminoácido queda determinada durante a transaminación. Para que se complete a reacción, as aminotransferases requiren a participación dun coencima que contén un grupo aldehido chamado piridoxal 5'-fosfato (PLP), un derivado da piridoxina (vitamina B6). O grupo amino é acomodado pola conversión do coencima PLP a piridoxamina 5'-fosfato (PMP). O PLP está unido covalentemente ao encima por un enlace de base de Schiff formado pola condensación do seu grupo aldehido co grupo ε-amino dun residuo de lisina do encima. A base de Schiff, que se conxuga ao anel de piridinio do encima é o foco da actividade do coencima.

Mecanismo de tipo Ping Pong Bi Bi da transaminación catalizada por encima dependente de PLP. A reacción de aminotransferase ocorre en dúas fases que constan de tres pasos: transaminación, tautomerización e hidrólise. Na primeira fase, o grupo alfa amino do aminoácido é transferido ao PLP rendendo un alfa cetoácido e PMP. Na segunda fase da reacción, na cal o grupo amino do PMP é transferido a un alfa-cetoácido diferente, rendendo un novo alfa-aminoácido e PLP.
O produto das reaccións de transaminación depende da dispoñibilidade de α-cetoácidos. Os produtos xeralmente son a alanina ou o aspartato ou o glutamato, xa que os seus correspondentes alfa-cetoácidos son producidos na metabolismo enerxético. A lisina, prolina e treonina son os únicos aminoácidos que non sempre sofren transaminación e usan as súas respectivas deshidroxenases.
Mecanismo alternativo[editar | editar a fonte]
Un segundo tipo de reacción de transaminación pode ser descrita como unha substitución nucleofílica dun amino ou anión amida sobre un amino ou sal de amonio.[1] Por exemplo, o ataque dunha amina primaria por un anión amida primaria pode utilizarse para preparar aminas secundarias:
- RNH2 + R'NH− → RR'NH + NH2−
Poden prepararse aminas secundarias simétricas usando níquel de Raney (2RNH2 → R2NH + NH3). E, finalmente, os sales de amonio cuaternario poden ser desalquilados usando etanolamina:
- R4N+ + NH2CH2CH2OH → R3N + RN+H2CH2CH2OH
Os aminonaftalenos tamén sofren transaminacións.[2]
Tipos de aminotransferases[editar | editar a fonte]
A transaminación está mediada por diferentes tipos de encimas aminotransferases, que poden ser específicas para cada aminoácido ou poden procesar un grupo de aminoácidos quimicamentre similares. Estas últimas actúan sobre o grupo de aminoácidos de cadea ramificada, que son a leucina, isoleucina e valina. Os dous tipos comúns de aminotransferases son a alanina aminotransferase (ALT) e a aspartato aminotransferase (AST).
Notas[editar | editar a fonte]
- ↑ Booth, Gerald (2000-01-01). Naphthalene Derivatives. Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 9783527306732. doi:10.1002/14356007.a17_009.
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Smith, M. B. e March, J. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, quinta ed. Wiley, 2001, p. 503. ISBN 0-471-58589-0
- Gerald Booth "Naphthalene Derivatives" en Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_009
- Voet & Voet. "Biochemistry" Fourth edition

