Carbocatión: Diferenzas entre revisións
Engade 1 libro para verificar) #IABot (v2.0.7) (GreenC bot |
m Correcciones ortográficas con Replacer (herramienta en línea de revisión de errores) |
||
| Liña 47: | Liña 47: | ||
:[[Ficheiro:The cyclopropyl carbinyl cation.svg|A xeración dun catión ciclopropilcarbinilo en ácido máxico]] |
:[[Ficheiro:The cyclopropyl carbinyl cation.svg|A xeración dun catión ciclopropilcarbinilo en ácido máxico]] |
||
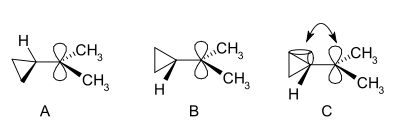
No espectro de RMN dun derivado dimetilo, encóntranse dous sinais non equivalentes para os dous grupos metilo, indicando que a [[conformación molecular]] deste catión non é perpendicular (como en A) senón que é bisecado (como en B) co orbital p baleiro e o sistema do anel ciclopropilo no |
No espectro de RMN dun derivado dimetilo, encóntranse dous sinais non equivalentes para os dous grupos metilo, indicando que a [[conformación molecular]] deste catión non é perpendicular (como en A) senón que é bisecado (como en B) co orbital p baleiro e o sistema do anel ciclopropilo no mesmo plano: |
||
:[[Ficheiro:Cyclopropylcarbinyl bisected conformation.svg|A conformación do ciclopropilcarbinil bisecado]] |
:[[Ficheiro:Cyclopropylcarbinyl bisected conformation.svg|A conformación do ciclopropilcarbinil bisecado]] |
||
Revisión como estaba o 7 de marzo de 2021 ás 19:20



Un carbocatión é un ión cun átomo de carbono con carga positiva. Entre os exemplos máis simples están o metenio CH+
3, o metanio CH+
5 e o etanio C
2H+
7. Algúns carbocatións poden ter dúas ou máis cargas positivas. As cargas poden estar situadas no mesmo átomo de carbono ou en diferentes átomos; como o dicatión de etileno C
2H2+
4.[1]
Ata o inicio da década de 1970, todos os carbocatións denominábanse ións carbonio.[2] Na química actual, un carbocatión é calquera ión cun átomo de carbono cargado positivamente, os cales se clasifican en dúas grandes categorías segundo a valencia do carbono cargado: tres nos ións carbenio (carbenos protonados), e cinco ou seis nos ións carbonio (alcanos protonados, nomeados así por analoxía co amonio). Esta nomenclatura foi proposta por G. A. Olah.[3] Os carbocatións están estabilizados pola dispersión ou deslocalización da carga positiva.
Definicións
Algúns libros de texto de nivel universitario tratan os carbocatións como se fosen só ións carbenio,[4] ou trátanos con só unha breve referencia á vella terminoloxía dos ións carbonio[5] ou carbenio.[6] Un libro de texto mantén o nome máis antigo de ión carbonio para o ión carbenio, e usa o nome ión carbenio hipervalente para o CH+
5.[7]
Historia
A historia dos carbocatións remóntase a 1891 cando G. Merling[8] informou que engadira bromo ao tropilideno (cicloheptatrieno) e despois quentara o produto para obter un material hidrosoluble cristalino, C
7H
7Br. Non suxeriu unha estrutura para el; porén, Doering e Knox[9] demostraron convincentemente que era bromuro de tropilio (cicloheptatrienilio). Este ión predise que é aromático pola regra de Hückel.
En 1902, Norris e Kehrman descubriron independentemente que o trifenilmetanol incoloro dá lugar a solucións fortemente amarelas en ácido sulfúrico concentrado. O cloruro de trifenilmetil formaba de maneira similar complexos laranxa con cloruros de estaño e aluminio. En 1902, Adolf von Baeyer recoñeceu o carácter similar aos dun sal dos compostos formados.

Denominou a relación entre a cor e a formación de sales halocromía, da cal o verde malaquita é un bo exemplo.
Os carbocatións son intermediarios reactivos en moitas reaccións orgánicas. Esta idea, proposta primeiramente por Julius Stieglitz en 1899,[10] foi desenvolvida despois por Hans Meerwein no seu estudo de 1922[11][12] do rearranxo de Wagner–Meerwein. Os carbocatións tamén se descubriu que estaban implicados na reacción SN1, a reacción E1, e nas reaccións de rearranxo ou transposición como a transposición 1,2 de Whitmore. Os químicos establecidos foron remisos a aceptar a noción de carbocatión e durante un longo tempo o Journal of the American Chemical Society rexeitou artigos que os mencionaban.
O primeiro espectro de RMN dun carbocatión estable en solución foi publicado por Doering et al.[13] en 1958. Era o ión heptametilbencenio, feito tratando hexametilbenceno con cloruro de metilo e cloruro de aluminio. O catión estable 7-norbornadienil foi preparado por Story et al. en 1960[14] facendo reaccionar cloruro de norbornadienilo con tetrafluoroborato de prata en dióxido de xofre a −80 °C. O espectro de RMN estableceu que era un ión non clásico, o primeiro observado.
En 1962, Olah observou directamente o carbocatión tert-butilo por resonancia magnética nuclear (RMN) como unha especie estable en fluoruro de tert-butilo disolvéndose en ácido máxico. A RMN do catión norbornilo foi realizada por primeira vez por Schleyer et al.[15] Saunders et al. demostraron que sufría un intercambio de protóns sobre unha barreira.[16]
Estrutura e propiedades
O carbono cargado nun carbocatión é un "sexteto", é dicir, ten só seis electróns capa de valencia externa en vez dos oito electróns de valencia que aseguran o máximo de estabilidade (regra do octeto). Por tanto, os carbocatións son a miúdo reactivos, xa que tratan de encher o seu octeto de electróns de valencia e de recuperar a súa carga neutra. Podería razoablemente asumirse que un carbocatión ten hibridación sp3 cun orbital sp3 baleiro que lle dá carga positiva. Porén, a reactividade dun carbocatión lembra máis á dun hibridación sp2 cunha xeometría molecular trigonal planar. Un exemplo é o catión metilo CH+
3.

Os carbocatións son a miúdo a diana dos ataques nucleofílicos por nucleófilos como os ións hidróxido (OH−) ou ións halóxeno.

Os carbocatións tipicamente sofren reaccións de rearranxo ou transposición desde estruturas menos estables a outras igual de estables ou máis estables con constantes de velocidade en exceso de 109 s−1. Este feito complica as vías sintéticas de moitos compostos. Por exemplo, cando se quenta o 3-pentanol con HCl acuoso, o carbocatión 3-pentilo formado inicialmente rearránxase a unha mestura estatística do 3-pentilo e 2-pentilo. Estes catións reaccionan co ión cloruro para producir aproximadamente 1/3 de 3-cloropentano e 2/3 de 2-cloropentano.
Un carbocatión pode ser estabilizado por resonancia por un enlace dobre carbono-carbono adxacente ao carbono ionizado. Tales catións como o catión alilo CH2=CH–CH2+ e bencilo C6H5–CH2+ son máis estables que a maior parte doutros carbocatións. As moléculas que poden formar carbocatións alilo ou bencilo son especialmente reactivas. Estes carbocatións nos que o C+ está adxacente a outro átomo de carbono que ten un enlace dobre ou triplo teñen unha estabilidade extra debido ao solapamento do orbital p baleiro do carbocatión cos orbitais p do enlace π. Este solapamento dos orbitais permite que a carga se comparta entre múltiples átomos (deslocalización da carga) e, por tanto, estabiliza o carbocatión. A hiperconxugación é tamén un factor estabilizador para os carbocatións. Os orbitais pi baleiros do átomo de carbono aceptan un par de electróns do carbono alfa, o cal despois adquire a carga positiva. Máis hidróxenos alfa incrementan a estabilidade do carbocatión. A orde de estabilidade tamén segue a hibridación sp3 > sp2 > sp do átomo de carbono que leva a carga positiva.
A orde de estabilidade do carbocatión é a seguinte:
- ión tropilio > catión trifenilmetilo (tritilo) > catión difenilmetilo > cabocatión tert-butilo > bencilo > alilo
Ións non clásicos
Algúns carbocatións como o catión norbornilo mostran máis ou menos simetricamente tres centros de enlace. Os catións deste tipo foron denominados ións non clásicos. A diferenza de enerxía entre os carbocatións "clásicos" e isómeros "non clásicos" adoita ser moi pequena, e en xeral hai pouca ou ningunha enerxía de activación implicada na transición entre as estruturas "clásicas" e "non clásicas". Esencialmente, a forma "non clásica" do carbocatión 2-butilo é 2-buteno cun protón directamente sobre o centro do que sería o enlace dobre carbono-carbono. Os carbocatións "non clásicos" foron antes obxectos dunha gran controversia. Unha das grandes contribucións de George Olah á química foi resolver esta controversia.[17]
Carbocatións específicos
Os catións ciclopropilcarbinilo poden ser estudados por RMN:[18][19]
No espectro de RMN dun derivado dimetilo, encóntranse dous sinais non equivalentes para os dous grupos metilo, indicando que a conformación molecular deste catión non é perpendicular (como en A) senón que é bisecado (como en B) co orbital p baleiro e o sistema do anel ciclopropilo no mesmo plano:
En termos da teoría do enlace flexionado esta preferencia explícase asumindo un solapamento electrónico favorable entre os enlaces flexionados do ciclopropano cheos e o orbital p baleiro.[20]
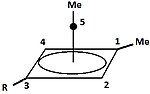
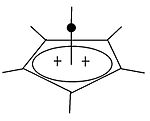
Carbocatión piramidal
| Carbocatións piramidais | ||
|---|---|---|
|
|
Ademais dos clásicos e non clásicos pode distingirse unha terceira clase de carbocatións: os carbocatións piramidais. Nestes ións un só átomo de carbono está situado por riba dun polígono de catro ou cinco lados formando así unha pirámide. O ión piramidal de catro lados levará unha carga de +1, e o piramidal de cinco lados levará unha carga de +2. |
| Un exemplo de carbocatión monovalente | Un exemplo de carbocatión divalente |
Notas
- ↑ Grützmacher, Hansjörg; Marchand, Christina M. (1997). "Heteroatom stabilized carbenium ions". Coord. Chem. Rev. 163: 287–344. doi:10.1016/S0010-8545(97)00043-X.
- ↑ Robert B. Grossman (2007-07-31). The Art of Writing Reasonable Organic Reaction Mechanisms. Springer Science & Business Media. pp. 105–. ISBN 978-0-387-95468-4.
- ↑ Olah, George A. (1972). "Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions". J. Am. Chem. Soc. 94 (3): 808–820. doi:10.1021/ja00758a020.
- ↑ McMurry, John (1999). Organic chemistry (5th ed.). ISBN 0-534-37617-7.
- ↑ Yurkanis Bruice, Paula. Organic Chemistry (4th ed.). ISBN 0-13-140748-1.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- ↑ Fox, Marye Anne; Whitesell, James K. Organic Chemistry. ISBN 0-7637-0413-X.
- ↑ Merling, G. (1891). "Ueber Tropin". Berichte der deutschen chemischen Gesellschaft 24 (2): 3108–3126. ISSN 0365-9496. doi:10.1002/cber.189102402151.
- ↑ Doering, W. von E.; Knox, L. H. (1954). "The Cycloheptatrienylium (Tropylium) Ion". J. Am. Chem. Soc. 76 (12): 3203–3206. doi:10.1021/ja01641a027.
- ↑ "On the Constitution of the Salts of Imido-Ethers and other Carbimide Derivatives". Am. Chem. J. 21: 101. ISSN 0096-4085.
- ↑ Meerwein, H.; Emster, K. van (1922). "About the equilibrium isomerism between bornyl chloride isobornyl chloride and camphene chlorohydrate". Berichte 55: 2500.
- ↑ Rzepa, H. S.; Allan, C. S. M. (2010). "Racemization of Isobornyl Chloride via Carbocations: A Nonclassical Look at a Classic Mechanism". Journal of Chemical Education 87 (2): 221. Bibcode:2010JChEd..87..221R. doi:10.1021/ed800058c.
- ↑ Doering, W. von E.; Saunders, M.; Boyton, H. G.; Earhart, H. W.; Wadley, E. F.; Edwards, W. R.; Laber, G. (1958). "The 1,1,2,3,4,5,6-heptamethylbenzenonium ion". Tetrahedron 4 (1–2): 178–185. doi:10.1016/0040-4020(58)88016-3.
- ↑ Story, Paul R.; Saunders, Martin (1960). "The 7-norbornadienyl carbonium ion". J. Am. Chem. Soc. 82 (23): 6199. doi:10.1021/ja01508a058.
- ↑ Schleyer, Paul von R.; Watts, William E.; Fort, Raymond C.; Comisarow, Melvin B.; Olah, George A. (1964). "Stable Carbonium Ions. X.1 Direct Nuclear Magnetic Resonance Observation of the 2-Norbornyl Cation". J. Am. Chem. Soc. 86 (24): 5679–5680. doi:10.1021/ja01078a056.
- ↑ Saunders, Martin; Schleyer, Paul von R.; Olah, George A. (1964). "Stable Carbonium Ions. XI.1 The Rate of Hydride Shifts in the 2-Norbornyl Cation". J. Am. Chem. Soc. 86 (24): 5680–5681. doi:10.1021/ja01078a057.
- ↑ George A. Olah - Nobel Lecture
- ↑ Kabakoff, David S.; Namanworth, Eli (1970). "Nuclear magnetic double resonance studies of the dimethylcyclopropylcarbinyl cation. Measurement of the rotation barrier". J. Am. Chem. Soc. 92 (10): 3234–3235. doi:10.1021/ja00713a080.
- ↑ Pittman Jr., Charles U.; Olah, George A. (1965). "Stable Carbonium Ions. XVII.1a Cyclopropyl Carbonium Ions and Protonated Cyclopropyl Ketones". J. Am. Chem. Soc. 87 (22): 5123–5132. doi:10.1021/ja00950a026.
- ↑ Carey, F.A.; Sundberg, R.J. Advanced Organic Chemistry Part A (2nd ed.).
Véxase tamén
| Wikimedia Commons ten máis contidos multimedia na categoría: Carbocatión |
Outros artigos
Ligazóns externas
- Press Release The 1994 Nobel Prize in Chemistry". Nobelprize.org. 9 de xuño de 2010